کربن
گرافیت (راست) و الماس (چپ) ، دو دگرشکل کربن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کربن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| دگرشکلی | گرافیت، الماس، دگرشکلهای کربن | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | (۱۲٫۰۰۹۶، ۱۲٫۰۱۱۶) conventional: ۱۲٫۰۱۱ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کربن در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | ۱۴ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره ۲ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | نافلز, به عنوان یک شبهفلز در نظر گرفته میشود. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [He] 2s2 2p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲٬۴ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه تصعید | ۳۹۱۵ K (۳۶۴۲ °C, ۶۵۸۸ °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | آمورف: ۱٫۸–۲٫۱ g/cm3[۱] گرافیت: ۲٫۲۶۷ g/cm3 الماس: ۳٫۵۱۵ g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه سهگانه | ۴۶۰۰ K, ۱۰٬۸۰۰ kPa[۲][۳] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | گرافیت: ۱۱۷ kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | گرافیت: ۸٫۵۱۷ J/(mol·K) الماس: ۶٫۱۵۵ J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −4, −3, −2, −1, 0, +1,[۴] +2, +3,[۵] +4[۶] (یک اکسید اسیدی ملایم) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: ۲٫۵۵ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm sp3: ۷۷ pm sp2: ۷۳ pm sp: ۶۹ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | ۱۷۰ pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | گرافیت: دستگاه بلوری ششگوشه (سیاه) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | الماس: (شفاف) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | الماس: ۱۸٬۳۵۰ m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | الماس: ۰٫۸ µm/(m·K) (at 25 °C)[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | گرافیت: ۱۱۹–۱۶۵ W/(m·K) الماس: ۹۰۰–۲۳۰۰ W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | گرافیت: ۷٫۸۳۷ µΩ·m[۸] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | دیامغناطیس[۹] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| پذیرفتاری مغناطیسی | ۱۰-۶×۵.۹- (graph.) cm3/mol[۱۰] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | الماس: ۱۰۵۰ GPa[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | الماس: ۴۷۸ GPa[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | الماس: ۴۴۲ GPa[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبت پواسون | الماس: ۰٫۱[۷] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | گرافیت: ۱–۲ الماس: ۱۰ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | مصر باستان و سومر[۱۱] (۳۷۵۰ پیش از میلاد) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نام بردن به عنوان یک عنصر | آنتوان لاووازیه[۱۲] (۱۷۸۹) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای کربن | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
کربن عنصری شیمیایی با نماد C و عدد اتمی ۶ است. واژه کربن برگرفته از واژهای لاتین بهنام کربو[a] به معنای زغالسنگ است. این عنصر، که در ردهٔ عناصر غیرفلزی جای میگیرد، چهارظرفیتی است به این معنی که چهار الکترون در دسترس برای تشکیل پیوندهای شیمیایی کووالانسی دارد. کربن از گروه چهاردهم در جدول تناوبی و دارای سه ایزوتوپ طبیعی است. این ایزوتوپها عبارتاند از کربن-۱۲ و کربن-۱۳ که ایزوتوپهای پایداری هستند و کربن-۱۴ یک ایزوتوپ پرتوزا محسوب میشود و زمان نیمهعمر واپاشی آن حدود ۵۷۳۰ سال است. از دوران باستان تا سال ۱۶۹۹ میلادی، تنها سیزده عنصر توسط بشر شناسایی شده بودند که کربن یکی از آنها بود.
از نظر فراوانی، کربن پانزدهمین عنصر در پوسته زمین و پس از هیدروژن، هلیوم و اکسیژن، چهارمین عنصر در کیهان است. فراوانی کربن، گوناگونی منحصر به فرد ترکیبات آلی ساخته شده از آن و توانایی تشکیل بسپار در دماهای متداول قابل دسترسی بر روی زمین، موجب میشود که این عنصر بهعنوان عنصر مشترک در تمامی انواع شکلهای شناخته شده از زندگی وجود داشته باشد. این عنصر به لحاظ جرم، پس از اکسیژن، دومین عنصر موجود در بدن انسان است و حدود ۱۸٫۵ درصد از جرم بدن انسان را تشکیل میدهد
اتمهای کربن میتوانند به صورتهای مختلفی با یکدیگر پیوند برقرار نمایند که این موجب میشود تا دگرشکلهای متنوعی از کربن تشکیل شود. شناخته شدهترین دگرشکلهای کربنی، گرافیت، الماس و فولرن باکمینستر هستند. خواص فیزیکی کربن در هر کدام از دگرشکلهای کربنی متفاوت است. بهعنوان مثال گرافیت دارای ظاهری کدر و سیاهرنگ است، در حالیکه الماس کاملاً شفاف است. گرافیت به قدری نرم است که میتواند برروی کاغذ اثری از خود برجا بگذارد و خود واژه گرافیت نیز از واژهای یونانی بهمعنای نوشتن[b] برگرفته شدهاست. درحالیکه الماس، سختترین ترکیب طبیعی یافت شده بر روی زمین است. گرافیت یک هدایت کننده خوب جریان الکتریکی است، درحالی که الماس یک رسانای ضعیف جریان الکتریکی است. در فشار معمولی، الماس، نانولولههای کربنی و گرافین، دارای بالاترین رسانندگی گرمایی در بین تمام ترکیبات شناخته شده هستند. آنها در مقابل تغییرات شیمیایی مقاوم هستند و برای این که با اکسیژن وارد واکنش شوند یا به عبارت دیگر برای این که سوزانده شوند، به دمای بالا نیاز دارند.
متداولترین حالت اکسایشی کربن در ترکیبات معدنی برابر با ۴+ است، در حالیکه عدد اکسایش ۲+ در موردی مانند کربن مونوکسید و کمپلکسهای کربونیلی فلزات واسطه قابل مشاهده است. سنگ آهک، دولومیت و دیاکسید کربن از بزرگترین منابع کربن معدنی هستند. این در حالی است که مقادیر قابل توجهی از کربن بهصورت ذخیره شده در منابع آلی مانند زغالسنگ، پوده، نفت خام و آذریخ وجود دارد. کربن طیف گستردهای از ترکیبات را شامل میشود، بهطوری که دامنه آن گسترهتر از هر عنصر دیگری است. تا بهامروز بیش از ده میلیون ترکیب آلی ثبت شدهاست و مسیر شناسایی ترکیبات جدیدتر همچنان باز است، چرا که این تعداد ترکیب کشف شده تنها بخشی از ترکیبات مجموعه ترکیبات کربنی فرضی ممکن و پایدار در شرایط استاندارد هستند و به همین علت از کربن بهعنوان «پادشاه عناصر»[c] یاد شود.
تاریخچه
[ویرایش]

ریشهٔ نام کربن از واژهٔ لاتین کربو به معنای زغالسنگ یا زغال چوب گرفته شدهاست.[۱۳] کشف کربن به دوران پیشاتاریخ بر میگردد و استفاده از آن به صورت دوده و زغال چوب در زندگی نخستین تمدنهای بشری مشهور بود. الماس شکل دیگری از کربن احتمالاً در اوایل سال ۲۵۰۰ پیش از میلاد در چین شناخته شده بود و به صورت شیمیایی امروزی، در دوران روم باستان از زغال چوب ساخته میشد. همچنین از مخلوط آن با خاک رس در اهرام به منظور پوششی در برابر ورود هوا استفاده میشدهاست.[۱۴][۱۵]
در سال ۱۷۲۲، رنه آنتوان فرشاکو دی رامور نشان داد که آهن با جذب برخی از مواد به فولاد تبدیل میشود، که امروزه بهعنوان کربن شناخته شدهاست.[۱۶] در سال ۱۷۷۲، آنتوان لاووازیه، پدر علم شیمی نوین نشان داد که الماسها، نوعی کربن هستند. او با سوزاندن زغالسنگ و الماس دریافت که پس از سوختن هیچکدام آبی تولید نمیکنند و هر دو به مقدار یکسان دیاکسید کربن در هر گرم آزاد میکنند.[۱۷] زمانی که تصور میشد گرافیت شکل دیگری از سرب است، کارل ویلهلم شیله نشان داد که گرافیت درواقع همانند زغال چوب است با این تفاوت که دارای مخلوط کوچکی از آهن است. از آنجا که که گرافیت در زمان واکنش با نیتریک اسید موجب تولید دیاکسید کربن میشود، او نام اسید هوایی[d] را روی آن گذاشت.[۱۸]
در سال ۱۷۸۶، دانشمندان فرانسوی، کلود لویی برتوله، گاسپار مونژ و سی. اِی. واندرموند[e] با اکسید کردن گرافیت به همان روشی که لاووازیه برای الماس انجام داده بود تأیید کردند که گرافیت بیشتر کربن است.[۱۹] با باقی ماندن مقداری آهن در انتها، آنها بر این باور شدند که آهن در ساختار گرافیت لازم است. آنها در نگارشهای خود برای گازی که از سوختن گرافیت خارج میشد نام کاربون [f] را پیشنهاد دادند که از واژه لاتین کاربونوم[g] گرفته شده بود. در سال ۱۷۸۹ لاووازیه در کتابهای درسی از کربن بهعنوان یک عنصر نام برد.[۲۰]
در سال ۱۹۸۵ شیمیدانهای آمریکایی رابرت کرل و ریچارد اسمالی و شیمیدان بریتانیایی هارولد کروتو موفق به کشف فولرن، یکی از دگرشکلهای مصنوعی عنصر کربن شدند[۲۱] که خود انواع گوناگون و متعددی شامل اشکال نانوساختار مانند باکیبالها و نانولولهها است.[۲۲] کاشفان این شکل جدید از کربن در سال ۱۹۹۶ جایزه نوبل شیمی را دریافت کردند.[۲۳] از طرف دیگر علاقه جدید به اشکال جدید منجر به کشف دگرشکلهای بیشتر از جمله کربن شیشهای، و کربن آمورف شد.[۲۴]
ویژگی
[ویرایش]
کربن با داشتن عدد اتمی ۶، بهعنوان عنصر ششم محسوب میشود و دارای آرایش الکترونی ۱s۲۲s۲۲p۲ است که چهار الکترون موجود در اوربیتالهای ۲s و ۲p بهعنوان الکترونهای ظرفیت آن بهحساب میآیند، الکترونهایی که میتوانند موجب تشکیل پیوندهای کووالانسی و ساخته شدن پیوندهای بین اتمی و درنتیجه ترکیبات مولکولی جدید شوند. چهار انرژی یونش ابتدایی کربن عبارتاند از: ۱۰۸۰٫۵، ۲۳۵۲٫۶، ۴۶۲۰٫۵ و ۶۲۲۲٫۷ کیلوژول بر مول که این مقادیر انرژی یونش بسیار بیشتر از سایر عناصر موجود در گروه چهاردهم جدول تناوبی (عناصر زیرین در گروه شامل کربن) هستند. میزان الکترونگاتیوی کربن در مقیاس پائولینگ[h] برابر با ۲٫۵ است که بهطور قابل توجهی از مقدار الکترونگاتیوی سایر عناصر همگروه با کربن (۱٫۸–۱٫۹) در گروه چهاردهم جدول تناوبی بیشتر و تقریباً مشابه نیتروژن و فلزات واسطه ردیف دوم و سوم جدول تناوبی است. شعاع پیوند کووالانسی کربنی معمولاً برابر با ۷۷٫۲ پیکومتر برای پیوند کربن-کربن یگانه، ۶۶٫۷ پیکومتر برای پیوند کربن-کربن دوگانه، ۶۰٫۳ پیکومتر برای پیوند کربن-کربن سهگانه است، با اینحال این مقادیر مطلق نیستند و بسته به نوع عدد کوئوردیناسیون و نوع پیوندهای دو اتم کربن درگیر در پیوند مورد نظر، متفاوت هستند. بهطور عمومی، شعاع کووالانسی، با کاهش عدد کوئوردیناسیون و افزایش مرتبه پیوند، کاهش مییابد.[۲۵]
کربن دارای بالاترین دمای تصعید در میان تمام عناصر است. در فشار معمولی اتمسفر، فاقد نقطه ذوب است، چراکه نقطه سهگانه آن در فشار ۰٫۲±۱۰٫۸ مگاپاسکال و دمای ۳۰۰±۴۶۰۰ درجه کلوین (۳۰۰±۴۳۳۰ درجه سانتیگراد؛ ۵۴۰±۷۸۲۰ درجه فارنهایت) بهوقوع میپیوندد[۲][۳] و درنتیجه، کربن در دمایی در حدود ۳۹۰۰ درجه کلوین (۳۶۳۰ درجه سانتیگراد؛ ۶۵۶۰ درجه فارنهایت) تصعید میشود.[۲۶][۲۷] کربن در حضور یک قوس کربنی تصعید میشود، جایی که دمای آن به حدود ۵۸۰۰ درجه کلوین (۵۵۳۰ درجه سانتیگراد؛ ۹۹۸۰ درجه فارنهایت) میرسد. صرف نظر از نوع، تمامی دگرشکلهای کربنی در دماهایی حتی بالاتر از نقطه ذوب فلزاتی مانند تنگستن و رنیوم، جامد باقی میماند. اگرچه کربن از لحاظ ترمودینامیکی تمایل به اکسید شدن دارد، با این حال در مقابل اکسایش به طرز بسیار موثرتر از فلزاتی مانند آهن و مس مقاومت میکند.[۲۸] در شرایط استاندارد، گرافیت با اینکه پایداری ترمودینامیکی بالاتری در مقایسه با الماس دارد، اما واکنشپذیرتر است؛ چراکه دارای پیوندهای پای نامستقر است و این موجب میشود راحتتر وارد واکنش شیمیایی شود. بهعنوان مثال، در شرایط استاندارد، گرافیت میتواند توسط نیتریک اسید غلیظ و داغ اکسید شود و ملیتیک اسید تولید کند. در طی چنین واکنشی، واحدهای ششگوشه موجود در ساختار گرافیت حفظ میشود، اما ساختار و نظم کلی آن شکسته میشود.[۲۹]
کربن میتواند به آسانی با اتمهای کوچک دیگر از جمله اتمهای کربن دیگر پیوند برقرار کند. اتم کربن قادر است که پیوندهای کووالانسی پایدار و متنوعی با اتمهای مناسب چندظرفیتی دیگر شکل دهد. کربن با داشتن بیش از ده میلیون ترکیب شناخته شده، در بین تمامی عناصر جدول تناوبی، دارای بیشترین میزان ترکیبات شیمیایی است.[۳۰] اگرچه کربن دارای تعداد بسیار زیاد و گوناگون از ترکیبات است، اغلب این ترکیبات در دمای معمولی واکنش ناپذیر هستند. در دما و فشار استاندارد، کربن در مقابل تمامی تغییرات شیمیایی مقاومت میکند با اینحال اکسیدکنندههای قوی میتوانند موجب واکنش پذیری آن شوند. کربن در مقابل سولفوریک اسید، هیدروکلریک اسید، کلر، و تمامی قلیاها، واکنش ناپذیر است.[۳۱] در دماهای بالاتر از دمای استاندارد، کربن با اکسیژن وارد واکنش میشود و منجر به تولید اکسوکربنها میشود و در این شرایط چنانچه در کنار اکسیدهای فلزی قرار بگرید، با گرفتن اکسیژن آنها، موجب تبدیل آنها به اکسید فلز به شکل عنصر فلزی میشود.[۳۲]
ایزوتوپها
[ویرایش]در واقع همگی اتمهای کربن دارای شش پروتون هستند و تفاوت آنها در داشتن تعداد متفاوتی از نوترونها است، نوترونهایی که تعدادشان میتواند از ۲ تا ۱۶ متغیر باشد. از میان تمامی ایزوتوپهای کربن، تنها دو مورد، ایزوتوپ طبیعی و پایدار محسوب میشوند که دارای بیشترین میزان فراوانی نیز هستند.[۳۳] از این میان، این دو ایزوتوپ، ایزوتوپ کربن-۱۲ حدود ۹۸٫۹۳ درصد از کربن موجود بر روی زمین را تشکیل میدهد و ایزوتوپ کربن-۱۳، سهمی برابر ۱٫۰۷ درصد را دارا است.[۳۳] میزان کربن-۱۲ در ترکیبات زیستی حتی از مقدار ذکر شده نیز بیشتر میشود چرا که در واکنشهای زیستشیمیایی، تمایل زیادی برای کربن-۱۲ نسبت به کربن-۱۳ وجود دارد.[۳۴] در سال ۱۹۶۱، اتحادیهٔ بینالمللی شیمی محض و کاربردی، ایزوتوپ کربن-۱۲ را بهعنوان مبنای تعیین جرم اتمی نسبی عناصر انتخاب کرد.[۳۵] در طیفسنجی رزونانس مغناطیسی هستهای از کربن-۱۳ برای شناسایی ساختمان شیمیایی ترکیبات کربنی استفاده میشود.[۳۶]
کربن-۱۴ دیگر ایزوتوپ کربن است که بهصورت طبیعی یک ایزوتوپ پرتوزا است که توسط واکنش پرتوهای کیهانی با نیتروژن در لایه بالایی جو (در بخشهای پایینی استراتوسفر و بالایی تروپوسفر) ایجاد میشود.[۳۷] این ایزوتوپ در مقادیر بسیار ناچیزی برابر ۱ قسمت در تریلیون[i] (۰٫۰۰۰۰۰۰۰۰۰۱ درصد) بهویژه در جو و انباشتهها سطحی مانند پوده و دیگر مواد آلی یافت میشود.[۳۸] کربن-۱۴ با انتشار پرتوی بتایی با بار منفی و انرژی ۰٫۱۵۸ مگاالکترونولت (MeV) فروپاشیده میشود. بهعلت زمان فروپاشی نسبتاً آهسته این ایزوتوپ، کربن-۱۴ عملاً در میان سنگهای قدیمی یافت نمیشود. مقدار این ایزوتوپ در جو زمین و همچنین در بدن موجودات زنده تقریباً ثابت است، اما بهصورت مشخصی بعد از مرگ موجودات زنده، مقدار آن در بدن آنها کاهش مییابد.[۳۹][۴۰]
بیش از ۱۵ نوع ایزوتوپ کربن شناخته شده وجود دارد که از میان آنها کمترین نیمهعمر به کربن-۸ تعلق دارد، ایزوتوپی که با نشر پروتون و واپاشی آلفا دارای نیمهعمری معادل ۲۱-۱۰×۱٫۹۸۷۳۹ ثانیه دارد.[۴۱] کربن-۱۹ یکی دیگر از ایزوتوپهای غیرعادی کربن است که دارای هاله هستهای[j][توضیح ۱] است. به این معنی که اگر هسته را معادل یک کره دارای چگالی واحد در نظر بگیریم، هسته این ایزوتوپ بزرگتر از حد مورد انتظار است.[۴۲]
مدل اتمی
[ویرایش]
اتم کربن در حالت پایه دارای اوربیتالهای اتمی با آرایش الکترونی ۱s۲۲s۲۲px۱۲py۱۲pz۰ است. یک اتم کربن میتواند با تغییر سطح انرژی اوربیتالهای اتمی خود طی فرایندی موسوم به هیبریداسیون اوربیتالی، منجر به همتراز شدن اوربیتالهای لایه ظرفیت خود و همچنین چینش مجدد الکترونهای این اوربیتالها شود. اوربیتالهای هیبریدی نیمه پر ایجاد شده از این طریق، امکان برقراری پیوند با اتمهای دیگر را دارند که برای اتم کربن با توجه به وجود چهار اوربیتال نیمهپر، امکان تشکیل حداکثر چهار پیوند کووالانسی وجود دارد. یک اتم کربن، بسته به میزان مشارکت ۳ اوربیتال پی (p) در فرایند هیبریداسیون، میتواند متحمل سه نوع هیبریداسیون شود. به این ترتیب که مشارکت سه اوربیتال پی در فرایند هیبریداسیون موجب ایجاد هیبریداسیون sp۳، مشارکت دو اوربیتال پی موجب شکلگیری هیبریداسیون sp۲ و چنانچه تنها یکی از اوربیتالهای پی در فرایند هیبریداسیون شرکت کند، هیبریداسیون اتم مورد نظر از نوع sp میشود. علاوهبر هیبریداسیون متفاوت، نوع پیوندهایی که یک اتم کربن قادر به برقراری آنها است نیز میتواند متفاوت باشد که آنها نیز به نوبه خود به سه نوع؛ پیوند یگانه (C-C)، دوگانه (C=C) و سهگانه (C≡C) تقسیم میشوند. این که یک اتم در کدام نوع پیوند مشارکت کند، به هیبریداسیون آن بستگی دارد. بهعنوان مثال اگر هیبریداسیون اتم کربن از نوع sp۳ باشد، نوع پیوند آن یگانه، برای هیبریداسیون sp۲، نوع پیوند دوگانه و در مورد هیبریداسیون sp، نوع پیوند سهگانه خواهد بود.[۴۳]
هیبریداسیون sp۳
[ویرایش]هیبریداسیون sp۳ ناشی از مشارکت سه اوربیتال اتمی پی (px.py.pz) و یک اوربیتال اتمی اس (s) است. در میان دگرشکلهای کربن، الماس یکی از ساختارهایی است که اتمهای تشکیل دهنده آن، دارای هیبریداسیون sp۳ و درنتیجه پیوندهای یگانه است. ساختار بلوری مکعب الماس الگوی تکراری از ۸ اتم است که برخی مواد ممکن است هنگام جامد شدن از آن استفاده کنند. در حالی که اولین نمونه شناخته شده از این نوع ساختار، الماس بودهاست، سایر عناصر گروه ۱۴ نیز این ساختار را به خود میگیرند، از جمله آلفا-قلع، نیمرساناهای سیلیسیم و ژرمانیوم و همچنین آلیاژهای سیلیسیم و ژرمانیم. تمام اتمها در این ساختار، اتمهای مشابهی هستند که توسط پیوندهای کووالانسی به یکدیگر متصل شدهاند. این ساختار شبیه یک ساختار مکعبی با وجوه مرکز پر به اضافه چهار اتم داخلی است.[۴۴]
-
هیبریداسیون sp۳
-
سلول واحد الماس
هیبریداسیون sp۲
[ویرایش]هیبریداسیون sp۲ ناشی از مشارکت دو اوربیتال اتمی پی (px.py) و یک اوربیتال اتمی اس (s) است. از بین دگرشکلهای کربن، گرافیت یکی از مواردی است که اتمهای تشکیل دهنده آن، دارای هیبریداسیون sp۲ و درنتیجه پیوندهای دوگانه است. گرافیت دارای ساختاری لایهای است و در آن هر اتم کربن به سه اتم کربن دیگر متصل است. در اطراف هر اتم کربن یک آرایش سه ضلعی مسطح با زاویه ۱۲۰ درجه به وجود میآید.[۴۵][۴۶] از اتصال ۶ اتم کربن ساختارهایی ششگوشه ایجاد میشود که از اتصال آنها به یکدیگر صفحاتی مشبک به وجود میآید. پیوند بین مولکولی در صفحات بسیار قوی بوده ولی بین صفحات نیروی ضعیف واندروالسی وجود دارد که موجب لغزیدن یا جدا شدن لایهها میگردد.[۴۷] آلفا-هگزاگونال و بتا-رامبوهدرال دو شکل شناخته شده گرافیت، ویژگیهای فیزیکی بسیار مشابهی دارند.[۴۸][۴۹] فرم آلفا میتواند با استفاده از روشهای مکانیکی به فرم بتا تبدیل شود و فرم بتا هنگامی که بالاتر از ۱۳۰۰ درجه سانتیگراد گرم شود، به فرم آلفا بازمیگردد.[۵۰]
-
هیبریداسیون sp۲
-
ساختار بلوری گرافیت
هیبریداسیون sp
[ویرایش]هیبریداسیون sp ناشی از مشارکت تنها یک اوربیتال اتمی پی (px ،py یا pz) و یک اوربیتال اتمی اس (s) است. از بین دگرشکلهای کربن، ترکیب سیکلو(۱۸)کربن گونهای است که اتمهای تشکیل دهنده آن، دارای هیبریداسیون sp و درنتیجه پیوندهای سهگانه است. سیکلو(۱۸)کربن مولکولی است که ساختاری حلقوی دارد و متشکل از ۱۸ اتم کربن دارای پیوندهای سهگانه یکی در میان است. این ساختار، کوچکترین ترکیب از خانواده سیکلو[n]کربنها است و طبق محاسبات انجام شده با داشتن انرژی فشار حلقه[k] برابر ۷۲ کیلوکالری بر مول، پیشبینی میشود که یک ترکیب پایدار از لحاظ ترمودینامیکی باشد. رایجترین پیوندهای سهگانه بین دو اتم کربن، در آلکینها دیده میشود. سیانیدها و ایزوسیانیدها نیز پیوند سهگانه دارند. برخی مولکولها دواتمی مانند دینیتروژن و کربن مونوکسید نیز پیوند سهگانه دارند. این پیوند در فرمول اسکلتی با سه خط افقی (≡) نمایش داده میشود.[۵۱][۵۲][۵۳]
-
هیبریداسیون sp
دگرشکلها
[ویرایش]
d.e.f. فولرنها (C۷۰ ،C۵۴۰ ،C۶۰) g. کربن بیشکل، h. نانولوله کربنی
گرافیت که یکی از دگرشکلهای کربن محسوب میشود، یکی از نرمترین مواد شناخته شده و الماس که دگرشکل دیگر کربن است، سختترین ترکیب طبیعی شناخته شده بر روی زمین است. دگرشکلهای کربنی طیف وسیعی از خواص فیزیکی و شیمیایی را منجر میشوند. کربن اتمی دارای عمری کوتاه است که این موضوع موجب میشود شکلهای متنوع مولکولی یا همان دگرشکلهای کربنی شکل بگیرند. سه دگرشکل شناخته شده کربن عبارتاند از کربن بیشکل گرافیت و الماس. دگرشکل دیگر کربن، فولرن است که زمانی گونهای خاص و عجیب بهشمار میآمد اما امروزه بهصورت متداول تهیه و در تحقیقات علمی مورد استفاده قرار میگیرد. خانواده دگرشکلهای فولرنی خود شامل فولرن باکمینستر،[۲۲][۵۴] نانولوله کربنی،[۵۵] نانوجوانه کربنی[۵۶] و نانوالیاف کربنی[۵۷][۵۸] است. علاوهبر دگرشکلهای مرسوم، چندین نوع دگرشکل غیرمعمول نیز از کربن شناخته شدهاست که عبارتاند از لونسدالیت،[۵۹] کربن شیشهای،[۲۴] نانوفوم کربنی[۶۰] و کربن استیلنی خطی یا همان کاربین.[۶۱]
گرافن یکی دیگر از دگرشکلهای کربنی است که متشکل از ورقهای دوبعدی و ساخته شده از ساختارهای ششگوشه کربنی است. تا سال ۲۰۰۹، گرافن بهعنوان محکمترین ماده بررسی شده بود.[۶۲] فرایند جداسازی گرافن از گرافیت، نیازمند توسعه فناوری به منظور تجاری سازی تولید آن است.[۶۳]
کربن بیشکل، بهعنوان دگرشکلی از کربن، فرمی است که در آن اتمهای کربن در ساختاری غیربلوری، نامنظم و شیشهای مانند قرار گرفتهاند. این نوع کربن بهصورت پودری است و جزء اصلی تشکیل دهنده زغال، کربن سیاه، دوده و کربن فعال است.[۶۴]
در فشار رایج، کربن ساختاری مانند گرافیت به خود میگیرد، بهطوری که هر اتم به صورت مثلثی با سهاتم دیگر پیوند برقرار میکند و منجر به تولید یک صفحه مسطح متشکل از واحدهای حلقوی ششگوشه درست همانند هیدروکربنهای آروماتیک میشود.[۶۵] ساختار بهوجود آمده یک شبکه دوبعدی از اتمهای کربن است و این صفحات مسطح کربنی میتوانند با کمک نیروی واندروالسی بر روی یکدیگر قرار بگیرند. استحکام پایین پیوند میان این صفحات قرار گرفته بر روی یکدیگر، موجب لغزش آسان صفحات بر روی یکدیگر و نرمی گرافیت میشود. نیروی واندروالسی میان لایهها براثر همپوشانی الکترونهای خارجی اتمهای تشکیل دهنده لایهها است و این همپوشانی منجر به تشکیل یک ابر پای و عدم استقرار الکترونی میشود. وجود ابر ناشی از عدم استقرار الکترونی، باعث میشود که گرافیت بتواند تنها در محل تشکیل پیوندهای نامستقر و در راستای صفحات خود، هادی جریان الکتریکی باشد. این محدودیت سبب میشود که خصلت هدایت الکتریکی توده کربن در مقایسه با اغلب فلزات کمتر باشد. عدم استقرار الکترونی همچنین موجب میشود که گرافیت در مقایسه با الماس، پایداری بیشتری در دمای اتاق داشته باشد.[۶۶]
در فشارهای بالا، کربن دگرشکلهای فشردهتری مانند الماس را تشکیل میدهد که تقریباً دارای چگالی دوبرابر گرافیت است. برخلاف گرافیت، در ساختار الماس، هر اتم بهصورت چهاروجهی با چهار اتم دیگر پیوند برقرار میکند و منجر به تشکیل یک شبکه سه بعدی از حلقههای شش عضوی منقبض شده میشود. الماس همانند سیلیسیم و ژرمانیم، دارای ساختار مکعبی است و بهعلت قدرت پیوندهای کربن-کربن، سختترین ماده طبیعی شناخته شده در مقابل خراشیده شدن است. برخلاف باور عمومی که بیان میکند «الماسها تا ابد باقی میمانند»، الماس در شرایط استاندارد (دما: ۲۹۸ کلوین، فشار: ۱۰٬۰۰۰ پاسکال[۶۷]) از نظر ترمودینامیکی ناپایدار است (انرژی استاندارد تشکیل گیبس (ΔfG°) برای الماس در دمای ۲۹۸ کلوین = ۲٫۹ کیلوژول بر مول[۶۸]) و در نهایت به گرافیت تبدیل میشود. باتوجه به سد انرژی بالای فعالسازی، تبدیل الماس به گرافیت در دمای اتاق بهقدری آهسته است که قابل تشخیص نیست. باقیمانده کربنی که دچار تغییر فاز شدهاست بهصورت تجربی مورد بررسی قرار نگرفتهاست اما مطالعات نظری اخیر با استفاده از روش نظریه تابعی چگالی به این نتیجه رسیدهاست که در شرایط رسیدن دما و فشار بهترتیب به صفر کلوین و صفر پاسکال، الماس به ساختاری با استحکامی در حدود ۱/۱ کیلوژول بر مول بیشتر از گرافیت تبدیل میشود. تحت برخی شرایط، کربن به لونسدالیت متبلور میشود، ساختاری که یک شبکه بلوری ششگوشه است و در آن، همه اتمها، همانند آنچه در الماس رخ میدهد، بهصورت کووالانسی با یکدیگر پیوند برقرار میکنند.[۵۹]
فولرنها، بلورهایی سنتزی با ساختای مشابه گرافیت هستند با این تفاوت که تمام واحدهای تشکیل دهنده، از ششگوشههای مسطح ساخته نشدهاند و تعدادی واحد ششگوشه نامسطح، پنجگوشه و حتی هفتگوشه نیز در ساختار آنها وجود دارد. صفحات سازنده فولرنها بهصورت کره، بیضی یا استوانهای شکل میگیرند. خواص خانواده ترکیبات فولرنی هنوز بهصورت کامل ارزیابی نشدهاست و این موضوع خود زمینه وسیعی در تحقیقات نانومواد را به خود اختصاص دادهاست. فولرن یا نام متداول دیگر آن یعنی باکیبال، برگرفته از نام باکمینستر فولر و مخترع گنبد ژئودزیک است، گنبدی که دارای ساختاری مشابه با فولرنها است. باکیبالها دارای ساختارهای مولکولی بزرگی از کربن هستند که که اتمهای کربن در آنها بهصورت مثلثی با یکدیگر پیوند دادهاند و موجب شکلگیری یک ساختار گویوار شدهاند، شناخته شدهترین و سادهترین نوع فولرن، فولرن باکمینستر با ۶۰ اتم کربن است که دارای ساختاری شبیه توپ فوتبال است.[۲۲]
نانولولههای کربنی همانند باکیبالها هستند با این تفاوت که هر اتم کربن در صفحه کربنی ساخته شده بهصورت مثلثی با سه اتم دیگر در پیوند است و موجب ایجاد ساختاری استوانهای شکل و توخالی میشود.[۵۴][۵۵] نانوجوانهها برای اولینبار در سال ۲۰۰۷ گزارش شدند و ترکیبی از باکیبالها و نانولولهها هستند، به این صورت که باکیبالها بهصورت کووالانسی به سطح خارجی یک نانولوله متصل شدهاند که این موجب تجمیع خواص این دو گونه در غالب یک ساختار واحد میشود.[۵۶]
گرافیت
|
الماس
|
| از نرمترین ترکیبات شناخته شدهاست. | نانوبلور سنتزی الماس، سختترین ترکیب طبیعی شناخته شدهاست.[۶۹] |
| با داشتن خاصیت ابرروانکنندگی[l] یک روانکننده خوب است.[۷۰] | بهترین ترکیب موجود برای ساییدن دیگر مواد است. |
| رسانای جریان الکتریکی است.[۷۱] | یک عایق عالی برای جریان الکتریکی است[۷۲] و دارای بالاترین میزان شکست میدان الکتریکی در میان تمامی مواد شناخته شدهاست. |
| برخی از انواع گرافیت مناسب برای استفاده بهعنوان عایق حرارتی (عایق آتش و محافظ) هستند در حالیکه برخی دیگر، هدایت کننده بسیار خوب حرارت محسوب میشوند. | بهترین ترکیب طبیعی رساننده حرارتی است. |
| کدر است. | فوقالعاده شفاف است. |
| در شبکه بلوری ششگوشه متبلور میشود.[۷۳] | در شبکه بلوری مکعبی متبلور میشود. |
| کربن بیشکل،[m] کاملاً همسانگرد است. | نانولولههای کربنی در میان ناهمسانترین مواد شناخته شده قرار میگیرند. |
از دیگر دگرشکلهای شناخته شده، کربن نانوفوم است که در سال ۱۹۹۷ کشف شد. این دگرشکل متشکل از مجموعه خوشههای دارای چگالی کم از اتمهای کربن است که این اتمهای کربنی بهصورت رشته مانند در شبکه سهبعدی ضعیفی نگه داشته شدهاند. در ساختار این کربن نانوفوم، اتمها بهصورت مثلثی با یکدیگر در پیوند هستند و منجر به تشکیل حلقههایی شش یا هفت عضوی میشوند. این دگرشکل یکی از سبکترین مواد جامد شناخته شدهاست بهطوری که تنها دارای یک چگالی ۲ کیلوگرم برای هر متر مکعب است.[۷۴] بهصورت مشابهی با کربن نانوفوم، کربن شیشهای نیز شامل نسبت زیادی فضاهای متخلخل بستهاست با این تفاوت که برخلاف ساختار گرافیتی، فاقد ساختاری منظم از صفحات چیده شده بر روی یکدیگر همانند صفحات یک کتاب است و صفحات بهصورت نامنظم و تصادفی بر روی یکدیگر قرار گرفتهاند.[۲۴]
کربن استیلنی خطی که با نام کاربین نیز شناخته میشود، دارای ساختار شیمیایی C≡C-)n-) است.[۶۱] کربن در این نوع دگرشکل، دارای هیبریداسیون از نوع sp است و شکل کلی دگرشکل مانند یک پلیمر است که دارای پیوندهای یگانه و سهگانه بهصورت یکدرمیان است. کاربین توجه زیادی را در نانوفناوری به خود جلب کردهاست چراکه دارای مدول یانگ برابر با ۴۰ برابر الماس است.[۷۵] کربن دات در سال ۲۰۰۴ بهطور تصادفی در خالص سازی نانولولههای کربنی تک جداره کشف شد.[۷۶] این کشف مطالعات گستردهای را برای بهرهبرداری از ویژگیهای فلورسانس کربن دات ایجاد کرد.[۷۷]
- برخی از دگرشکلهای کربن
-
الماس دریای نور در موزه جواهرات ملی ایران قرار دارد.
-
کربن شیشهای ساختاری بینظم و دانهای، نسبتاً سخت، هادی حرارت و دارای پایداری حرارتی بالا
-
کربن فعال، حاصل از گرماکافت پیرولیز موادی مانند چوب، زغالسنگ، هسته یا پوسته میوهها
-
فولرن C۶۰ به شکل بلوری
-
سی دات تهیه شده از پیش مادههای مختلف: اوره ، آلانین و ساکارز
دیگر شکلهای ممکن
[ویرایش]- کربن دی[n]: این شکل از کربن توسط نظریهپردازان در سال ۲۰۱۸ پیشنهاد شد.[۷۸] کربن دی یک دگرشکل اورتورومبیک sp۳ است. محاسبات کل انرژی نشان میدهد که کربن دی از نظر انرژی از ساختار T۶ که قبلاً پیشنهاد شدهاست و همچنین بسیاری ساختارهای دیگر، مطلوب تر است.
- چائویتی[o]: ماده معدنی است که گمان میرود در اثر برخورد شهاب سنگ تشکیل شدهاست. کمی سختتر از گرافیت با رنگ مایل به خاکستری تا سفید توصیف شدهاست.
- کربن فلزی[p]: مطالعات نظری نشان دادهاست که در نمودار فازی مناطقی در فشارهای بسیار زیاد وجود دارد که کربن دارای ویژگی فلزی است.[۷۹]

- کربن بیسیسی[q]: در فشارهای فوقالعاده بالای ۱۰۰۰ گیگا پاسکال پیشبینی شدهاست که ساختار مکعبی بدنه محور با ۸ اتم در سلول واحد، به اصطلاح C۸ تبدیل شود. این فاز کربن مکعبی ممکن است در اخترفیزیک اهمیت داشته باشد. ساختار آن در یکی از مراحل قابل تبدیل سیلیکون شناخته شده و شبیه به کوبان است.[۸۰] مواد ابرچگال و ابرسخت مشابه به این مرحله در سال ۱۹۷۹[۸۱] و ۲۰۰۸ ساخته و منتشر شدهاست.[۸۲][۸۳] ساختار این فاز در سال ۲۰۱۲ به عنوان سودالیت کربن پیشنهاد شد.[۸۴]
- کربن بیسیتی[r]: دارای دستگاه بلوری چهارگوشه است که توسط نظریهپردازان در سال ۲۰۱۰ ارائه شدهاست[۸۵][۸۶]
- کربن ام[s]: تصور میشد که کربن منوکلینیک کربن-مرکز در سال ۱۹۶۳ با فشرده سازی گرافیت در دمای اتاق ایجاد شدهاست. ساختار آن در سال ۲۰۰۶ بهطور نظری ارائه شد،[۸۷] سپس در سال ۲۰۰۹[۸۸] مشاهدات تجربی آن را تأیید کرد. بسیاری از نامزدهای ساختاری، از جمله کربن بیسیتی، برای آن پیشنهاد شده که به همان اندازه با دادههای تجربی موجود در آن زمان سازگار باشد، تا اینکه در سال ۲۰۱۲ از نظر تئوری ثابت شد که این ساختار از نظر جنبشی احتمالاً از گرافیت تشکیل شدهاست.[۸۹][۹۰] اندکی پس از آن دادههای با وضوح بالا نشان دادند که در میان تمام کاندیداهای ساختار، فقط کربن ام با آزمایش سازگار است.[۹۱][۹۲]
- کربن کیو: در سال ۲۰۱۵، یک تیم از دانشگاه ایالتی کارولینای شمالی، اعلام کرد که دگرشکل دیگری از از کربن را توسعه دادهاند که نام آن کربن کیو[t] گذاشته شدهاست. این دگرشکل، خواص فرومغناطیس، فلوئورسانس نشان میدهد و سختی آن بیشتر از الماس است. در فاز بخار، برخی از اتمهای کربن، تشکیل کربن دواتمی میدهند. این شکل از کربن در زمان برانگیخته شدن، نور سبز رنگ از خود منتشر میکند.[۹۳][۹۴]
- کربن تی[u]: هر اتم کربن موجود در الماس با یک کربن تتراهدرون جایگزین میشود از این رو T-carbon نامیده میشود. این شکل از کربن در سال ۱۹۸۵ توسط نظریهپردازان مطرح شد.[۹۵]
- پریسمان سی۸[v]: یک دگرشکل کربنی با استحکام بالاست که از لحاظ نظری پیشبینی شده و شامل یک خوشه اتمی هشت اتمی کربن به شکل منشور مثلی دوهرمی سه گوش کشیده[w]شش اتمی با دو اتم دیگر در بالا و پایین پایههای آن است.[۹۶]
- کریستال کی۴[x]:یک ساختار کربنی بلوری سه بعدی است که هر اتم کربن در زاویه ۱۲۰ درجه به سه دیگر متصل میشود (مانند گرافیت)، اما در جایی که صفحات پیوندی لایههای مجاور به جای همزمانی با زاویه ۷۰٫۵ درجه قرار دارند.[۹۷][۹۸]
- پنتا گرافن[y]: یک دگرشکل فرضی است که کاملاً از پنج ضلعیهای کربن تشکیل شده و شبیه کاشی کاریهای پنج ضلعی قاهره است. پنتا گرافن در سال ۲۰۱۴ بر اساس تجزیه و تحلیل و شبیهسازی ارائه شد.[۹۹]
- شواهدی وجود دارد که ستارههای کوتوله سفید دارای هسته ای از کربن متبلور و هستههای اکسیژن هستند. بزرگترین نمونه پیدا شده در جهان تا کنون، بیپیام ۳۷۰۹۳، است که در فاصله ۵۰ سال نوری (۴٫۷×۱۰۱۴ کیلومتر) واقع در صورت فلکی قنطورس قرار دارد. در انتشار خبری از مرکز اخترفیزیک هاروارد-اسمیتسونین هسته ستارهای ۴۰۰۰ کیلومتری به عنوان یک الماس توصیف شد[۱۰۰] و پس از ترانه «لوسی در آسمان با الماس» از بیتلز، لوسی نامگذاری شد؛ با این حال، به احتمال زیاد یک شکل عجیب و غریب از کربن است.[۱۰۱]
از هکلیتز،[z] فگرافن،[aa] نوامن،[ab][۱۰۲] پروتومن،[ac][۱۰۳] زایدین،[ad][۱۰۴] کربن یو،[ae][۱۰۵] به عنوان دیگر شکلهای ممکن کربن یاد شدهاست.
ترکیبات
[ویرایش]ترکیبات آلی
[ویرایش]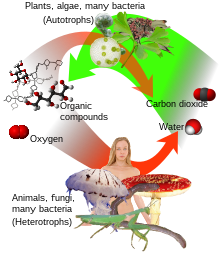

ترکیبات کربنی تشکیل دهنده پایه تمامی شکلهای شناخته شده حیات بر روی زمین هستند که موضوع شیمی آلی میباشد.[۱۰۶] چرخه کربن-نیتروژن، با کمک گرفتن از پرتوهای خورشیدی و سایر ستارگان، تأمین کننده انرژی لازم برای مصرف موجودات است. کربن توانایی تشکیل زنجیرهای طولانی و متقاطع متشکل از پیوندهای کربن-کربن را دارد، خصلتی که به آن زنجیرهای شدن[af][توضیح ۲] گفته میشود. پیوندهای کربن-کربن پیوندهایی محکم و پایدار هستند و از طریق زنجیرهای شدن این پیوندها میتوانند ترکیبات کربنی بیشماری را تشکیل دهند.[۱۰۷]
هیدروکربنها، سادهترین شکل از مولکولهای آلی هستند، خانواده بزرگی از مولکولهای آلی که تنها از اتمهای هیدروژن متصل به کربن تشکیل شدهاند.[۱۰۸] چنانچه در ساختار یک مولکول هیدروکربن اتمهای دیگری بهجز کربن و هیدروژن حضور داشته باشد، آن مولکول دیگر یک هیدروکربن تلقی نمیشود و به آن اتمها، اصطلاحاً ناجور اتم گفته میشود.[۱۰۹] ناجوراتمهای متداولی که در ساختار ترکیبات آلی حضور دارند عبارتاند از اکسیژن، نیتروژن، گوگرد، فسفر، هالوژنهای غیرپرتوزا و همچنین فلزاتی مانند سدیم و منیزیم. گروههای مشخصی از برخی اتمها که اغلب شامل ناجوراتمها هستند، در تعداد زیادی از ترکیبات آلی حضور دارند. به این گروهها که دارای آرایش مشخصی از اتمها هستند، گروههای عاملی گفته میشود و علت عاملی خواندن آنها این است که این گروهها بهطور عمده عامل تعیینکننده رفتار شیمیایی و فیزیکی و همچنین نوع واکنش پذیری ترکیب مورد نظر هستند.[۱۱۰]
از همین رو میتوان ترکیبات آلی را بر مبنای نوع گروه عاملی خود دستهبندی کرد. طول زنجیره مولکول، شکل، نوع و تعداد گروه عاملی، همگی در تعیین خواص نهایی فیزیکی و شیمیایی مولکول نقش دارند. در پایدارترین ترکیبات کربنی (و تقریباً تمام ترکیبات آلی پایدار)، کربن از قاعده هشتتایی پیروی میکند و بهصورت چهارظرفیتی است.[۱۱۱] به این معنی که یک اتم کربن برای رسیدن به پایداری در مجموع چهار پیوند کووالانسی تشکیل میدهد (که این پیوندها، موارد پیوند دوگانه و سهگانه را نیز شامل میشود). برخی از ترکیبات مانند کربوکاتیونها (دارای سهپیوند، بار مثبت)، رادیکالها (دارای سه پیوند، خنثی)، کربانیونها (دارای سه پیوند، بار منفی) و کاربنها (دارای دو پیوند، خنثی) اگرچه میتوانند مطابق قاعده فوق رفتار نکنند، اما این ترکیبات ناپایدار محسوب شده و بهعنوان حدواسطهای واکنشپذیر درنظر گرفته میشوند.[۱۱۲]
کربن که در تمامی شکلهای حیات شناخته شده حضور دارد و اساس شیمی آلی است.[۱۰۶] زمانی که اتم کربن با اتم هیدروژن پیوند برقرار کند، شکلهای متنوعی از هیدروکربنها را تولید میکند که اهمیت زیادی برای صنایع بهعنوان مبرد، روانکننده، حلال، ماده اولیه برای تولید پلاستیک و فراوردههای پتروشیمی دارد و همچنین میتوانند بهعنوان سوختهای فسیلی استفاده شوند.[۱۱۳]
زمانی که کربن با اکسیژن و هیدروژن ترکیب شود، گروهی از ترکیبات بسیار مهم زیستی مانند قندها، لیگنانها، الکلها، چربیها، استرهای آروماتیک، کاروتنوئیدها و ترپنها را منجر میشوند. با حضور نیتروژن، آلکالوئیدها تشکیل میشوند و با حضور عنصری مانند گوگرد، ترکیباتی مانند آنتیبیوتیکها، اسید آمینهها، و تولید ترکیباتی از لاستیک طبیعی ممکن میشود. چنانچه در ترکیبات آلی، علاوه بر عناصر قبلی، عنصر فسفر نیز حضور داشته باشد، امکان ساخته شدن دیانای (DNA) و آرانای (RNA)، بهعنوان حاملان شیمیایی کدهای حیات، فراهم میشود. علاوهبراین، با حضور گوگرد، تولید آدنوزین تریفسفات که مهمترین مولکول حامل انرژی در تمامی سلولهای زنده محسوب میشود، نیز امکانپذیر میشود.[۱۱۴]
- نمونههایی از ترکیبات آلی کربندار
-
شکر از جمله ترکیبات آلی کربندار است که در بسیاری از مواد خوراکی استفاده میشود.
-
آموکسیسیلین، از مهمترین و پرمصرفترین آنتیبیوتیکهای جهان از داروهای خانواده پنیسیلینها و از دسته بتالاکتامها است.
-
در فصل پاییز با کاهش کلروفیل کاروتنوئیدها، موجب تغییر رنگ برگ درختان میشوند.
-
هیدروکربنها، اساس فراوردههای پتروشیمی هستند.
ترکیبات معدنی
[ویرایش]
بهصورت معمول، ترکیبات حاوی کربن که ترکیباتی معدنی تلقی میشوند، فاقد پیوند کربن-کربن، کربن-هیدروژن و کربن-هالوژن هستند و در طبقهای کاملاً جدا نسبت به ترکیبات آلی قرار میگیرند. البته تعریف ارائه شده کاملاً سختگیرانه نیست و ممکن است طبقهبندی آلی و معدنی برای بعضی از ترکیبات بسته به دیدگاه یک پژوهشگر، کمی متفاوت باشد. یک دسته از ترکیبات کربنی معدنی، اکسیدهای ساده کربن هستند. برجستهترین ترکیب از خانواده اکسیدهای کربنی، کربن دیاکسید است، مولکولی که در تاریخ گذشته زمین جزء اصلی جو زمین بودهاست، اما امروزه تبدیل به جزئی ناچیز از آن شدهاست.[۱۱۵]
زمانی که کربن دیاکسید در آب حل میشود منجر به تولید کربنیک اسید میشود، اما همانند اغلب ترکیبات دارای چندین پیوند یگانه اکسیژن متصل به یک اتم کربن، ناپایدار است و به مرور تجریه میشود.[۱۱۶] با اینحال اسید کربنیک قادر به تولید ساختار کربنات (-CO۳۲) است که از طریق عدم استقرار الکترون میان کربن مرکزی و اکسیژنهای متصل به آن، پایدار میشود. کلسیت از جمله مواد معدنی مهمی است که حاوی گروه کربنات است. کربن دیسولفید نیز مشابه کربنات است[۱۱۷] با اینحال، بهعلت خواص فیزیکی و همچنین کاربرد آن در سنتز ترکیبات آلی، معمولاً از آن بهعنوان یک حلال آلی یاد میشود.[۱۱۸]
کربن مونوکسید از دیگر اکسیدهای متداول کربنی که از سوختن ناقص ترکیبات آلی ایجاد میشود، گازی بدون بو و رنگ است. ساختار این ترکیب متشکل از یک پیوند سهگانه قطبی میان اتم کربن و اکسیژن است که منجر به تمایل بسیار قوی این مولکول برای اتصال دائمی با اتم آهن موجود در مولکول هموگلوبین میشود. این موضوع سبب میشود که در صورت وجود کربن مونوکسید در خون، جای اکسیژن بر روی هموگلوبین را به علت تمایل بالای اتصال خود اشغال نماید.[۱۱۹][۱۲۰]
یون سیانید (−CN) نیز رفتار مشابهی با کربن مونوکسید در برابر هموگلوبین از خود بروز میدهد، با اینحال، سیانید بیشتر شبیه یک یون هالوژن (بهصورت یک شبههالوژن) عمل مینماید. برای مثال، دو یون سیانید میتوانند مانند اتصال دو اتم هالوژن و تشکیل یک هالید دو اتمی، با اتصال بهیکدیگر موجب تشکیل یک مولکول سیانوژن (N≡C−C≡N) شوند. همچنین گونه سیافید (−CP) که ساختار مشابهی با سیانید دارد، با اینکه حتی بسیاری از مشتقات ساده آن نیز بسیار ناپایدار هستند، بهعنوان ترکیبی معدنی در نظر گرفته میشود. دیگر اکسیدهای کمتر مرسوم معدنی حاوی کربن عبارتاند از کربن سابوکسید (C۳O۲)،[۱۲۱] دیکربن منوکسید ناپایدار (C۲O),[۱۲۲][۱۲۳] کربن تریاکسید (CO۳)،[۱۲۴][۱۲۵] سیکلوپنتانپنتون (C۵O۵)،[۱۲۶] سیکلوهگزانهگزون (C۶O۶)[۱۲۶] و انیدرید ملیتیک (C۱۲O۹). البته انیدرید ملتیک ناشی از واکنش آبگیری یک اسید ملتیک است و بهعلت داشتن حلقه بنزن، بسیاری از شیمیدانها آن را ترکیبی آلی بهشمار میآورند. کربن میتواند با فلزات واکنشپذیر مانند تنگستن واکنش داده و با تشکیل کاربید یا استیلید فلزی، موجب ایجاد آلیاژی با دمای ذوب بالا شود. این آنیونها در واقع بهترتیب بازهای مزدوج اسیدهای ضعیفی مانند متان و استیلن محسوب میشوند. کربن با داشتن الکترنگاتیویته ۲٫۵، تمایل به تشکیل پیوند کووالانسی دارد.[۱۲۷]
تعداد کمی از کاربیدها دارای شبکه کووالانسی هستند که یکی از مثالهای آن کاربید سیلیسیوم (کربوراندوم) است که دارای ساختاری شبیه الماس است. با اینحال، حتی قطبیترین کاربیدها که ساختاری شبیه نمکها دارند نیز ترکیباتی کاملاً یونی محسوب نمیشوند.[۱۲۸]
ترکیبات آلی فلزی
[ویرایش]ترکیبات آلی فلزی بر اساس تعریف به مولکولهای گفته میشود که حداقل حاوی یک پیوند کربن-فلز باشند.[۱۲۹] گستره وسیعی از چنین ترکیباتی وجود دارد که ترکیبات ساده آلکیل-فلز (مانند تترااتیلسرب)، η۲-آلکان (مانند نمک زایس)، η۳-آلیل (مانند دیمر آلیلپالادیم کلرید)، متالوسنهای حاوی لیگاندهای سیکلوپنتادیانیل (مانند فروسن) و کمپلکسهای کاربنی فلزات واسطه از مهمترین مجموعههای این طیف وسیع هستند. ترکیبات فلزی زیادی دارای لیگاند کربونیل و سیانید (مانند نیکل تتراکربونیل و پتاسیم فریسیانید) وجود دارد که برخی از آنها چنانچه فاقد سایر گروههای کربنی باشند، ترکیباتی کاملاً معدنی میدانند و آنها را در خانواده آلی فلزی قرار نمیدهند. با اینحال اغلب شیمیدانهای متخصص در زمینه شیمی آلی فلزی، کمپلکسهای فلزی، حتی مواردی که حاوی کربن معدنی هستند (مانند کربونیلها، سیانیدها و برخی از انواع کاربیدها و استیلیدها) را ذاتاً ترکیباتی آلی فلزی میدانند. اغلب کمپلکسهای حاوی لیگاندهای آلی که فاقد پیوند کربن-فلز از نوع کووالانسی هستند (مانند کمپلکسهای فلز-کربوکسیلاتها) اصطلاحاً آلی فلزی خوانده میشوند.[۱۳۰]
در حالیکه که درک عمومی بر این است که کربن دارای چهار ظرفیت برای ایجاد پیوند کووالانسی است، الگوهای نامعمول پیوندی دیگری نیز شناخته شدهاند. کربورانها دوازده وجهیهایی بسیار پایدار هستند که واحد اصلی ساختاری آنها -۲[B۱۲H۱۲] است که در آن یک گروه کاتیون کربن-هیدروژن (+CH) جایگزین بور-هیدروژن (BH) شدهاست؛ بنابراین، کربن در این ساختار به شش اتم دیگر (پنج بور و یک هیدروژن) متصل است. کاتیون
+۲[(Ph
۳PAu)
۶C]
حاوی یکی کربن هشت وجهی متصل به شش واحد فسفر-طلا است. این پدیده به طلادوستی[ag] لیگاندهای طلا نسبت داده شدهاست.[۱۳۱] در طبیعت، کوفاکتور آهن-مولیبدینیوم (FeMoco) عامل تثبیت میکروبی نیتروژن است. این ترکیب دارای یک کربن هشت وجهی مرکزی است که به شش اتم آهن متصل است. در سال ۲۰۱۶، تأیید شد که مطابق پیشبینیهای قبلی، دیکاتیون هگزامتیلبنزن حاوی یک اتم کربن دارای شش پیوند است. بهصورت دقیقتری، دیکاتیون میتواند با فرمول +۲[MeC(η۵-C۵Me۵)] نمایش داده شود. این ترکیب، یک متالوسن آلی است که در آن بخش +MeC۳ از طریق تمامی پنج کربن حلقه پنج عضوی به یک واحد −η۵-C۵Me۵ متصل شدهاست.[۱۳۲]
- نمونههایی از ترکیبات آلی فلزی
-
نمک زایس: یکی از اولین نمونههای کشف شده ترکیبات آلی فلزی
-
تریمتیلآلومینیوم: استفاده در تولید صنعتی برخی از الکلها
-
روکسارسون: استفاده بهعنوان افزودنی به غذا و ضدانگل در پرورش طیور
-
سستامیبی تکنیتیوم-۹۹ام: استفاده برای تصویربرداری از ماهیچههای قلب در پزشکی هستهای
موضوع حائز اهمیت در مورد این نوع ترکیبات که در آنها اتم کربن دارای پیوندهایی بیش از چهار عدد است این مورد است که هرکدام از پیوندهای متصل به کربن کمتر از دو الکترون جفت شده قراردادی را در خود جای دادهاند؛ بنابراین تعداد قراردادی الکترون در هر یک از این گونهها، قاعده هشتتایی را نقض نمیکند. در نتیجه این ترکیبات اگرچه فوق کئوردیناسیونی بهشمار میآیند اما همچنان فوق ظرفیتی محسوب نمیشوند. حتی برای گونههایی که توسط آکیبا[ai] و همکاران او گزارش شده و در آنها اتم کربن دارای پنج لیگاند و ده الکترون قراردادی است، نیز صادق است.[۱۳۳] محاسبات ساختاری الکترونی نشان میدهد که تعداد الکترونهای حول کربن هنوز کمتر از هشت مورد هستند، موردی که برای ترکیبات دارای چهار الکترون و سه مرکز پیوندی (سه مرکزی-چهارالکترونی[aj]) رخ میدهد.[۱۳۴]
منشأ و فراوانی
[ویرایش]
از لحاظ فراوانی جرمی، پس از هیدروژن، هلیوم و اکسیژن، کربن چهارمین عنصر در سراسر کیهان است. کربن در خورشید، سایر ستارگان، دنبالهدارها و جو اغلب سیارات، بهوفور یافت میشود.[۱۳۵] برخی از شهاب سنگها حاوی الماسهای میکروسکوپی هستند که در دوران اولیه تشکیل منظومه شمسی، زمانی که منظومه شمسی تنها یک قرص پیشسیارهای بودهاست، تشکیل شدهاند.[۱۳۶] الماسهای میکروسکوپی همچنین ممکن است در فشار و دمای بالا در بخشهایی از شهابسنگها که در محل برخورد شهابسنگها قرار دارند، تشکیل شوند.[۱۳۷]
در سال ۲۰۱۴، ناسا از یک پایگاه داده بهروز شده گسترده برای دنبال کردن هیدروکربنهای آروماتیک چندحلقهای در کیهان رونمایی کرد. بیش از ۲ درصد کربن موجود در کیهان، ممکن است با هیدروکربنهای آروماتیک چندحلقهای در ارتباط باشد، ترکیبات پیچیدهای متشکل از کربن و هیدروژن، بدون اکسیژن.[۱۳۸] این ترکیبات اساس فرضیه دنیای ناشی از هیدروکربنهای آروماتیک چندحلقهای و پیدایش حیات را بهعهده دارند. این ترکیبات که در حدود چند میلیارد سال پس از مهبانگ تشکیل شدهاند، در سرتاسر کیهان پراکنده شدهاند و با ستارههای جدیدی و سیارات خارج از منظومه شمسی در ارتباط هستند.[۱۳۵] کربن-۱۴ در لایه بالای تروپوسفر و استراتوسفر در ارتفاعی بین ۹ تا ۱۵ کیلومتر تولید میشود، جایی که کربن براثر واکنش با پرتوهای کیهانی تهنشین میشود.[۱۳۹] نوترونهای حرارتی با برخورد با نیتروژن-۱۴ موجب تبدیل آنها به کربن-۱۴ و یک پرتون بهازای هر کربن-۱۴ تولید شده، میشوند. برهمین اساس، ۱۰-۱۰×۱٫۵ درصد از کربن دیاکسید موجود در جو زمین، حای کربن-۱۴ است.[۱۴۰]
سیارکهای غنی از کربن، نسبت قابل توجهی را در مناطق خارج از کمربند سیارکها در منظومه شمسی به خود اختصاص میدهند. دانشمندان هنوز موفق به نمونه برداری مستقیم از این سیارکها نشدهاند. با اینحال این سیارکها میتوانند بهعنوان منابع کربن در فرضیه معادن فضایی استخراج کربن مورد استفاده قرار بگیرند، طرحی که با فناوری امروزی غیرممکن است، اما ممکن است در آینده عملی شود.[۱۴۱]
شکلگیری در ستارهها
[ویرایش]
کربن اتمی درون یک ستاره غول یا ابرغول از طریق انجام فرایند آلفا سهگانه تشکیل میشود. این مسیر نیازمند برخورد تقریباً همزمان سه ذره آلفا (هسته اتم هلیوم) است، چراکه محصول واکنش همجوشی هستهای یک هلیوم با هیدروژن یا اتم هلیوم دیگر، بهترتیب لیتیم-۵ و هلیوم-۸ خواهند بود که هردو فوقالعاده ناپایدار هستند و فوراً به گونههای سبکتر فروپاشیده میشوند.[۱۴۲] فرایند آلفا سهگانه در دمایی بیش از ۱۰۰ مگاکلوین انجام میشود. در نتیجه در دورانهای اولیه تشکیل کیهان که سرعت بالای انبساط و افت دما رخ دادهاست، مقدار قابل توجهی کربن تولید نشدهاست.[۱۴۳]
بر طبق نظریات فعلی اخترفیزیک، کربن در بخشهای درونی ستارگان در زمانی که آنها در مرحله شاخه افقی قرار دارند، تشکیل میشود.[۱۴۴] زمانی که ستارگان کلان جرم، با تولید ابرنواختر شروع به نابود شدن میکنند، کربنهای تولید شده مانند غبار به درون فضا پرتاب میشوند. این غبار پراکنده شده، بهعنوان مواد سازنده نسل بعدی ستارگان که اصطلاحاً ستارگان فلزینه نامیده میشوند[توضیح ۳] و دارای سیاراتی به دور خود هستند، مورد استفاده قرار میگیرد.[۱۳۵][۱۴۵]
خورشید واقع در منظومه شمسی یکی از ستارگان این چنینی است که با داشتن مقدار زیاد کربن، وجود حیاتی که امروزه بر روی زمین وجود دارد را ممکن ساختهاست. چرخه سیاناو، که یک سازوکار همجوشی هیدروژن اضافی است که با کمک کربن در نقش کاتالیزور، موجب نیرو بخشیدن به ستارگان میشود. انتقالات چرخشی گونههای مختلف ایزوتوپی مولکول کربن مونوکسید (برای مثال کربن-۱۲، ۱۳ و ۱۸) توسط اخترشناسی زیرمیلیمتری[ak][توضیح ۴] قابل تشخیص هستند و از آنها در مطالعه ستارگان تازه متولد شده و ابرهای مولکولی استفاده میشود.[۱۴۶]
در زمین
[ویرایش]
تخمین زده میشود که بخش جامد زمین، متشکل از ۷۳۰ قسمت در میلیون[al] کربن است و این مقدار در هسته به ۲۰۰۰ و در بخشهای گوشته و پوسته روی هم به ۱۲۰ قسمت در میلیون میرسد.[۱۴۷][۱۴۸] باتوجه به اینکه جرم زمین برابر ۱۰۲۴×۵٫۹۷۲ کیلوگرم است، بنابراین مقدار کربن را میتوان برابر با ۴۳۶۰ میلیون گیگاتن دانست. این مقدار بسیار بیشتر از کربن موجود در اقیانوسها و جو زمین است. کربن بهصورت کربن دیاکسید در جو زمین وجود دارد و مقدار مجموع آن تقریباً به ۸۳۹ گیگاتن میرسد. میزان کربن حل شده در مجموعهای آبها نیز تقریباً برابر با ۳۸۰۰۰ گیگاتن، تخمین زده میشود.[۱۴۹]
کربن موجود در زیستکره حدود ۵۵۰ گیگاتن است که البته بهعلت عدم دقت در تعیین میزان باکتریهای موجود در اعماق زمین، میزان عدم قطعیت این تخمین زیاد است.[۱۵۰] هیدروکربنها (مانند زغالسنگ، نفت خام و گاز طبیعی) نیز بهعنوان منابع حاوی کربن محسوب میشوند. مقدار کربن موجود در ذخایر زغالسنگ برابر با ۹۰۰ گیگاتن است، درحالیکه این مقدار برای منابع زغالسنگ شاید به ۱۸۰۰۰ گیگاتن هم برسد.[۱۵۱] میزان کربن ذخایر نفت خام نیز به حدود ۱۵۰ گیگاتن میرسد. منابع اثبات شده گاز طبیعی تقریباً برابر با ۱۰۱۲×۱۷۵ متر مکعب است (که میزان کربن آن را حدوداً برابر با ۱۰۵ گیگاتن است)، با اینحال مطالعات تخمین میزند که ۱۰۱۲×۹۰۰ متر مکعب گاز دیگر در منابعی مانند گاز شیل وجود دارد که میزان کربن آن را میتوان تا ۵۴۰ گیگاتن محاسبه کرد.[۱۵۲]
کربن همچنین به صورت آذریخ در مناطق قطبی و در زیر اقیانوس یافت میشود. تخمینهای متفاوتی از میزان کربن مربوط ارائه شدهاست که مقدار آن را ۵۰۰، ۲۵۰۰ یا ۳۰۰۰ گیگاتن اعلام میکنند.[۱۵۳][۱۵۴] در گذشته، مقدار هیدروکربنها بسیار بیشتر بودهاست. برمبنای یک منبع، بین سالهای ۱۷۵۱ تا ۲۰۰۱، حدود ۳۴۷ گیگاتن از کربن موجود، بر اثر سوزاندن سوختهای فسیلی، بهصورت کربن دیاکسید به درون جو زمین رها شدهاست.[۱۵۵] منبع دیگری بیان میکند که از سال ۱۷۵۰ به بعد، میزان کربن رها شده بهدرون جو زمین برابر با ۸۷۹ گیگاتن و مجموع کربن رها شده بهدرون جو، اقیانوسها و خشکی (مانند خاک باتلاقی) برابر با ۲۰۰۰ گیگاتن بودهاست.[۱۵۶]
کربن یکی از اجزای اصلی سنگهای کربناتی (مانند سنگ آهک، دولومیت، مرمر) است بهطوری که بهلحاظ جرمی، در مجموع سهمی ۱۲ درصدی دارد. زغالسنگ دارای مقدار بسیار بالایی کربن است (بهعنوان مثال آنتراسیت دارای ۹۲ تا ۹۸ درصد کربن است)[۱۵۷] و زغالسنگ، با داشتن ۴۰۰۰ گیگاتن کربن و سهمی ۸۰ درصدی از سوختهای فسیلی، بزرگترین منبع تجاری کربن معدنی است.[۱۵۸]
مطابق آمار اعلام شده در سال ۲۰۱۹، کشورهای ترکیه، چین، برزیل، موزامبیک، تانزانیا، هند، ویتنام، مکزیک، کره شمالی و ماداگاسکار، بهترتیب، ۱۰ کشور دارای بیشترین میزان ذخیره طبیعی گرافیت در سراسر دنیا هستند.[۱۵۹] همچنین، کشورهای چین، برزیل، ماداگاسکار، کانادا، هند، روسیه، اوکراین، نروژ، پاکستان و مکزیک ۱۰ کشور دارای بیشترین میزان تولید گرافیت در سراسر دنیا هستند.[۱۶۰] مطابق آمار اعلام شده در سال ۲۰۱۹، کشورهای روسیه، کنگو، بوتسوانا، آفریقای جنوبی، استرالیا بهترتیب، پنج کشور دارای بیشترین میزان ذخیره طبیعی الماس در سراسر دنیا هستند.[۱۶۱] همچنین، کشورهای روسیه، استرالیا، کنگو، بوتسوانا، زیمبابوه، آفریقای جنوبی، شش کشور دارای بیشترین میزان تولید الماس در سراسر دنیا هستند.[۱۶۲] اگرچه الماس بهطور طبیعی نیز یافت میشود، با اینحال حدود ۳۰ درصد تمام الماسهای مورد استفاده در صنعت در ایالات متحده آمریکا، بهصورت مصنوعی ساخته میشوند.[۱۶۳]
-
سنگ معدن گرافیت بههمراه یک سکه پنی برای مقایسه ابعاد
-
بلور الماس تراش نخورده
کربن چربیها و کربوهیدراتهای غذای ما را تشکیل میدهد و بخشی از مولکولها، مانند DNA و پروتئین، که بدن ما را تشکیل میدهد است. کربن، به شکل کربن دیاکسید، حتی بخشی از هوای تنفسی ماست. همچنین در مکانهایی مانند اقیانوس، سنگها، سوختهای فسیلی و گیاهان ذخیره میشود. هر فرایندی که از سوختهای فسیلی استفاده میکند مانند سوزاندن زغالسنگ برای تولید الکتریسیته، کربن زیادی را در جو آزاد میکند. پرورش گاو برای تولید گوشت همچنین مقدار زیادی کربن به شکل متان در جو آزاد میکند. اینگونه فرایندها که کربن را در جو آزاد میکنند از جمله منابع تولید کربن شناخته میشوند.[۱۶۴]
انباشتگاههای کربن، مخازن ذخیرهکننده کربن هستند. جنگلها معمولاً انباشتگاه کربن هستند، مکانهایی که کربن بیشتری نسبت به آزاد شدن جذب میکنند. آنها بهطور مداوم از طریق فرایند فتوسنتز، کربن را از جو خارج میکنند. اقیانوسها نمونه دیگری از انباشتگاه کربن است که مقدار زیادی کربن دیاکسید را از جو جذب میکند.[۱۶۵][۱۶۶]

در جنگلهای اصلی کانادا تا ۸۰٪ کل کربن به عنوان ماده آلی مرده در خاک ذخیره میشود.[۱۶۷] مطالعه ۴۰ ساله دانشگاه لیدز در مورد جنگلهای گرمسیری آفریقا، آسیا و آمریکای جنوبی نشان داد که جنگلهای گرمسیری حدود ۱۸ درصد کل کربن دیاکسید اضافه شده توسط سوختهای فسیلی را جذب میکنند. طبق مطالعه ای که در سال ۲۰۲۰ در ژورنال نیچر منتشر شد، طی سه دهه گذشته میزان کربن جذب شده توسط جنگلهای گرمسیر دست نخورده جهان کاهش یافتهاست. کل ذخایر کربن در جنگلها از ۶۶۸ گیگاتن در سال ۱۹۹۰ به ۶۶۲ گیگاتون در سال ۲۰۲۰ کاهش یافتهاست.[۱۶۸] در سال ۲۰۱۹، جنگلها به دلیل افزایش دما، خشکسالی و جنگلزدایی، یک سوم کربن کمتری نسبت به دهه ۱۹۹۰ مصرف کردند. طبق پیشبینیها جنگلهای گرمسیری معمولی ممکن است در دهه ۲۰۶۰ به منبع کربن تبدیل شود. بر اساس مطالعات فائو و برنامه محیط زیست سازمان ملل متحد، تخمین زده شدهاست که جنگلهای آسیا سالانه حدود ۵ تن کربن دیاکسید جذب میکنند.[۱۶۹]
چرخه کربن
[ویرایش]در شرایط متداول بر روی زمین، تبدیل یک عنصر به دیگری، رخدادی بسیار نادر است؛ بنابراین مقدار کربن موجود بر روی زمین به میزان تقریباً کاملی، ثابت است. از همینرو، فرایندهایی که طی آنها کربن مصرف میشود، بایستی کربن مورد نیاز خود را از یک محل تهیه و کربن پسماند را در محلی دیگر دفع کنند. مسیرهای کربنی موجود در محیط زیست، تشکیل دهنده چرخه کربن هستند. برای مثال گیاهانی که فتوسنتز میکنند، کربن دیاکسید مورد نیاز خود را از هوا یا آب دریا دریافت میکنند و سپس آن را به زیستتوده تبدیل میکنند، همانند چرخه کالوین که طی آن کربن تثبیت میشود. برخی از این زیستتوده تولید شده، توسط حیوانات خورده میشود و مقداری دیگر از آن بهصورت کربن دیاکسید توسط حیوانات تنفس میکند. چرخه کربن در عمل، فرایندی پیچیدهتر از توصیفی است که در اینجا به آن اشاره شد. بهعنوان مثال، مقداری از کربن دیاکسیدی که در آب اقیانوسها حل میشود و گیاهان مرده یا مواد جانوری چنانچه توسط باکتریها مصرف نشوند، ممکن است به نفت یا زغالسنگ تبدیل شوند که میتوانند در زمان سوزانده شدن، موجب آزادسازی کربن دیاکسید شوند.[۱۷۰][۱۷۱]
موجودات
[ویرایش]کربن یک جز اصلی از تمام حیات شناخته شده روی زمین است که تقریباً ۴۵–۵۰٪ از کل زیستتوده خشک را نشان میدهد.[۱۷۲] مولکولهای بیولوژیکی پیچیده تقریباً همیشه از اتمهای کربن متصل به عناصر دیگر، به ویژه اکسیژن و هیدروژن و غالباً ازت، فسفر و گوگرد تشکیل میشوند. از آنجا که این ماده سبک است و اندازه آن نسبتاً کوچک است، دستکاری آنزیمها برای مولکولهای کربن آسان است.[۱۷۳][۱۷۴] منتقدان از این فرض به عنوان شوونیسم کربن یاد میکنند.[۱۷۵]
پروتئینها، که ساختار موجودات زنده از آنها ساخته میشود تقریباً شامل تمام آنزیمهایی هستند که واکنشهای شیمیایی آلی را کاتالیز میکنند، نوکلئیک اسیدها، که اطلاعات ژنتیکی را حمل میکنند، کربوهیدراتها، که انرژی را به شکلی ذخیره میکند که میتواند توسط سلولهای زنده استفاده شود، لیپیدها، که انرژی را برای مدت طولانی در بدن حیوانات ذخیره میکنند مشهورترین درشت مولکولهای بیولوژیکی مورد استفاده در فرایندهای اساسی موجودات زنده هستند. کربن بیش از هر عنصر دیگر توانایی تشکیل ترکیبات گوناگون را دارد، تقریباً ده میلیون ترکیب تا به امروز شرح داده شدهاست[۱۷۶] و با این حال این تعداد تنها کسری از تعداد ترکیبات نظری ممکن در شرایط استاندارد است. به همین دلیل، اغلب از کربن به عنوان «پادشاه عناصر» یاد میشود.[۱۷۷] در یک مطالعه سال ۲۰۱۸، مشخص شد که کربن تقریباً ۵۵۰ میلیارد تن از کل حیات کره زمین را تشکیل میدهد.[۱۷۸][۱۷۹]
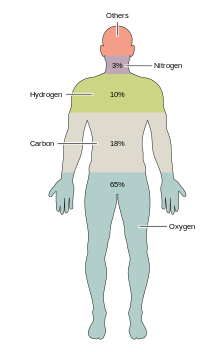
حدود ۹۹٪ جرم بدن انسان از ۶ عنصر اکسیژن، کربن، هیدروژن، نیتروژن، کلسیم و فسفر تشکیل شدهاست. بدن انسان بالغ با وزن بهطور متوسط ۷۰ کیلوگرم تقریباً شامل ۱۰۲۷ × ۷ اتم است و حداقل حاوی آثار قابل شناسایی ۶۰ عنصر شیمیایی است. مقادیر نسبی هر یک از عناصر به تفکیک متفاوت است که علت اصلی آن تفاوت در نسبت چربی، عضله و استخوان در بدن آنها است. افرادی که چربی بیشتری دارند، نسبت کربن بیشتری دارند.[۱۸۰] کربن بعد از اکسیژن دومین عنصر فراوان در بدن انسان حدود ۱۸٫۵ درصد، از نظر جرم است.[۱۸۱]
مشتقات
[ویرایش]
گرافیت
[ویرایش]ذخایر طبیعی و بهصورت تجاری در دسترس گرافیت در بخشهای مختلفی از دنیا وجود دارند با اینحال مهمترین منابع تجاری گرافیت در مناطقی مانند چین، هند، برزیل و کره شمالی قرار دارد. ذخایر گرافیت حاصل از سنگهای دگرگونی هستند و همراه کوارتز، میکا، و فلدسپات در سنگهای دگرگونی شیست، گنیس و ماسهسنگ دگرگونشده یا بهصورت تودهای یا لایهای همراه با سنگ آهک، گاهی با ضخامتی بیش از چند متر یافت میشود. ذخایر گرافیت در بارودیل[am] در شهر کامبرلند انگلستان بهاندازهای خالص و مناسب بودند که تا سده ۱۹ میلادی گرافیت مورد نیاز برای ساخت مداد، صرفاً با تراشیدن قطعات بزرگ و طبیعی گرافیت بهصورت رشتههای باریک تهیه شدهاست. امروزه، مقادیر کمتر گرافیت بهوسیله خرد کردن سنگهای اصلی حاوی گرافیت و شناور کردن گرافیت سبک بر روی آب تهیه میشود.[۱۸۲]
گرافیت طبیعی به سه صورت وجود دارد: بیشکل، پوستهای[an] یا پوستهای بلوری و ورقهای یا تودهای.[ao] گرافیت بیشکل دارای کمترین کیفیت در بین انواع گرافیت طبیعی است و میزان فراوانی آن نیز از دو نوع دیگر بیشتر است. برخلاف محیط آکادمیک، که بیشکلی به معنای فقدان ساختار بلوری است، در صنعت بیشکلی یا آمورف بودن به ساختار دارای بلورهای بسیار کوچک اشاره دارد. گرافیت بیشکل برای تولید محصولات کم ارزشتر گرافیتی مصرف میشود و بههمین دلیل این محصولات در مقایسه با سایر محصولات گرافیتی دارای کمترین قیمت هستند. مقادیر وسیعی از گرافیت بیشکل در چین، اروپا و ایالات متحده آمریکا یافت میشود. گرافیت پوستهای از فروانی کمتری برخوردار است و همچنین از کیفیت بالاتری نسبت به گرافیت بیشکل برخورد است. این نوع گرافیت به صورت صفحات مجزا به صورت سنگهای دگرگون شده متبلور میشود. میزان ارزش گرافیت پوستهای میتواند تا ۴ برابر ارزش گرافیت بیشکل باشد. کیفیت بهتر این نوع گرافیت موجب میشود که بتوان آن را با انجام پردازش مناسب برای کاربردهای متعددی مانند پیشگیرنده شعله استفاده کرد. بیشترین ذخایر گرافیت پوستهای در استرالیا، کانادا، برزیل، چین، آلمان و ماداگاسکار واقع شدهاست. گرافیت ورقهای یا تودهای کمیابترین، باارزشترین و در عین باکیفیتترین نیز نوع گرافیت طبیعی محسوب میشود. تنها معدن تجاری متعلق به این نوع گرافیت، در سریلانکا قرار دارد.[۱۸۲]
بر اساس سازمان زمینشناسی آمریکا، تولید جهانی گرافیت طبیعی در سال ۲۰۱۰ برابر با ۱٫۱ میلیون تن بودهاست. از این میان سهم چین ۸۰۰٬۰۰۰ تن، هند: ۱۳۰٬۰۰۰ تن، برزیل۷۶٬۰۰۰، کره شمالی ۳۰٬۰۰۰ و کانادا ۲۵٬۰۰۰ تن بودهاست. تاکنون هیچ نوع معدن گرافیت طبیعی در ایالات متحده آمریکا گزارش نشدهاست، اما حدود۱۱۸٬۰۰۰ تن گرافیت مصنوعی به ارزش ۹۹۸ میلیون دلار در سال ۲۰۰۹ در این کشور تولید شدهاست.[۱۸۲]
الماس
[ویرایش]


تنها کسر کوچکی از سنگ معدن الماس حاوی الماس واقعی است. سنگهای معدن پس از جمعآوری، طوری خرد میشوند که آسیبی به الماس موجود در آنها وارد نشود و در ادامه ذرات بهدست آمده بر اساس میزان چگالی دستهبندی میشوند. امروزه، پس از این که بررسی اولیه با دست انجام شد، عملیات تعیین میزان چگالی الماس بهصورت دقیق و با کمک طیفسنجی فلورسانس پرتو ایکس انجام میشود. در گذشته و قبل از اینکه استفاده از پرتو ایکس رایج شود، جداسازی به عهده نقالههای آغشته به گریس بودهاست. چون الماس تمایل زیادتری به چسبیدن به گریس در مقایسه با سایر کانیهای موجود در سنگ معدن دارد، در نتیجه امکان جداسازی مناسب آن به این صورت وجود داشتهاست.[۱۸۳]
در گذشته، الماسها تنها در تهنشستهای رسوبی در جنوب هندوستان یافت میشدند.[۱۸۴] هند از حدود قرن نهم پیش از میلاد تا سده ۱۸ پس از میلاد، مهمترین مکان تولید الماس در سرتاسر کره زمین بود، اما پتانسیل تجاری این منابع بهمرور و تا پایان سده ۱۸ از بین رفت.[۱۸۵] زمانی که این اتفاق رخ داد، هند از لحاظ تولید الماس، تقریباً در سایه برزیل قرار گرفته بود که در آنجا، بهعنوان اولین مکان خارج از هندوستان در سال ۱۷۲۵ الماس کشف شده بود.[۱۸۶]
تولید الماس از منابع اولیه (مانند کیمبرلیت و لمپرویت[ap]) تا دهه ۱۸۷۰ میلادی آغاز نشده بود و این اتفاق بعد از کشف الماس در آفریقای جنوبی رخ داد. تولید به مرور افزایش یافت و امروز مجموع الماس استخراج شده از آن زمان تا به امروز، به بیش از ۴٫۵ میلیارد قیراط رسیدهاست.[۱۸۷] حدود ۲۰ درصد الماس استخراج شده تنها در پنج سال اخیر انجام شدهاست و در طول ده سال اخیر نه معدن جدید شروع به تولید کردهاند، در حالیکه چهار معدن دیگر منتظر شروع کار هستند. اغلب این معادن در کانادا، زیمبابوه، آنگولا و یک مورد در روسیه هستند.[۱۸۷]
در ایالات متحده آمریکا، الماسها در ایالتهایی مانند آرکانزاس، کلرادو و مونتانا یافت شدهاند.[۱۸۸][۱۸۹] در سال ۲۰۰۴، کشفی خیره کننده از الماسهای میکروسکوپی اتفاق افتاد[۱۹۰] که در نتیجه تا سال ۲۰۰۸، مقادیر زیادی از نمونههای کیمبرلیت در مناطق دور افتاده مونتانا استخراج شدند.[۱۹۱] امروزه، اغلب ذخایر دارای قابلیت برداشت بهصورت تجاری، در روسیه، استرالیا و جمهوری دموکراتیک کنگو قرار گرفتهاند.[۱۹۲] براساس گزارش بررسی زمینشناسی بریتانیا[aq] در سال ۲۰۰۵، روسیه تقریباً یک پنجم الماس تهیه شده در سراسر دنیا را تولید کردهاست. استرالیا دارای غنیترین سنگهای معدنی حاوی الماس است و مطابق آمار، بیشینه تولید این کشور ۴۲ تن متریک در هر سال در دهه ۱۹۹۰ میلادی بودهاست.[۱۸۸] علاوهبر این موارد، تعدادی ذخایر فعال در مناطق شمالی کانادا، سیبری (بیشتر در منطقه یاقوتستان مانند معدن میر و گودال اوداچنایا)، برزیل و شمال و غرب استرالیا نیز وجود دارند.[۱۹۳][۱۹۴]
الیاف کربن
[ویرایش]
الیاف کربن یا الیاف گرافیت، الیافی با حدود ۵–۱۰ میکرومتر قطر هستند و بیشتر از اتمهای کربن تشکیل شدهاند. الیاف کربن دارای چندین مزیت از جمله سفتی بالا، مقاومت کششی نهایی بالا، وزن کم، مقاومت شیمیایی بالا، تحمل دما بالا و انبساط حرارتی کم هستند. این خاصیتها باعث شدهاست که فیبر کربن در برنامههای هوافضا، مهندسی عمران، نظامی و موتورسواری، به همراه سایر ورزشهای رقابتی، بسیار محبوب شود. با این حال، آنها در مقایسه با الیاف مشابه، مانند الیاف شیشهای یا الیاف پلاستیکی، نسبتاً گران هستند. در سال ۱۸۶۰، جوزف سوان برای نخستین بار الیاف کربن را برای استفاده در لامپها تولید کرد. در سال ۱۸۷۹، توماس ادیسون نخهای بامبو را در دماهای بالا حرارت داد و آنها را به یک رشته فیبر کربنی تبدیل کرد که در یکی از اولین لامپهای رشتهای قابل استفاده بهکار رفتند و میتوانستند براثر الکتریسیته گرم شده و تولید نور نمایند.[۱۹۵] در سال ۱۸۸۰، لوئیس لاتیمر یک رشته سیم کربن را برای لامپ رشتهای تولید کرد که با برق گرم میشد.[۱۹۶]
گرافین
[ویرایش]
گرافین یا گرافن[۱۹۷][۱۹۸] از دگرشکلهای کربن است. این ماده تشکیلشده از یک دستگاه بلوری ششگوشه دوبعدی است.[۱۹۹] که در آن هر اتم کربن به کمک سه الکترون ظرفیت خود، با سه پیوند دارای هیبریداسیون sp۲، به سه اتم کربن دیگر متصل شدهاست که این ساختار، ساختار اساسی تشکیل دهنده سایر دگرشکلها از جمله گرافیت، زغالسنگ، نانولوله کربنی و فولرنها است. همچنین میتواند بهعنوان یک مولکول با خصلت آروماتیکی برای خانواده هیدروکربنهای آروماتیک چند حلقهای مسطح در نظر گرفته شود. گرافن داری مجموعه ویژگیهایی است که آن را از سایر دگرشکلهای کربن جدا میکند.[۲۰۰]
در ضخامت برابر، تقریباً ۱۰۰ برابر قویتر از فولاد است.[۲۰۱][۲۰۲] با این وجود چگالی آن بهطور چشمگیری از فولاد پایینتر است و جرم سطحی آن ۰٫۷۶۳ میلیگرم در هر متر مربع است. هدایت گرما و الکتریسیته را بسیار کارآمد انجام میدهد و تقریباً شفاف است.[۲۰۳] گرافن همچنین یک دیامغناطیس است.[۲۰۴] محققان اثر ترانزیستور پیوندی دوقطبی، جریان پرتابیک و نوسانات کوانتومی زیادی را در مواد آن شناسایی کردهاند.[۲۰۵]
در ابتدا در سال ۱۹۶۲ در میکروسکوپهای الکترونی مشاهده شد، اما تنها در سطح فلز پشتیبانی میشد.[۲۰۶] سپس توسط آندره گایم فیزیکدان هلندی و کنستانتین نووسلف دانشمند روسی در سال ۲۰۰۴ در دانشگاه منچستر کشف شد که به خاطر این کشف جایزه نوبل فیزیک به آنها اهدا شد.[۱۹۹][۲۰۷][۲۰۸] جداسازی گرافن با کیفیت بالا به طرز شگفتآوری آسان است که این موضوع سبب میشود انجام تحقیقات بیشتر آسان گردد.[۲۰۹]
نانولوله کربنی
[ویرایش]
نانولولههای کربنی (CNTs) لولههایی هستند که از کربن ساخته شده و قطرهایی در حد نانومتر دارند. نانولولههای کربنی بهطور مستقل توسط دو گروه تحقیقاتی سومیو ایجیما و تویشناری ایچیهاشی[ar] از ژاپن و دونالد بتهونه[as] از آمریکا کشف شدند.[۲۱۰] نانولولههای کربنی تک جداره یکی از دگرشکلهای کربن و واسطهای بین فولرن و گرافنهای مسطح است. میتوان نانولولههای کربنی تک جداره را بهعنوان برشهایی از یک شبکه ششضلعی اتمهای کربنی که در امتداد یکی از بردارهای شبکه براوه قرار گرفتهاند تصور کرد تا یک استوانه توخالی شکل بگیرد.[۲۱۱]
نانو لولههای کربنی، ساختارهای حلقوی تو خالی و متشکل از اتمهای کربن هستند که میتوانند به شکل تک یا چند جداره آرایش یابند و دارای خواص فلزی و شبه رسانایی نیز هستند. نانولولههای کربنی میتوانند هدایت الکتریکی قابل توجهی داشته باشند.[۲۱۲][۲۱۳] همچنین دارای کشش سطحی فوقالعاده[۲۱۴] و هدایت حرارتی هستند.[۲۱۵][۲۱۶] به دلیل نانوساختار بودن و استحکام پیوندهای بین اتمهای کربن. علاوه بر این، آنها میتوانند از نظر شیمیایی اصلاح شوند.[۲۱۷] این خواص در بسیاری از زمینههای فناوری، از جمله الکترونیک، نورشناسی، مواد کامپوزیت، نانوفناوری میتواند کاربردی باشد.[۲۱۸][۲۱۹]

فولرن
[ویرایش]فولرن که مولکول آن از اتمهای کربن متصل شده توسط پیوندهای منفرد و دوتایی تشکیل شدهاست به طوری که میتواند شبکه توری مانند بسته یا نیمه بسته با حلقههای پنج تا هفت اتم را تشکیل دهد. این مولکول ممکن است یک کره توخالی، بیضی، استوانه یا بسیاری از اشکال و اندازههای دیگر باشد. پس از سنتز تصادفی آنها در سال ۱۹۸۵ در طبیعت و فضای بیرونی کشف شدند.[۲۲۰][۲۲۱]
کشف فولرنها باعث افزایش تعداد آلوتروپهای کربن شناخته شده شد که قبلاً محدود به گرافیت، الماس و کربن آمورف مانند دوده و زغال بود.[۲۲۲][۲۲۳] فولرنها بهدلیل خواص شیمیایی و کاربردهای جدیدشان، خصوصاً در علم مواد، الکترونیک و نانوفناوری، مورد توجه تحقیقات جدی بودهاند.[۲۲۴] فولرن باکمینستر یا توپ باکی[at] یک مولکول کروی با فرمول C۶۰ است. این ماده اولین بار در سال ۱۹۸۵ توسط هارولد کروتو، جیمز هلت، شاون اٌبرین، رابرت کارل و ریچارد اسمالی در دانشگاه رایس تگزاس تهیه شد. کروتو، کارل و اسمالی در سال ۱۹۹۶ برای کشف فولرن باکمینستر و دستهبندی اطلاعات دربارهٔ آن جایزه نوبل شیمی را دریافت کردند.[۲۲۵] این ترکیب پایدار است.[۲۲۶] و در دمای بالا و فشارهای بالا مقاومت میکند. سطح مولکول ضمن حفظ هندسه کروی میتواند با گونههای دیگر واکنش نشان دهد.[۲۲۷]
دوده
[ویرایش]دوده تودهای از ذرات کربن ناخالص است که در نتیجه سوختن ناقص هیدروکربنها حاصل میشود. بهطور مناسبتر به محصول فرایند سوختن در فاز گاز محدود میشود، اما معمولاً شامل ذرات باقیمانده سوخت پیرولیز شده مانند زغالسنگ، سانوسفرها، چوب سوخته شده و کک نفتی میشود که ممکن است در اثر تجزیه در هوا منتقل شوند.[۲۲۸] دوده به عنوان یک آلاینده موجود در هوا در محیط دارای منابع مختلفی است که همگی از نتایج نوعی تجزیه در اثر حرارت هستند. این منابع شامل دوده ناشی از سوختن زغالسنگ، موتورهای درونسوز،[۲۲۸] دیگهای نیروگاه، سوخت دیگهای بخار، دیگهای بخار کشتی، سوزاندن زباله، آتشسوزی جنگلها، شومینهها و کورهها میشود. از دیگر منابع آن میتوان به سیگار کشیدن، پختوپز، چراغهای روغنی، شمعها، و انتشار گازهای خروجی از وسایل نقلیه اشاره کرد.[۲۲۹]
دوده در غلظتهای بسیار کم قادر است سطوح را تیره کند یا باعث ایجاد رنگ سیاه در مجموعههای ذرات، مانند سیستمهای تهویه شود. دوده علت اصلی «مهدود» است. تشکیل دوده به شدت به ترکیب سوخت بستگی دارد. به ترتیب نفتالینها، بنزنها، آلیفاتیکها بیشترین تمایل را به ایجاد دوده دارند.[۲۳۰] دوده در سالهای گذشته به دلیل نگرانی در مورد بهداشت و محیط زیست بیشتر مورد توجه قرار گرفتهاست. تشکیل دوده یک فرایند پیچیدهاست که شامل سینتیک شیمیایی، در دمای بالا، صدها مولکول و رادیکالهای آنها، واکنشهای ناهمگن روی سطح ذرات و دینامیک ذرات است.[۲۳۱]
آلودگی ناشی از سوختن گازوئیل به شکل دوده بیش از یک چهارم کل آلودگی خطرناک هوا را تشکیل میدهد.[۲۲۹][۲۳۲] این ذرات معلق به دلیل تأثیر مستقیم و گسترده آن بر اندامهای تنفسی، تهدیدکننده جدی سلامت انسان هستند و قرار گرفتن طولانی مدت در معرض آلودگی هوای شهری حاوی دوده، خطر بیماری سرخرگهای کرونری را افزایش میدهد.[۲۳۳]

زغال
[ویرایش]زغال باقی ماندهای از کربن سیاه سبک است که به وسیله حرارت دادن زیاد چوب یا سایر مواد حیوانی و گیاهی تولید میشود. به طوری که تمام آب و سایر مواد سازنده فرار در این فرایند از بین میرود. این فرایند هنگام سوزاندن چوب در شومینه یا اجاق چوبی نیز اتفاق میافتد. شعله قابل مشاهده در آن حالت در واقع به دلیل سوختن مواد فرار ناشی از تبدیل چوب به زغال است. زغال انواع مختلفی دارد و افزون بر نمونهٔ رایج آن میتوان به کربن فعال، خشته و زغال قندی اشاره کرد. زغال قند از کربنی شدن شکر بهدست میآید. با افزودن اسید به آن برای از بین بردن مواد معدنی خالص میشود و سپس برای مدت طولانی در جریان کلر میسوزد تا آخرین آثار هیدروژن در آن از بین برود. آنری مواسان در تلاش اولیه خود برای ساخت الماس مصنوعی از آن استفاده کرد.[۲۳۴]
انواع خاصی از زغال، مانند زغال چوب، برای کاهش اکسیدهای فلزی گرم شده به فلزات مربوط استفاده میشود:
- ZnO + C → Zn + CO
- Fe۲O۳ + ۳C → ۲Fe + 3CO
از زغال چوب همچنین میتوان برای کاهش بخار فوقالعاده گرم به هیدروژن همراه با تشکیل مونوکسید کربن استفاده کرد:
- C + H۲O (1000 °C) → H۲ + CO (گاز پیوند)
کاربردها
[ویرایش]
واکنش انجام شده طی واکنش کربن با اکسید فلزی مانند آهن اکسید، یک واکنش گرماده است و از آن در تولید آهن در صنعت فولاد بهمنظور ذوب کردن آهن و کنترل میزان کربن موجود در فولاد استفاده میشود.
Fe۳O۴ + ۴C(s) → ۳Fe(s) + 4CO(g)
کربن مونوکسید میتواند با استفاده از مقدار بیشتری آهن، مورد استفاده قرار بگیرد.
Fe۳O۴ + ۴CO(g) → ۳Fe(s) + 4CO۲(g)
استفاده از گوگرد، موجب تولید کربن دیسولفید و استفاده از بخار آب، موجب تولید کربن مونوکسید میشود:
C(s) + H۲O(g) → CO(g) + H۲(g)
کربن در دماهای بالا قابلیت واکنش با برخی از فلزات و تولید کاربید فلزی را دارد. بهعنوان مثال تولید آهن کاربید در فرایند تولید فولاد و تنگستن کاربید که از آن بهعنوان یک ساینده در ساخت نوک سخت ابزارهای برش است، استفاده میشود. زغال بهعنوان یک ماده ترسیم در کارهای هنری، پختوپز، ذوب فلزات و کاربردهای دیگر و از چوب، زغالسنگ و نفت بهعنوان سوخت برای تولید انرژی و گرمایش استفاده میشوند. از الماس با کیفیت در سنگهای قیمتی و جواهرات و از و الماسهای صنعتی در ابزارهای حفاری، برش و پولیش برای ماشینکاری فلزات و سنگ استفاده میشوند. همچنین از الیاف کربن یا پلیمر تقویت شده با الیاف کربن که از پیرولیز الیاف پلیاستر مصنوعی ساخته شدهاست برای تقویت پلاستیکها برای تشکیل مواد کامپوزیتی سبک و پیشرفته، استفاده میشود. از کربن سیاه بهعنوان رنگدانه سیاه در چاپ جوهر، رنگ روغن و رنگهای آبی، کاغذ کاربون، اتمام رنگ خودرو، مرکب هندی و گرد جوهر چاپگر لیزری همچنین بهعنوان افزودنیهای پلیمری در محصولات مانند لاستیک و در ترکیبات پلاستیکی استفاده میشود.[۲۳۵]
چنانچه تولید تجاری گرافن قابل دسترس شود، گرافن میتواند در تولید اهداف گوناگونی مورد استفاده قرار بگیرید که آسانسور فضایی و ذخیره ایمن هیدروژن در ماشینهای مبتنی بر موتور هیدروژنی از جمله آنها هستند.[۲۳۶] زغال فعال بهعنوان یک جاذب و جذب کننده سطحی در مواد فیلتردار در کاربردهایی مانند ماسکهای گازی، خالصسازی آب و هود آشپزخانه و در پزشکی برای جذب زهرابه، سموم یا گازهای دستگاه گوارش استفاده میشود. کربن در کاهش شیمیایی در دماهای بالا استفاده میشود. از کُک برای کاهش سنگ آهن استفاده میشود. سختکاری پوسته فولاد با گرم کردن اجزای فولادی در پودر کربن حاصل میشود. کاربیدهای سیلیسیوم، تنگستن، بور و تیتانیوم از سختترین مواد شناخته شده هستند و بهعنوان ساینده در ابزار برش و سنگزنی استفاده میشوند.[۲۳۷]
ترکیبات کربن بیشتر مواد مورد استفاده شده در در لباس مانند پارچههای طبیعی و مصنوعی و چرم را تشکیل میدهد و تقریباً تمام سطوح داخلی ساختمان به غیر از شیشه، سنگ و فلز از محصولات کربن هستند. کربن عنصر لازم برای همه سیستمهای زنده شناخته شدهاست، و بدون آن زندگی نمیتواند وجود داشته باشد. عمده استفاده اقتصادی از کربن به غیر از مواد غذایی و چوب به شکل هیدروکربن است[۲۳۸] که مهمترین آنها گاز متان سوخت فسیلی و نفت خام است. نفت خام توسط صنایع پتروشیمی در پالایشگاهها تقطیر میشود تا بنزین، نفت سفید، گازوئیل، نفت کوره، قیر و دیگر فراوردههای نفتی تولید کند. سلولز نوعی پلیمر طبیعی حاوی کربن است که توسط گیاهان به شکل چوب، پنبه، کتان و کنف تولید میشود. سلولز در درجه اول برای حفظ ساختار گیاهان استفاده میشود و ساختار اولیه دیواره سلول گیاهان را تشکیل میدهد.[۲۳۹]
کاربرد کربن و ترکیبات آن بسیار متنوع است. کربن میتواند به همراه آهن تشکیل آلیاژهایی دهد که رایجترین آنها فولاد کربنی است.[۲۴۰] از ترکیب گرافیت با رس برای ساخت انواع مداد جهت نوشتن و ترسیم استفاده میشود. مداد گرافیت از نظر نرمی و سختی بسته به ناخالصی و رس درجهبندی گستردهای دارد. مغرهای مدادی که در مداد به کار میروند، بسته به میزان خاک رسی که با آنها ترکیب میشود، دارای سختی متفاوتی هستند. همچنین بهعنوان روانکننده و رنگدانه بهعنوان ماده قالبگیری در تولید شیشه استفاده میشود. در الکترود برای باتریهای خشک و در آبکاری و شکلدهی الکتریکی نیز کاربرد دارد. در جاروبک برای موتورهای الکتریکی و بهعنوان یک آرامکننده نوترون در رآکتورهای هستهای مورد استفاده قرار میگیرد.[۲۴۱]
فیبر کربن با استفاده از یک پلیمر پیش ساز مانند پلیاکریلونیترول،[au] که از نفت تولید میشود و سایر مواد آلی ساخته میشود. برای پلیمرهای مصنوعی مانند پلیاکریلونیترول یا ابریشم مصنوعی، پیش ماده ابتدا به نخهای رشتهای تبدیل میشود، با استفاده از فرایندهای شیمیایی و مکانیکی، ابتدا زنجیرههای پلیمری را به ترتیب برای بالا بردن خواص فیزیکی نهایی فیبر کربن تکمیل میکند. ساختار کریستالوگرافی و خصوصیات مکانیکی فیبر به نوع ماده شروع و پردازش بعدی بستگی دارد. الیاف کربن ساخته شده از پلیاکریلونیترول دارای ساختاری شبیه به رشتههای باریک گرافیت هستند. در نتیجه تجزیه گرمایی الیافی با استحکام کششی ویژه بالاتر از فولاد بهدست میآید.[۲۴۲]
پلیمرهای کربن با ارزش تجاری با منشأ حیوانی شامل پشم،[۲۴۳] ترمه و ابریشم است.[۲۴۴] پلاستیکها از پلیمرهای کربن مصنوعی ساخته میشوند از فرایند پلیمریزاسیون بهدست میآیند که غالباً با اتمهای اکسیژن و نیتروژن در فواصل منظم در زنجیره پلیمر اصلی قرار میگیرند همچنین مواد اولیه بسیاری از مواد مصنوعی از نفت خام تهیه میشود.[۲۴۵]
- کاربرد شکلهای گوناگون کربن
-
استفاده از کاربید تنگستن در متههای حفاری
-
استفاده از زغال برای تولید گرما
الماسها
[ویرایش]

صنعت الماس در دو دسته متفاوت قرار میگیرد. دسته اول شامل الماسهای با کیفیت میشود که برای استفاده در گوهرسنگ و جواهرات است و دسته دوم در مصارف صنعتی کاربرد دارد. در حالیکه تجارت بزرگی برای هر دو نوع الماس وجود دارد، با اینحال بازارهای مربوط به این دو نوع الماس، بهصورت کاملاً متفاوتی عمل میکنند. الماسهای مورد استفاده در جواهرات و زیور آلات، برخلاف فلزات گرانبهایی مانند طلا یا پلاتین همانند یک کالای اقتصادی مبادله نمیشوند. قیمت این نوع الماسها بهصورت قابل توجهی بالا است و در نتیجه بازار فعالی برای فروش مجدد این نوع الماسها وجود ندارد.[۲۴۶]
الماسهای صنعتی بیشتر به دلیل سختی و رسانش گرمایی، از ارزش بالایی برخوردار هستند و ویژگیهای زمینشناسی مانند شفافیت و رنگ الماس، ملاکی برای ارزش صنعتی آن نیست. حدود ۸۰٪ الماسهای استخراج شده (برابر با ۱۰۰ میلیون قیراط یا ۲۰ تن در سال) که با نام بورت[av][توضیح ۵] شناخته میشوند، بهعنوان سنگهای قیمتی مناسب نیستند و از آنها برای مصارف صنعتی استفاده میشود.[۲۴۷] الماس مصنوعی، که در دهه ۱۹۵۰ اختراع شد، بلافاصله کاربردهای صنعتی پیدا کرد. سالانه ۳ میلیارد قیراط (۶۰۰ تن) الماس مصنوعی تولید میشود.[۲۴۸]
کاربرد صنعتی عمده الماس در برش، حفاری، سنگ زنی و پولیش است. بسیاری از این کاربردها نیازی به الماسهای بزرگ ندارند. در حقیقت، بیشتر الماسهای با اندازه کوچک، میتوانند از نظر صنعتی استفاده شوند. الماسها در نوکهای مته یا تیغههای اره تعبیه شدهاند، یا برای استفاده در ابزارهای سنگ زنی و پولیش، داخل پودر ریخته میشوند.[۲۴۹] کاربردی تخصصی آن استفاده در سلول سندان الماس شامل استفاده در آزمایشگاهها بهعنوان مهار آزمایشهای ولتاژ بالا، یاتاقان با کارایی بالا و استفاده محدود در پنجرههای دارای کاربرد ویژه است.[۲۵۰][۲۵۱] با پیشرفتهای مداوم در تولید الماس مصنوعی، کاربردهای جدیدتری نیز عملی میشوند. استفاده از الماس بهعنوان نیمرسانا مناسب برای مدارهای مجتمع به دلیل ویژگی گرماگیری الکترونیک مورد توجه قرار گرفتهاست.[۲۵۲]
تاریخگذاری رادیوکربن
[ویرایش]
C معمولاً با طیفسنجی جرمی انجام میشود.
این روش در اواخر دهه ۱۹۴۰ در دانشگاه شیکاگو توسط ویلارد لیبای توسعه یافت.[۲۵۳] رادیوکربن (۱۴C) بهطور مداوم در اثر تقابل پرتوهای کیهانی با نیتروژن جو ایجاد میشود. ۱۴C با اکسیژن اتمسفر ترکیب میشود و کربن دیاکسید رادیواکتیو ایجاد میکند که با استفاده از فتوسنتز در گیاهان ترکیب میشود. وقتی حیوانات یا گیاهان از بین میروند، تبادل کربن با محیط متوقف میشود و پس از آن با از بین رفتن رادیواکتیو ۱۴C مقدار ۱۴C موجود در آن شروع به کاهش میکند. این کاهش، عملاً بهعنوان یک اصل در روش عمرسنجی رادیوکربنی مورد استفاده قرار میگیرد. این روش بهصورت گستردهای برای تعیین سن مواد کربنی تا عمری در حدود ۴۰۰۰۰ سال، استفاده میشود. اندازهگیری مقدار ۱۴C در یک نمونه از یک گیاه یا حیوان مرده، مانند یک قطعه چوب یا یک قطعه استخوان، اطلاعاتی را فراهم میکند که میتوان برای محاسبه زمان مرگ حیوان یا گیاه استفاده کرد. با توجه به نیمهعمر کربن-۱۴ هر ۵۷۳۰ سال مقدار آن نصف میشود.[۲۵۴][۲۵۵]
هموپرفیوژن
[ویرایش]اولین استفاده بالینی از سلولهای مصنوعی در هموپرفیوژن توسط محصور کردن کربن فعال صورت گرفت.[۲۵۶] زغال فعال قادر به جذب بسیاری از مولکولهای بزرگ است و مدت زیادی است که به دلیل توانایی آن در از بین بردن مواد سمی از خون در مسمومیتهای ناخواسته یا مصرف بیش از حد دارو شناخته شدهاست. با این حال، پرفیوژن از طریق تزریق مستقیم کربن فعال سمی است زیرا منجر به آمبولیسم و آسیب سلولهای خون میشود و به دنبال آن پلاکتها از بین میروند.[۲۵۷]
ایمنی و احتیاط
[ویرایش]

کربن خالص دارای سمیت فوقالعاده پایین برای انسان است و میتواند در شکلهای گرافیت و زغال توسط انسان بهصورت ایمن لمس شود. کربن در مقابل حل شدن یا واکنشهای شیمیایی حتی موردی مانند هضم شدن توسط اسید موجود در دستگاه گوارش انسان، از خود مقاومت نشان میدهد. در نتیجه زمانی که کربن وارد بافتهای انسان شود، به احتمال بالا، بهمدت نامعلومی همانجا خواهد ماند. کربن سیاه احتمالاً یکی از اولین رنگدانههایی بودهاست که برای خالکوبی مورد استفاده قرار گرفتهاست. یکی از مثالهای این موضوع خالکوبیهای یافت شده بر روی بدن یک مومیایی طبیعی معروف به اوتسی مرد یخی است که قدمت آن به حدود ۵۲۰۰ سال قبل میرسد.[۲۵۹]
استنشاق ذرات غبار زغالسنگ یا دوده (کربن سیاه) در مقادیر زیاد میتواند خطرناک باشد و موجب تحریک بافت ریه و منجر به بیماری نارسایی ریه شود، موضوعی که بهخصوص در معدنچیان دیده میشود و به بیماری سیاهششی موسوم است. از ذرات غبار الماس برای ساییدن سایر مواد استفاده میشود، با اینحال چنانچه این ذرات استنشاق یا بلعیده شوند، میتوانند برای انسان خطرناک باشند. میکروذرات کربنی که در دود خارج شده از موتورهای دیزلی وجود دارند، ممکن است در ریه انسان تجمع پیدا کنند.[۲۶۰]
در همه مثالهایی که تا اینجا ذکر شد، زیان احتمالی حاصل ناشی از تجمع ذرات در بدن فرد بودند و ماهیت شیمیایی خود کربن عامل آن نبود. بهطور عمومی، کربن دارای سمیت پایینی برای حیات موجود بر روی زمین است، با اینحال، نانولولهها کربنی برای مگس سرکه کشنده محسوب میشوند.[۲۶۱][۲۶۲]
کربن ممکن است در حضور هوا و در دمای بالا، باشدت و بهصورت نورانی بسوزد. مقادیر زیاد از زغالسنگ که در غیاب اکسیژن برای چند صد میلیون سال بهصورت خنثی باقی ماندهاند، ممکن است زمانی که بر اثر حفر معادن در معرض هوا قرار بگیرند، دچار احتراق خودبخودی شوند.[۲۶۳][۲۶۴]
در مصارف هستهای که از گرافیت بهعنوان یک تعدیلکننده نوترون استفاده میشود، پس از انباشت انرژی ویگنر[aw] ممکن است یک آزادسازی ناگهانی و خودبخودی رخ دهد. پخت تا دمای ۲۵۰ درجه سانتیگراد، میتواند انرژی را بهصورت ایمنی آزاد نماید، اگرچه این فرایند در حادثه آتشسوزی واینداسکیل[ax] در سال ۱۹۵۷ در انگلیس، بهخوبی پیش نرفت و منجر به آتشسوزی رآکتورهای دیگر شد.[۲۶۵][۲۶۶]
گستره وسیعی از ترکیبات کربنی دارای خطرات و البته فواید زیاد وجود دارند از ترکیبات خطرناکی مانند سمهای کشندهای همچون تترودوتوکسین، پروتئین لکتین رایسین که از دانههای کرچک بهدست میآیند، سیانید و کربن مونوکسید تا ترکیبات ضروری برای حیات مانند گلوکز و پروتئینها. پیوند سهگانه کربن با نیتروژن، موجب تشکیل گروه سیانو (CN-) میشود. در شیمی آلی، گروه سیانو بهعنوان یک گروه عاملی در نظر گرفته میشود و مولکولهای حاوی آن نیتریل نامیده میشوند. در شیمی معدنی، به گروههای سیانو که یک آنیون محسوب میشوند، سیانید گفته میشود. نمکهایی مانند سدیم سیانید و پتاسیم سیانید بسیار سمی هستند.[۲۶۷]
هیدروژن سیانید یک مایع بسیار فرار است که در مقیاس بزرگ، بهصورت صنعتی تولید میشود و با کمک افزودن اسید به نمک سیانید بهدست میآید. برخلاف سیانیدها که دارای پیوند یونی هستند و امکان آزاد سازی یون سیانید را دارند، نیتریلها بهدلیل پیوند کووالانسی میان گروه سیانو و کربن، فاقد چنین توانایی هستند و درنتیجه دارای سمیت کمتری نسبت به نمکهای سیانید دارند. مسمومیت با سیانید مسمومیت ناشی از قرار گرفتن در معرض سیانور است.[۲۶۸] علائم اولیه مسمومیت شامل سردرد، سرگیجه، ضربان سریع قلب، تنگی نفس و استفراغ است.[۲۶۹] همچنین ممکن است بهدنبال آن تشنج، ضربان آهسته قلب، فشار خون پایین، از دست دادن هوشیاری و ایست قلبی رخ دهد. شروع علائم معمولاً طی چند دقیقه بروز میکند و اگر شخصی زنده بماند، ممکن است دچار مشکلات عصبی طولانی مدت گردد.[۲۶۹][۲۷۰]
جستارهای وابسته
[ویرایش]توضیحات
[ویرایش]- ↑ هسته دارای هاله، به هستهای گفته میشود که توسط ابری هاله مانند از پروتون یا نوترون احاطه شدهاست و درنتیجه بزرگتر از یک هسته معمولی و فاقد هاله دیده میشود
- ↑ در شیمی، زنجیرهای شدن به خصلتی گفته میشود که اتمهای یکسان با یکدیگر پیوند برقرار کنند و تشکیل یک سری یا زنجیره از پیوندهای متشکل از اتمهای یکسان را بدهند.
- ↑ ستارگانی که فقط شامل هیدروژن و هلیوم نیستند و عناصر سنگینتر مانند کربن، نیتروژن، اکسیژن و نئون نیز در آنها یافت میشود.
- ↑ روش اخترشناسی زیرمیلیمتری روشی است که به بررسی بسیار ظریف طیفهای نشری بهدست آمده از مولکولهای موجود در فضای خارجی مینماید.
- ↑ اصطلاحی در صنعت تجارت الماس است که به قطعات ریز و خرده الماس غیرزینتی اشاره دارد.
واژهنامه
[ویرایش]- ↑ Carbo
- ↑ γράφειν
- ↑ King of the elements
- ↑ Aerial acid
- ↑ C. A. Vandermonde
- ↑ Carbone
- ↑ Carbonum
- ↑ Pauling scale
- ↑ Part Per Trillion (ppt)
- ↑ Nuclear halo
- ↑ Ring strain
- ↑ Superlubricity
- ↑ Amorphous carbon
- ↑ D-carbon
- ↑ Chaoite
- ↑ Metallic carbon
- ↑ bcc-carbon
- ↑ bct-carbon
- ↑ M-carbon
- ↑ Q-carbon
- ↑ T-carbon
- ↑ Prismane C8
- ↑ elongated triangular bipyramid
- ↑ K4 crystal
- ↑ Penta-graphene
- ↑ Haeckelites
- ↑ Phagraphene
- ↑ Novamene
- ↑ Protomene
- ↑ Zayedene
- ↑ U carbon
- ↑ Catenation
- ↑ Aurophilicity
- ↑ Antiknock agent
- ↑ Akiba
- ↑ three-center bonding
- ↑ Submillimetre astronomy
- ↑ Part Per Million (ppm)
- ↑ Borrowdale
- ↑ Flake
- ↑ Vein or lump
- ↑ Lamproite
- ↑ British Geological Survey
- ↑ Toshinari Ichihashi
- ↑ Donald S. Bethune
- ↑ Buckyball
- ↑ Polyacrylonitrile
- ↑ Bort
- ↑ Wigner effect
- ↑ Windscale fire
منابع
[ویرایش]- ↑ Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5.
- ↑ ۲٫۰ ۲٫۱ Haaland, D (1976). "Graphite-liquid-vapor triple point pressure and the density of liquid carbon". Carbon. 14 (6): 357–361. doi:10.1016/0008-6223(76)90010-5.
- ↑ ۳٫۰ ۳٫۱ Savvatimskiy, A (2005). "Measurements of the melting point of graphite and the properties of liquid carbon (a review for 1963–2003)". Carbon. 43 (6): 1115–1142. doi:10.1016/j.carbon.2004.12.027.
- ↑ "Fourier Transform Spectroscopy of the Electronic Transition of the Jet-Cooled CCI Free Radical" (PDF). Retrieved 2007-12-06.
- ↑ "Fourier Transform Spectroscopy of the System of CP" (PDF). Retrieved 2007-12-06.
- ↑ "Carbon: Binary compounds". Retrieved 2007-12-06.
- ↑ ۷٫۰ ۷٫۱ ۷٫۲ ۷٫۳ ۷٫۴ Properties of diamond, Ioffe Institute Database
- ↑ "Material Properties- Misc Materials". www.nde-ed.org. Retrieved 12 November 2016.
- ↑ Magnetic susceptibility of the elements and inorganic compounds, in Handbook of Chemistry and Physics 81st edition, CRC press.
- ↑ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics. Boca Raton, Florida: Chemical Rubber Company Publishing. pp. E110. ISBN 978-0-8493-0464-4.
- ↑ "History of Carbon and Carbon Materials - Center for Applied Energy Research - University of Kentucky". Caer.uky.edu. Retrieved 2008-09-12.
- ↑ Senese, Fred (2000-09-09). "Who discovered carbon?". Frostburg State University. Retrieved 2007-11-24.
- ↑ "Definition of carbon". www.dictionary.com (به انگلیسی). 2014-12-17. Archived from the original on 9 July 2020. Retrieved 2021-02-17.
- ↑ "Chinese made first use of diamond". BBC News. 17 May 2005. Archived from the original on 20 March 2007. Retrieved 2007-03-21.
- ↑ van der Krogt, Peter. "Carbonium/Carbon at Elementymology & Elements Multidict". Archived from the original on 2010-01-23. Retrieved 2010-01-06.
- ↑ Ferchault de Réaumur, R. -A. (1722). L'art de convertir le fer forgé en acier, et l'art d'adoucir le fer fondu, ou de faire des ouvrages de fer fondu aussi finis que le fer forgé (English translation from 1956). Paris, Chicago.
- ↑ "Carbon". Canada Connects. Archived from the original on 2010-10-27. Retrieved 2010-12-07.
- ↑ Senese, Fred. "Who discovered carbon?". Frostburg State University. Archived from the original on 2007-12-07. Retrieved 2007-11-24.
- ↑ Giolitti, Federico (1914). The Cementation of Iron and Steel. McGraw-Hill Book Company, inc. Archived from the original on 10 June 2020. Retrieved 25 June 2020.
- ↑ Senese, Fred (2000-09-09). "Who discovered carbon". Frostburg State University. Archived from the original on 2007-12-07. Retrieved 2007-11-24.
- ↑ Kroto, H. W.; Heath, J. R.; O'Brien, S. C.; Curl, R. F.; Smalley, R. E. (1985). "C60: Buckminsterfullerene". Nature. 318 (6042): 162–163. Bibcode:1985Natur.318..162K. doi:10.1038/318162a0.
- ↑ ۲۲٫۰ ۲۲٫۱ ۲۲٫۲ Unwin, Peter. "Fullerenes(An Overview)". Archived from the original on 2007-12-01. Retrieved 2007-12-08.
- ↑ "The Nobel Prize in Chemistry 1996 "for their discovery of fullerenes"". Archived from the original on 2007-10-11. Retrieved 2007-12-21.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ Harris, PJF (2004). "Fullerene-related structure of commercial glassy carbons" (PDF). Philosophical Magazine. 84 (29): 3159–3167. Bibcode:2004PMag...84.3159H. CiteSeerX 10.1.1.359.5715. doi:10.1080/14786430410001720363. Archived from the original (PDF) on 2012-03-19. Retrieved 2011-07-06.
- ↑ Greenwood, Norman N. ; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. 276–278. ISBN 0-08-037941-9
- ↑ Greenville Whittaker, A. (1978). "The controversial carbon solid−liquid−vapour triple point". Nature. 276 (5689): 695–696. Bibcode:1978Natur.276..695W. doi:10.1038/276695a0.
- ↑ Zazula, J. M. (1997). "On Graphite Transformations at High Temperature and Pressure Induced by Absorption of the LHC Beam" (PDF). CERN. Archived from the original (PDF) on 2009-03-25. Retrieved 2009-06-06.
- ↑ "Carbon". chemeurope.com (به انگلیسی). 2007-12-21. Archived from the original on 25 September 2020. Retrieved 2020-12-15.
- ↑ Greenwood, Norman N. ; Earnshaw, A. (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. 289–292. ISBN 0-08-037941-9
- ↑ Chemistry Operations (December 15, 2003). "Carbon". Los Alamos National Laboratory. Archived from the original on 2008-09-13. Retrieved 2008-10-09.
- ↑ "Four Characteristics of Carbon". Sciencing. Archived from the original on 24 July 2020. Retrieved 2020-07-23.
- ↑ "Using Carbon to Extract Metals". Study. Archived from the original on 23 July 2020. Retrieved 2020-07-23.
- ↑ ۳۳٫۰ ۳۳٫۱ "Carbon: isotope data". Webelements. Archived from the original on 26 July 2020. Retrieved 30 July 2020.
- ↑ Gannes, Leonard Z.; Del Rio, Carlos Martı́nez; Koch, Paul (1998). "Natural Abundance Variations in Stable Isotopes and their Potential Uses in Animal Physiological Ecology". Comparative Biochemistry and Physiology – Part A: Molecular & Integrative Physiology. 119 (3): 725–737. doi:10.1016/S1095-6433(98)01016-2. PMID 9683412.
- ↑ "Official SI Unit definitions". Archived from the original on 2007-10-14. Retrieved 2007-12-21.
- ↑ R. M. Silverstein; G. C. Bassler; T. C. Morrill (1991). Spectrometric Identification of Organic Compounds. Wiley.
- ↑ Bowman, S. (1990). Interpreting the past: Radiocarbon dating. British Museum Press. ISBN 978-0-7141-2047-8.
- ↑ Brown, Tom (March 1, 2006). "Carbon Goes Full Circle in the Amazon". Lawrence Livermore National Laboratory. Archived from the original on September 22, 2008. Retrieved 2007-11-25.
- ↑ Libby, W. F. (1952). Radiocarbon dating. Chicago University Press and references therein.
- ↑ Westgren, A. (1960). "The Nobel Prize in Chemistry 1960". Nobel Foundation. Archived from the original on 2007-10-25. Retrieved 2007-11-25.
- ↑ "Use query for carbon-8". barwinski.net. Archived from the original on 2005-02-07. Retrieved 2007-12-21.
- ↑ Watson, A. (1999). "Beaming Into the Dark Corners of the Nuclear Kitchen". Science. 286 (5437): 28–31. doi:10.1126/science.286.5437.28.
- ↑ Loudon, Marc (2009). Organic Chemistry. Roberts and Company Publishers. p. 39. ISBN 978-0-9815194-3-2.
- ↑ Kobashi, Koji (2005), "2.1 Structure of diamond", Diamond films: chemical vapor deposition for oriented and heteroepitaxial growth, Elsevier, p. 9, ISBN 978-0-08-044723-0.
- ↑ Delhaes, Pierre (2000). "Polymorphism of carbon". In Delhaes, Pierre (ed.). Graphite and precursors. Gordon & Breach. pp. 1–24. ISBN 9789056992286.
- ↑ Pierson, Hugh O. (2012). Handbook of carbon, graphite, diamond, and fullerenes: properties, processing, and applications. Noyes Publications. pp. 40–41. ISBN 978-0-8155-1739-9.
- ↑ Chung, D. D. L. (2002). "Review Graphite". Journal of Materials Science. 37 (8): 1475–1489. doi:10.1023/A:1014915307738.
- ↑ Wyckoff, W.G. (1963). Crystal Structures. New York, London: John Wiley & Sons. ISBN 978-0-88275-800-8.
- ↑ Lipson, H.; Stokes, A. R. (1942). "A New Structure of Carbon". Nature. 149 (3777): 328. Bibcode:1942Natur.149Q.328L. doi:10.1038/149328a0.
- ↑ IUPAC, Compendium of Chemical Terminology, 2nd ed. (the "Gold Book") (1997). Online corrected version: (2006–) "Rhombohedral graphite".
- ↑ March, Jerry (1985), Advanced Organic Chemistry: Reactions, Mechanisms, and Structure (3rd ed.), New York: Wiley, ISBN 0-471-85472-7
- ↑ McMurry, John (2015). Organic Chemistry. Cengage Learning. p. 263. ISBN 978-1-305-08048-5.
- ↑ Pyykkö, Pekka; Riedel, Sebastian; Patzschke, Michael (2005). "Triple-Bond Covalent Radii". Chemistry: A European Journal. 11 (12): 3511–20. doi:10.1002/chem.200401299. PMID 15832398.
- ↑ ۵۴٫۰ ۵۴٫۱ Ebbesen, T. W., ed. (1997). Carbon nanotubes—preparation and properties. Boca Raton, Florida: CRC Press. ISBN 978-0-8493-9602-1.
- ↑ ۵۵٫۰ ۵۵٫۱ Dresselhaus, M. S.; Dresselhaus, G.; Avouris, Ph., eds. (2001). Carbon nanotubes: synthesis, structures, properties and applications. Topics in Applied Physics. Vol. 80. Berlin. ISBN 978-3-540-41086-7.
- ↑ ۵۶٫۰ ۵۶٫۱ Nasibulin, Albert G.; Pikhitsa, P. V.; Jiang, H.; Brown, D. P.; Krasheninnikov, A. V.; Anisimov, A. S.; Queipo, P.; Moisala, A.; et al. (2007). "A novel hybrid carbon material". Nature Nanotechnology. 2 (3): 156–161. Bibcode:2007NatNa...2..156N. doi:10.1038/nnano.2007.37. PMID 18654245.
- ↑ Nasibulin, A.; Anisimov, Anton S.; Pikhitsa, Peter V.; Jiang, Hua; Brown, David P.; Choi, Mansoo; Kauppinen, Esko I. (2007). "Investigations of NanoBud formation". Chemical Physics Letters. 446 (1): 109–114. Bibcode:2007CPL...446..109N. doi:10.1016/j.cplett.2007.08.050.
- ↑ Vieira, R; Ledoux, Marc-Jacques; Pham-Huu, Cuong (2004). "Synthesis and characterisation of carbon nanofibers with macroscopic shaping formed by catalytic decomposition of C2H6/H2 over nickel catalyst". Applied Catalysis A: General. 274 (1–2): 1–8. doi:10.1016/j.apcata.2004.04.008.
- ↑ ۵۹٫۰ ۵۹٫۱ Clifford, Frondel; Marvin, Ursula B. (1967). "Lonsdaleite, a new hexagonal polymorph of diamond". Nature. 214 (5088): 587–589. Bibcode:1967Natur.214..587F. doi:10.1038/214587a0.
- ↑ Rode, A. V.; Hyde, S. T.; Gamaly, E. G.; Elliman, R. G.; McKenzie, D. R.; Bulcock, S. (1999). "Structural analysis of a carbon foam formed by high pulse-rate laser ablation". Applied Physics A: Materials Science & Processing. 69 (7): S755–S758. Bibcode:1999ApPhA..69S.755R. doi:10.1007/s003390051522.
- ↑ ۶۱٫۰ ۶۱٫۱ Heimann, Robert Bertram; Evsyukov, Sergey E. & Kavan, Ladislav (28 February 1999). Carbyne and carbynoid structures. Springer. pp. 1–. ISBN 978-0-7923-5323-2. Archived from the original on 23 November 2012. Retrieved 2011-06-06.
- ↑ Lee, C.; Wei, X.; Kysar, J. W.; Hone, J. (2008). "Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene". Science. 321 (5887): 385–8. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798. Lay summary.
{{cite journal}}: Cite uses deprecated parameter|lay-url=(help) - ↑ Sanderson, Bill (2008-08-25). "Toughest Stuff Known to Man: Discovery Opens Door to Space Elevator". nypost.com. Archived from the original on 2008-09-06. Retrieved 2008-10-09.
- ↑ Robertson, J. (1986). "Amorphous carbon". Advances in Physics (به انگلیسی). Informa UK Limited. 35 (4). doi:10.1080/00018738600101911. ISSN 0001-8732.
- ↑ Jenkins, Edgar (1973). The polymorphism of elements and compounds. Taylor & Francis. p. 30. ISBN 978-0-423-87500-3. Archived from the original on 2012-11-23. Retrieved 2011-05-01.
- ↑ Popov, Ilya V.; Görne, Arno L.; Tchougréeff, Andrei L.; Dronskowski, Richard (2019). "Relative stability of diamond and graphite as seen through bonds and hybridizations". Physical Chemistry Chemical Physics (به انگلیسی). Royal Society of Chemistry (RSC). 21 (21). doi:10.1039/c8cp07592a. ISSN 1463-9076.
- ↑ "World of Carbon – Interactive Nano-visulisation in Science & Engineering Education (IN-VSEE)". Archived from the original on 2001-05-31. Retrieved 2008-10-09.
- ↑ Rossini, F. D.; Jessup, R. S. (1938). "Heat and Free Energy of Formation of Carbon Dioxide and of the Transition Between Graphite and Diamond". Journal of Research of the National Bureau of Standards. 21 (4): 491. doi:10.6028/jres.021.028.
- ↑ Irifune, Tetsuo; Kurio, Ayako; Sakamoto, Shizue; Inoue, Toru; Sumiya, Hitoshi (2003). "Materials: Ultrahard polycrystalline diamond from graphite". Nature. 421 (6923): 599–600. Bibcode:2003Natur.421..599I. doi:10.1038/421599b. PMID 12571587.
- ↑ Dienwiebel, Martin; Verhoeven, Gertjan; Pradeep, Namboodiri; Frenken, Joost; Heimberg, Jennifer; Zandbergen, Henny (2004). "Superlubricity of Graphite" (PDF). Physical Review Letters. 92 (12): 126101. Bibcode:2004PhRvL..92l6101D. doi:10.1103/PhysRevLett.92.126101. PMID 15089689. Archived from the original (PDF) on 2011-09-17.
- ↑ Deprez, N.; McLachan, D. S. (1988). "The analysis of the electrical conductivity of graphite conductivity of graphite powders during compaction". Journal of Physics D: Applied Physics. 21 (1): 101–107. Bibcode:1988JPhD...21..101D. doi:10.1088/0022-3727/21/1/015.
- ↑ Collins, A. T. (1993). "The Optical and Electronic Properties of Semiconducting Diamond". Philosophical Transactions of the Royal Society A. 342 (1664): 233–244. Bibcode:1993RSPTA.342..233C. doi:10.1098/rsta.1993.0017.
- ↑ Delhaes, P. (2001). Graphite and Precursors. CRC Press. ISBN 978-90-5699-228-6. Archived from the original on 4 December 2020. Retrieved 24 June 2020.
- ↑ Schewe, Phil & Stein, Ben (March 26, 2004). "Carbon Nanofoam is the World's First Pure Carbon Magnet". Physics News Update. 678 (1). Archived from the original on March 7, 2012.
- ↑ Itzhaki, Lior; Altus, Eli; Basch, Harold; Hoz, Shmaryahu (2005). "Harder than Diamond: Determining the Cross-Sectional Area and Young's Modulus of Molecular Rods". Angew. Chem. Int. Ed. 44 (45): 7432–5. doi:10.1002/anie.200502448. PMID 16240306.
- ↑ Xu, Xiaoyou; Ray, Robert; Gu, Yunlong; Ploehn, Harry J.; Gearheart, Latha; Raker, Kyle; Scrivens, Walter A. (2004). "Electrophoretic Analysis and Purification of Fluorescent Single-Walled Carbon Nanotube Fragments". Journal of the American Chemical Society. 126 (40): 12736–7. doi:10.1021/ja040082h. PMID 15469243.
- ↑ Wang, Youfu; Hu, Aiguo (2014). "Carbon quantum dots: Synthesis, properties and applications". Journal of Materials Chemistry C. 2 (34): 6921–39. doi:10.1039/C4TC00988F.
- ↑ Fan, Dong; Lu, Shaohua; Golov, Andrey A.; Kabanov, Artem A.; Hu, Xiaojun (2018). "D-carbon: Ab initio study of a novel carbon allotrope". The Journal of Chemical Physics. 149 (11): 114702. arXiv:1712.09748. Bibcode:2018JChPh.149k4702F. doi:10.1063/1.5037380. ISSN 0021-9606. PMID 30243276. Archived from the original on 7 May 2021. Retrieved 17 February 2021.
- ↑ Correa, Aa; Bonev, Sa; Galli, G (Jan 2006). "Carbon under extreme conditions: phase boundaries and electronic properties from first-principles theory". Proceedings of the National Academy of Sciences of the United States of America. 103 (5): 1204–8. Bibcode:2006PNAS..103.1204C. doi:10.1073/pnas.0510489103. ISSN 0027-8424. PMC 1345714. PMID 16432191.
- ↑ Johnston, Roy L.; Hoffmann, Roald (1989). "Superdense carbon, C8: supercubane or analog of .gamma. -silicon?". Journal of the American Chemical Society. 111 (3): 810. doi:10.1021/ja00185a004.
- ↑ Matyushenko N.N.; Strel'nitsky V.E. (1979). "JETP Letters: issues online". www.jetpletters.ac.ru. p. 199. Archived from the original on 2016-03-05.
- ↑ Liu, P.; Cui, H.; Yang, G. W. (2008). "Synthesis of Body-Centered Cubic Carbon Nanocrystals". Crystal Growth & Design. 8 (2): 581. doi:10.1021/cg7006777.
- ↑ Liu, P; Cao, Yl; Wang, Cx; Chen, Xy; Yang, Gw (Aug 2008). "Micro- and nanocubes of carbon with C8-like and blue luminescence". Nano Letters. 8 (8): 2570–5. Bibcode:2008NanoL...8.2570L. doi:10.1021/nl801392v. ISSN 1530-6984. PMID 18651780.
- ↑ Pokropivny, Alex; Volz, Sebastian (2012-09-01). "'C8 phase': Supercubane, tetrahedral, BC-8 or carbon sodalite?". Physica Status Solidi B (به انگلیسی). 249 (9): 1704–1708. Bibcode:2012PSSBR.249.1704P. doi:10.1002/pssb.201248185. ISSN 1521-3951.
- ↑ Wolfram Demonstrations Project بایگانیشده در ۱۲ ژانویه ۲۰۲۱ توسط Wayback Machine. Demonstrations.wolfram.com. Retrieved on 2011-11-23.
- ↑ Edwards, Lin (November 8, 2010) Structure of new form of super-hard carbon identified بایگانیشده در ۵ اوت ۲۰۱۱ توسط Wayback Machine. Physorg.com. Retrieved on 2011-11-23.
- ↑ Oganov A. R.; Glass C. W. (2006). "Crystal structure prediction using ab initio evolutionary techniques: principles and applications". J. Chem. Phys. 124 (3): 244704. Bibcode:2006JChPh.124c4704K. doi:10.1063/1.2155529. PMID 16438597.
- ↑ Li, Q.; Ma, Y.; Oganov, A.R.; Wang, H.B.; Wang, H.; Xu, Y.; Cui, T.; Mao, H. -K.; Zou, G. (2009). "Superhard monoclinic polymorph of carbon". Phys. Rev. Lett. 102 (17): 175506. Bibcode:2009PhRvL.102q5506L. doi:10.1103/PhysRevLett.102.175506. PMID 19518796.
- ↑ Boulfelfel S.E.; Oganov A.R.; Leoni S. (2012). "Understanding the nature of "superhard graphite"". Scientific Reports. 2: 471. arXiv:1204.4750. Bibcode:2012NatSR...2E.471B. doi:10.1038/srep00471. PMC 3384968. PMID 22745897.
- ↑ Oganov, Artem R. (27 June 2012). "Researchers establish structure of a new superhard form of carbon". Archived from the original on 25 August 2016. Retrieved 23 July 2012.
- ↑ Wang Y.; Panzik J.E.; Kiefer B.; Lee K.K.M. (2012). "Crystal structure of graphite under room-temperature compression and decompression". Scientific Reports. 2: 520. Bibcode:2012NatSR...2E.520W. doi:10.1038/srep00520. PMC 3400081. PMID 22816043.
- ↑ Lee, Kanani K. M. (20 July 2012). "Diamond in the rough: Half-century puzzle solved". Archived from the original on 23 July 2012. Retrieved 23 July 2012.
- ↑ Narayan, Jagdish; Bhaumik, Anagh (2 December 2015). "Novel phase of carbon, ferromagnetism, and conversion into diamond". Journal of Applied Physics. 118 (215303): 215303. Bibcode:2015JAP...118u5303N. doi:10.1063/1.4936595.
- ↑ "Researchers Find New Phase of Carbon, Make Diamond at Room Temperature". news.ncsu.edu. 2015-11-30. Archived from the original on 2016-04-06. Retrieved 2016-04-06.
- ↑ Burdett, Jeremy K.; Lee, Stephen (May 1985). "Moments method and elemental structures". Journal of the American Chemical Society. 107 (11): 3063–3082. doi:10.1021/ja00297a011.
- ↑ Openov, Leonid A.; Elesin, Vladimir F. (1998). "Prismane C8: A new form of carbon?". JETP Letters. 68 (9): 726. arXiv:physics/9811023. Bibcode:1998JETPL..68..726O. doi:10.1134/1.567936.
- ↑ Itoh, Masahiro; Kotani, Motoko; Naito, Hisashi; Sunada, Toshikazu; Kawazoe, Yoshiyuki; Adschiri, Tadafumi (2009), "New metallic carbon crystal", Physical Review Letters, 102 (5): 055703, Bibcode:2009PhRvL.102e5703I, doi:10.1103/PhysRevLett.102.055703, PMID 19257523
- ↑ Tagami, Makoto; Liang, Yunye; Naito, Hisashi; Kawazoe, Yoshiyuki; Kotani, Motoko (2014), "Negatively curved cubic carbon crystals with octahedral symmetry", Carbon, 76: 266–274, doi:10.1016/j.carbon.2014.04.077
- ↑ Zhang, S.; Zhou, J.; Wang, Q.; Chen, X.; Kawazoe, Y.; Jena, P. (2015). "Penta-graphene: A new carbon allotrope". Proceedings of the National Academy of Sciences. 112 (8): 201416591. Bibcode:2015PNAS..112.2372Z. doi:10.1073/pnas.1416591112. PMC 4345574. PMID 25646451.
- ↑ "This Valentine's Day, Give The Woman Who Has Everything The Galaxy's Largest Diamond". Center for Astrophysics. Archived from the original on 6 July 2008. Retrieved 2009-05-05.
- ↑ Cauchi, S. (2004-02-18). "Biggest Diamond Out of This World". The Age. Archived from the original on 4 November 2007. Retrieved 2007-11-11.
- ↑ Burchfield, Larry A; Fahim, Mohamed Al; Wittman, Richard S; Delodovici, Francesco; Manini, Nicola (2017). "Novamene: A new class of carbon allotropes". Heliyon. 3 (2): e00242. doi:10.1016/j.heliyon.2017.e00242. PMC 5300697. PMID 28217750.
- ↑ Delodovici, Francesco; Manini, Nicola; Wittman, Richard S; Choi, Daniel S; Al Fahim, Mohamed; Burchfield, Larry A (2018). "Protomene: A new carbon allotrope" (PDF). Carbon. 126: 574–579. doi:10.1016/j.carbon.2017.10.069. Archived from the original (PDF) on 19 اكتبر 2022. Retrieved 17 February 2021.
{{cite journal}}: Check date values in:|archive-date=(help) - ↑ Delodovici, Francesco; Choi, Daniel S.; Al Fahim, Mohamed; Burchfield, Larry A.; Manini, Nicola (2019). "Carbon sp chains in diamond nanocavities". Physical Chemistry Chemical Physics (به هلندی). Royal Society of Chemistry (RSC). 21 (39). doi:10.1039/c9cp03978c. ISSN 1463-9076.
- ↑ Gibbs, W. Wayt (2019-11-15). "A new form of pure carbon dazzles and attracts". Science (به انگلیسی). 366 (6467): 782–783. doi:10.1126/science.366.6467.782. ISSN 0036-8075. PMID 31727805.
- ↑ ۱۰۶٫۰ ۱۰۶٫۱ "Why is Carbon the Key to Life (On Earth, Anyway)". ACS. Archived from the original on 23 July 2020. Retrieved 2020-07-23.
- ↑ Burrows, A.; Holman, J.; Parsons, A.; Pilling, G.; Price, G. (2017). Chemistry3: Introducing Inorganic, Organic and Physical Chemistry. Oxford University Press. p. 70. ISBN 978-0-19-873380-5. Archived from the original on 2017-11-22. Retrieved 2017-05-07.
- ↑ "Hydrocarbons". FSU chemistry - Florida State University. Archived from the original on 25 December 2017. Retrieved 2020-07-13.
- ↑ Housecroft, Catherine E.; Constable, Edwin C. (2006). Chemistry - An introduction to organic, inorganic and physical chemistry (3rd ed.). Prentice Hall. p. 945. ISBN 978-0-13-127567-6.
- ↑ (IUPAC), Applied Chemistry (2014-02-24). "functional group (F02555)". IUPAC (به لاتین). Archived from the original on 16 May 2019. Retrieved 2021-02-17.
- ↑ "Carbon: Always Tetravalent and Often Tetrahedral". Libretexts. Jun 5, 2019. Archived from the original on 4 December 2020. Retrieved 2020-07-13.
- ↑ "Exceptions to the Octet Rule". Libretexts. Jul 29, 2019. Archived from the original on 4 December 2020. Retrieved 2020-07-13.
- ↑ "Hydrocarbons". Opentextbc. Archived from the original on 18 October 2020. Retrieved 2020-07-13.
- ↑ Knowles, J. R. (1980). "Enzyme-catalyzed phosphoryl transfer reactions". Annu. Rev. Biochem. 49: 877–919. doi:10.1146/annurev.bi.49.070180.004305. PMID 6250450.
- ↑ Levine, Joel S.; Augustsson, Tommy R.; Natarajan, Murali (1982). "The prebiological paleoatmosphere: stability and composition". Origins of Life and Evolution of Biospheres. 12 (3): 245–259. Bibcode:1982OrLi...12..245L. doi:10.1007/BF00926894. PMID 7162799.
- ↑ Loerting, T.; et al. (2001). "On the Surprising Kinetic Stability of Carbonic Acid". Angew. Chem. Int. Ed. 39 (5): 891–895. doi:10.1002/(SICI)1521-3773(20000303)39:5<891::AID-ANIE891>3.0.CO;2-E. PMID 10760883.
- ↑ Greenwood and Earnshaw, pp. 289–292.
- ↑ "Carbon disulfide - an overview | ScienceDirect Topics". www.sciencedirect.com (به انگلیسی). Archived from the original on 9 May 2020. Retrieved 2018-03-07.
- ↑ Haldane J. (1895). "The action of carbonic oxide on man". Journal of Physiology. 18 (5–6): 430–462. doi:10.1113/jphysiol.1895.sp000578. PMID 16992272.
- ↑ Gorman, D.; Drewry, A.; Huang, Y. L.; Sames, C. (2003). "The clinical toxicology of carbon monoxide". Toxicology. 187 (1): 25–38. doi:10.1016/S0300-483X(03)00005-2. PMID 12679050.
- ↑ "Compounds of carbon: carbon suboxide". Archived from the original on 2007-12-07. Retrieved 2007-12-03.
- ↑ Bayes, K. (1961). "Photolysis of Carbon Suboxide". Journal of the American Chemical Society. 83 (17): 3712–3713. doi:10.1021/ja01478a033.
- ↑ Anderson D. J.; Rosenfeld, R. N. (1991). "Photodissociation of Carbon Suboxide". Journal of Chemical Physics. 94 (12): 7852–7867. Bibcode:1991JChPh..94.7857A. doi:10.1063/1.460121.
- ↑ Sabin, J. R.; Kim, H. (1971). "A theoretical study of the structure and properties of carbon trioxide". Chemical Physics Letters. 11 (5): 593–597. Bibcode:1971CPL....11..593S. doi:10.1016/0009-2614(71)87010-0.
- ↑ Moll N. G.; Clutter D. R.; Thompson W. E. (1966). "Carbon Trioxide: Its Production, Infrared Spectrum, and Structure Studied in a Matrix of Solid CO2". Journal of Chemical Physics. 45 (12): 4469–4481. Bibcode:1966JChPh..45.4469M. doi:10.1063/1.1727526.
- ↑ ۱۲۶٫۰ ۱۲۶٫۱ Fatiadi, Alexander J.; Isbell, Horace S.; Sager, William F. (1963). "Cyclic Polyhydroxy Ketones. I. Oxidation Products of Hexahydroxybenzene (Benzenehexol)" (PDF). Journal of Research of the National Bureau of Standards Section A. 67A (2): 153–162. doi:10.6028/jres.067A.015. PMID 31580622. Archived from the original (PDF) on 2009-03-25. Retrieved 2009-03-21.
- ↑ Pauling, L. (1960). The Nature of the Chemical Bond (3rd ed.). Ithaca, NY: Cornell University Press. p. 93. ISBN 978-0-8014-0333-0. Archived from the original on 10 June 2020. Retrieved 26 June 2020.
- ↑ Greenwood and Earnshaw, pp. 297–301
- ↑ Crabtree, Robert H. (2009). The Organometallic Chemistry of the Transition Metals (5th ed.). New York, NY: John Wiley and Sons. pp. 2, 560, and passim. ISBN 978-0-470-25762-3. Retrieved 23 May 2016.
- ↑ Oliveira, José; Elschenbroich, Christoph (2006). Organometallics (3. , completely rev. and extended ed.). Weinheim: Wiley-VCH-Verl. ISBN 978-3-527-29390-2.
- ↑ Scherbaum, Franz; et al. (1988). ""Aurophilicity" as a consequence of Relativistic Effects: The Hexakis(triphenylphosphaneaurio)methane Dication [(Ph3PAu)6C]2+". Angew. Chem. Int. Ed. Engl. 27 (11): 1544–1546. doi:10.1002/anie.198815441.
- ↑ Ritter, Stephen K. "Six bonds to carbon: Confirmed". Chemical & Engineering News. Archived from the original on 2017-01-09.
- ↑ Yamashita, Makoto; Yamamoto, Yohsuke; Akiba, Kin-ya; Hashizume, Daisuke; Iwasaki, Fujiko; Takagi, Nozomi; Nagase, Shigeru (2005-03-01). "Syntheses and Structures of Hypervalent Pentacoordinate Carbon and Boron Compounds Bearing an Anthracene Skeleton − Elucidation of Hypervalent Interaction Based on X-ray Analysis and DFT Calculation". Journal of the American Chemical Society. 127 (12): 4354–4371. doi:10.1021/ja0438011. ISSN 0002-7863. PMID 15783218.
- ↑ Berry, John F. (2012). "The role of three-center/four-electron bonds in superelectrophilic dirhodium carbene and nitrene catalytic intermediates". Dalton Trans. (به انگلیسی). Royal Society of Chemistry (RSC). 41 (3). doi:10.1039/c1dt11434d. ISSN 1477-9226.
- ↑ ۱۳۵٫۰ ۱۳۵٫۱ ۱۳۵٫۲ Hoover, Rachel (21 February 2014). "Need to Track Organic Nano-Particles Across the Universe? NASA's Got an App for That". NASA. Archived from the original on 6 September 2015. Retrieved 2014-02-22.
- ↑ Lauretta, D.S.; McSween, H.Y. (2006). Meteorites and the Early Solar System II. Space science series. University of Arizona Press. p. 199. ISBN 978-0-8165-2562-1. Archived from the original on 2017-11-22. Retrieved 2017-05-07.
- ↑ Mark, Kathleen (1987). Meteorite Craters. University of Arizona Press. ISBN 978-0-8165-0902-7.
- ↑ "Online Database Tracks Organic Nano-Particles Across the Universe". Sci Tech Daily. February 24, 2014. Archived from the original on March 18, 2015. Retrieved 2015-03-10.
- ↑ "Carbon-14 formation". Archived from the original on 1 August 2015. Retrieved 13 October 2014.
- ↑ Aitken, M.J. (1990). Science-based Dating in Archaeology. pp. 56–58. ISBN 978-0-582-49309-4.
- ↑ Nichols, Charles R. "Voltatile Products from Carbonaceous Asteroids" (PDF). UAPress.Arizona.edu. Archived from the original (PDF) on 2 July 2016. Retrieved 12 November 2016.
- ↑ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (1997). "The NUBASE evaluation of nuclear and decay properties" (PDF). Nuclear Physics A. 624 (1): 1–124. Bibcode:1997NuPhA.624....1A. doi:10.1016/S0375-9474(97)00482-X. Archived from the original (PDF) on 2008-09-23.
- ↑ "Triple Alpha Process - COSMOS". Centre for Astrophysics and Supercomputing (CAS) | Swinburne (به انگلیسی). Archived from the original on 17 June 2020. Retrieved 2020-12-15.
- ↑ Ostlie, Dale A. & Carroll, Bradley W. (2007). An Introduction to Modern Stellar Astrophysics. San Francisco (CA): Addison Wesley. ISBN 978-0-8053-0348-3.
- ↑ Whittet, Douglas C. B. (2003). Dust in the Galactic Environment. CRC Press. pp. 45–46. ISBN 978-0-7503-0624-9.
- ↑ Pikelʹner, Solomon Borisovich (1977). Star Formation. Springer. p. 38. ISBN 978-90-277-0796-3. Archived from the original on 2012-11-23. Retrieved 2011-06-06.
- ↑ McDonough, W.F.; Sun, S. -s. (28 March 1995). "The composition of the Earth". Chemical Geology (به انگلیسی). Elsevier BV. 120 (3–4). doi:10.1016/0009-2541(94)00140-4. ISSN 0009-2541.
- ↑ William F McDonough The composition of the Earth بایگانیشده در ۲۸ سپتامبر ۲۰۱۱ توسط Wayback Machine in Majewski, Eugeniusz (2000). Earthquake Thermodynamics and Phase Transformation in the Earth's Interior. ISBN 978-0-12-685185-4.
- ↑ Swanston, C. (June 2017). "Global Carbon". NASA. Archived from the original on 24 October 2020. Retrieved 30 July 2020.
- ↑ Yinon Bar-On; et al. (Jun 19, 2018). "The biomass distribution on Earth". PNAS. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ↑ Fred Pearce (2014-02-15). "Fire in the hole: After fracking comes coal". New Scientist. 221 (2956): 36–41. Bibcode:2014NewSc.221...36P. doi:10.1016/S0262-4079(14)60331-6. Archived from the original on 2015-03-16.
- ↑ Knight, Helen (2019-02-26). "Wonderfuel: Welcome to the age of unconventional gas". New Scientist (به انگلیسی). Archived from the original on 14 June 2020. Retrieved 2021-02-17.
- ↑ "Ocean methane stocks 'overstated'". BBC NEWS (به انگلیسی). 2004-02-17. Archived from the original on 25 April 2013. Retrieved 2021-02-17.
- ↑ Pearce, Fred (2019-02-26). "Ice on fire: The next fossil fuel". New Scientist (به انگلیسی). Archived from the original on 13 April 2016. Retrieved 2021-02-17.
- ↑ Calculated from file global.1751_2008.csv in "Index of /ftp/ndp030/CSV-FILES". Archived from the original on 2011-10-22. Retrieved 2011-11-06. from the Carbon Dioxide Information Analysis Center.
- ↑ Rachel Gross (Sep 21, 2013). "Deep, and dank mysterious". New Scientist: 40–43. Archived from the original on 2013-09-21.
- ↑ Stefanenko, R. (1983). Coal Mining Technology: Theory and Practice. Society for Mining Metallurgy. ISBN 978-0-89520-404-2.
- ↑ Kasting, James (1998). "The Carbon Cycle, Climate, and the Long-Term Effects of Fossil Fuel Burning". Consequences: The Nature and Implication of Environmental Change. 4 (1). Archived from the original on 2008-10-24.
- ↑ "World graphite reserves as of 2019, by country". Statista. Archived from the original on 12 June 2020. Retrieved 30 July 2020.
- ↑ "Major countries in worldwide graphite mine production from 2015 to 2019". Statista. Archived from the original on 26 October 2020. Retrieved 30 July 2020.
- ↑ "Countries with the largest diamond reserves as of 2019 (in million carats)". Statista. Archived from the original on 31 July 2020. Retrieved 30 July 2020.
- ↑ "Major countries in worldwide industrial diamond mine production from 2014 to 2019 (in million carats)". Statista. Archived from the original on 4 December 2020. Retrieved 30 July 2020.
- ↑ "Industrial Diamonds Statistics and Information". United States Geological Survey. Archived from the original on 6 May 2009. Retrieved May 5, 2009.
- ↑ Society, National Geographic (2020-03-26). "Carbon Sources and Sinks". National Geographic Society (به انگلیسی). Archived from the original on 14 December 2020. Retrieved 2020-12-14.
- ↑ "CARBON SINK - EESC Glossaries". European Economic and Social Committee | (به لاتین). Archived from the original on 13 November 2020. Retrieved 2020-12-14.
{{cite web}}: نگهداری CS1: نقطهگذاری اضافه (link) - ↑ "carbon sink". European Environment Agency (به انگلیسی). 2017-02-14. Archived from the original on 27 October 2020. Retrieved 2020-12-14.
- ↑ "Does harvesting in Canada's forests contribute to climate change?". Canadian Forest Service Science-Policy Notes. Natural Resources Canada. May 2007. Archived from the original (PDF) on 15 December 2020. Retrieved 15 December 2020.
- ↑ Global Forest Resources Assessment 2020 – Key findings. FAO. 2020. doi:10.4060/ca8753en. ISBN 978-92-5-132581-0.
- ↑ Harvey, Fiona (2020-03-04). "Tropical forests losing their ability to absorb carbon, study finds". The Guardian (به انگلیسی). ISSN 0261-3077. Archived from the original on 3 December 2020. Retrieved 2020-03-05.
- ↑ Falkowski, P.; Scholes, R. J.; Boyle, E.; Canadell, J.; Canfield, D.; Elser, J.; Gruber, N.; Hibbard, K.; et al. (2000). "The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System". Science. 290 (5490): 291–296. Bibcode:2000Sci...290..291F. doi:10.1126/science.290.5490.291. PMID 11030643.
- ↑ Smith, T. M.; Cramer, W. P.; Dixon, R. K.; Leemans, R.; Neilson, R. P.; Solomon, A. M. (1993). "The global terrestrial carbon cycle". Water, Air, & Soil Pollution. 70 (1–4): 19–37. Bibcode:1993WASP...70...19S. doi:10.1007/BF01104986.
- ↑ "Knowledge reference for national forest assessments - modeling for estimation and monitoring". www.fao.org. Archived from the original on 13 January 2020. Retrieved Feb 20, 2019.
- ↑ "Astrobiology". Biology Cabinet. September 26, 2006. Archived from the original on 12 December 2010. Retrieved 2011-01-17.
- ↑ "Polycyclic Aromatic Hydrocarbons: An Interview With Dr. Farid Salama". Astrobiology magazine. 2000. Archived from the original on 2008-06-20. Retrieved 2008-10-20.
- ↑ Darling, David. "Carbon-based life". Encyclopedia of Life. Archived from the original on 30 June 2013. Retrieved 14 September 2007.
- ↑ "There are close to ten million known carbon compounds, many thousands of which are vital to organic and life processes." Chemistry Operations (December 15, 2003). "Carbon". Los Alamos National Laboratory. Archived from the original on 2008-09-13. Retrieved 2008-10-09.
- ↑ Deming, Anna (2010). "King of the elements?". Nanotechnology. 21 (30): 300201. Bibcode:2010Nanot..21D0201D. doi:10.1088/0957-4484/21/30/300201. PMID 20664156.
- ↑ Bar-On, Yinon M.; Phillips, Rob; Milo, Ron (May 21, 2018). "The biomass distribution on Earth". Proceedings of the National Academy of Sciences. 115 (25): 6506–6511. doi:10.1073/pnas.1711842115. PMC 6016768. PMID 29784790.
- ↑ editor, Damian Carrington Environment (May 21, 2018). "Humans just 0.01% of all life but have destroyed 83% of wild mammals – study". The Guardian. Archived from the original on 11 September 2018. Retrieved Feb 20, 2019 – via www.theguardian.com.
{{cite news}}:|last=has generic name (help) - ↑ "How many atoms are in the human body?". Questions and Answers (به انگلیسی). Archived from the original on 6 October 2003. Retrieved 2020-12-14.
- ↑ Reece, Jane B. (31 October 2013). Campbell Biology (10 ed.). Pearson. ISBN 978-0-321-77565-8.
- ↑ ۱۸۲٫۰ ۱۸۲٫۱ ۱۸۲٫۲ "Graphite Statistics and Information". Mineral Resources Program (به انگلیسی). Archived from the original on 16 September 2008. Retrieved 2021-02-17.
- ↑ Harlow, G. E. (1998). The nature of diamonds. Cambridge University Press. p. 223. ISBN 978-0-521-62935-5.
- ↑ Catelle, W. R. (1911). The Diamond. John Lane Company. p. 159. discussion on alluvial diamonds in India and elsewhere as well as earliest finds
- ↑ Ball, V. (1881). Diamonds, Gold and Coal of India. London, Truebner & Co. Archived from the original on 24 October 2012. Retrieved 26 June 2020. Ball was a Geologist in British service. Chapter I, Page 1
- ↑ Hershey, J. W. (1940). The Book Of Diamonds: Their Curious Lore, Properties, Tests And Synthetic Manufacture. Kessinger Pub Co. p. 28. ISBN 978-1-4179-7715-4.
- ↑ ۱۸۷٫۰ ۱۸۷٫۱ Janse, A. J. A. (2007). "Global Rough Diamond Production Since 1870". Gems and Gemology. XLIII (Summer 2007): 98–119. doi:10.5741/GEMS.43.2.98.
- ↑ ۱۸۸٫۰ ۱۸۸٫۱ Lorenz, V. (2007). "Argyle in Western Australia: The world's richest diamantiferous pipe; its past and future". Gemmologie, Zeitschrift der Deutschen Gemmologischen Gesellschaft. 56 (1/2): 35–40.
- ↑ "Microscopic diamond found in Montana". The Montana Standard. 2004-10-17. Archived from the original on 2005-01-21. Retrieved 2008-10-10.
- ↑ Cooke, Sarah (2004-10-19). "Microscopic Diamond Found in Montana". Livescience.com. Archived from the original on 2008-07-05. Retrieved 2008-09-12.
- ↑ "Delta News / Press Releases / Publications". Deltamine.com. Archived from the original on 2008-05-26. Retrieved 2008-09-12.
- ↑ Marshall, Stephen; Shore, Josh (2004-10-22). "The Diamond Life". Guerrilla News Network. Archived from the original on 2008-06-09. Retrieved 2008-10-10.
- ↑ Yakovleva, Natalia P. (2000). "Natural resource use in the Russian North: a case study of diamond mining in the Republic of Sakha". Environmental Management and Health. 11 (4): 318–336. doi:10.1108/09566160010372743.
- ↑ Bohlen, Celestine (1992). "Poor Region in Russia Lays Claim to Its Diamonds". New York Times. Archived from the original on 19 March 2018. Retrieved 18 March 2018.
- ↑ "High Performance Carbon Fibers". National Historic Chemical Landmarks. American Chemical Society. 2003. Archived from the original on 2014-04-27. Retrieved 2014-04-26.
- ↑ "The Gifted Men Who Worked for Edison". National Park Service. Archived from the original on 2015-02-07. Retrieved 2014-12-01.
- ↑ "graphene definition, meaning – what is graphene in the British English Dictionary & Thesaurus – Cambridge Dictionaries Online". cambridge.org. Archived from the original on 17 July 2015. Retrieved 29 June 2020.
- ↑ "graphene noun - Definition, pictures, pronunciation and usage notes | Oxford Advanced Learner's Dictionary at OxfordLearnersDictionaries.com". www.oxfordlearnersdictionaries.com. Archived from the original on 22 July 2019. Retrieved 29 June 2020.
- ↑ ۱۹۹٫۰ ۱۹۹٫۱ Novoselov, K. S.; Geim, A. K.; Morozov, S. V.; Jiang, D.; Zhang, Y.; Dubonos, S. V.; Grigorieva, I. V.; Firsov, A. A. (2004-10-22). "Electric Field Effect in Atomically Thin Carbon Films". Science. 306 (5696): 666–669. arXiv:cond-mat/0410550. Bibcode:2004Sci...306..666N. doi:10.1126/science.1102896. ISSN 0036-8075. PMID 15499015.
- ↑ "graphene properties – Graphene Flagship EU". Archived from the original on 2 July 2020. Retrieved 29 June 2020.
- ↑ Lee, Changgu (2008). "Measurement of the Elastic Properties and Intrinsic Strength of Monolayer Graphene". Science. 321 (385): 385–388. Bibcode:2008Sci...321..385L. doi:10.1126/science.1157996. PMID 18635798.
- ↑ Cao, K. (2020). "Elastic straining of free-standing monolayer graphene". Nature Communications. 11 (284): 284. Bibcode:2020NatCo..11..284C. doi:10.1038/s41467-019-14130-0. PMID 31941941.
- ↑ Mrmak, Nebojsa (2014-11-28). "Graphene properties (A Complete Reference)". Graphene-Battery.net. Archived from the original on 25 February 2020. Retrieved 2019-11-10.
- ↑ Li, Zhilin; Chen, Lianlian; Meng, Sheng; Guo, Liwei; Huang, Jiao; Liu, Yu; Wang, Wenjun; Chen, Xiaolong (2015). "Field and temperature dependence of intrinsic diamagnetism in graphene: Theory and experiment". Phys. Rev. B. 91 (9): 094429. Bibcode:2015PhRvB..91i4429L. doi:10.1103/PhysRevB.91.094429.
- ↑ E., Shinn; A., Hubler; D., Lyon; M., Grosse-Perdekamp; A., Bezryadin; A., Belkin (22 October 2012). "Nuclear Energy Conversion with Stacks of Graphene Nano-capacitors". Complexity. 18 (3): 24–27. Bibcode:2013Cmplx..18c..24S. doi:10.1002/cplx.21427.
- ↑ Boehm, H. P.; Clauss, A.; Fischer, G. O.; Hofmann, U. (1962-07-01). "Das Adsorptionsverhalten sehr dünner Kohlenstoff-Folien". Zeitschrift für Anorganische und Allgemeine Chemie. 316 (3–4): 119–127. doi:10.1002/zaac.19623160303. ISSN 1521-3749.
- ↑ "This Month in Physics History: October 22, 2004: Discovery of Graphene". APS News. Series II. 18 (9): 2. 2009. Archived from the original on 3 July 2020. Retrieved 4 December 2020.
- ↑ "The Story of Graphene". www.graphene.manchester.ac.uk. The University of Manchester. 10 September 2014. Archived from the original on 9 October 2014. Retrieved 9 October 2014.
- ↑ "The Nobel Prize in Physics 2010". The Nobel Foundation. Archived from the original on 23 January 2012. Retrieved 3 December 2013.
- ↑ Bethune, D. S.; Kiang, C. H.; De Vries, M. S.; Gorman, G.; Savoy, R.; Vazquez, J.; Beyers, R. (1993). "Cobalt-catalyzed growth of carbon nanotubes with single-atomic-layer walls". Nature. 363 (6430): 605–607. Bibcode:1993Natur.363..605B. doi:10.1038/363605a0.
- ↑ Iijima, Sumio (7 November 1991). "Helical microtubules of graphitic carbon". Nature. 354 (6348): 56–58. Bibcode:1991Natur.354...56I. doi:10.1038/354056a0.
- ↑ Tans, S.J.; Devoret, M.H.; Dai., H.; Thess, A.; Smalley, R.E.; Geerligs, L.J.; Dekker, C. (1997). "Individual single-wall carbon nanotubes as quantum wires". Nature. 386 (6624): 374–377. Bibcode:1997Natur.386..474T. doi:10.1038/386474a0. Archived from the original on 4 December 2020. Retrieved 29 June 2020.
- ↑ Mintmire, J.W.; Dunlap, B.I.; White, C.T. (1992). "Are fullerene tubules metallic?". Phys. Rev. Lett. 68 (5): 631–634. Bibcode:1992PhRvL..68..631M. doi:10.1103/PhysRevLett.68.631. PMID 10045950.
- ↑ Yu, M. -F; Lourie, O.; Dyer, M.J.; Moloni, K.; Kelley, T.F.; Ruoff, R.S. (2000). "Strength and breaking mechanism of multiwalled carbon nanotubes under tensile load". Science. 287 (5453): 637–40. Bibcode:2000Sci...287..637Y. doi:10.1126/science.287.5453.637. PMID 10649994.
- ↑ Bever, S.; Kwon, Y. -K.; Tomanek, D. (2000). "Unusually high thermal conductivity of carbon nanotubes". Phys. Rev. Lett. 84 (20): 4613–4616. arXiv:cond-mat/0002414. Bibcode:2000PhRvL..84.4613B. doi:10.1103/PhysRevLett.84.4613. PMID 10990753.
- ↑ Kim, P.; Shi, L.; Majumdar, A.; McEuen, P.L. (2001). "Thermal transport measurements of individual multi walled nanotubes". Phys. Rev. Lett. 87 (21): 215502. arXiv:cond-mat/0106578. Bibcode:2001PhRvL..87u5502K. doi:10.1103/PhysRevLett.87.215502. PMID 11736348.
- ↑ Karousis, Nikolaos; Tagmatarchis, Nikos; Tasis, Dimitrios (2010-06-14). "Current progress on the chemical modification of carbon nanotubes". Chemical Reviews. 110 (9): 5366–5397. doi:10.1021/cr100018g. PMID 20545303.
- ↑ "Applications of Carbon Nanotubes". AZoNano.com (به انگلیسی). 2018-04-23. Archived from the original on 9 August 2020. Retrieved 2020-12-15.
- ↑ Janas, Dawid; Koziol, Krzysztof K. (2014). "A review of production methods of carbon nanotube and graphene thin films for electrothermal applications". Nanoscale. 6 (6): 3037–3045. Bibcode:2014Nanos...6.3037J. doi:10.1039/C3NR05636H. PMID 24519536.
- ↑ "The allotropes of carbon". Interactive Nano-Visualization in Science & Engineering Education. Archived from the original on 18 June 2010. Retrieved 29 August 2010.
- ↑ Buseck, P.R.; Tsipursky, S.J.; Hettich, R. (1992). "Fullerenes from the Geological Environment". Science. 257 (5067): 215–7. Bibcode:1992Sci...257..215B. doi:10.1126/science.257.5067.215. PMID 17794751.
- ↑ Cami, J; Bernard-Salas, J.; Peeters, E.; Malek, S. E. (2 September 2010). "Detection of C
60 and C
70 in a Young Planetary Nebula". Science. 329 (5996): 1180–2. Bibcode:2010Sci...329.1180C. doi:10.1126/science.1192035. PMID 20651118. - ↑ Gill, Victoria (22 July 2010). "Stars reveal carbon 'spaceballs'". BBC. Archived from the original on 14 August 2020.
- ↑ Belkin, A.; et., al. (2015). "Self-Assembled Wiggling Nano-Structures and the Principle of Maximum Entropy Production". Sci. Rep. 5: 8323. Bibcode:2015NatSR...5E8323B. doi:10.1038/srep08323. PMC 4321171. PMID 25662746.
- ↑ "The Nobel Prize in Chemistry ۱۹۹۶" (به انگلیسی). Nobelprize.org. Archived from the original on 22 June 2013.
- ↑ A. Karton; B. Chan; K. Raghavachari & L. Radom (2013). "Evaluation of the heats of formation of corannulene and C60 by means of high-level theoretical procedures". Journal of Physical Chemistry A. 117 (8): 1834–1842. Bibcode:2013JPCA..117.1834K. doi:10.1021/jp312585r. PMID 23343032.
- ↑ Azom (15 July 2006). "Buckminsterfullerene and Buckyballs – Definition, Discovery, Structure, Production, Properties and Applications". AZoM.com. Archived from the original on 14 August 2020.
- ↑ ۲۲۸٫۰ ۲۲۸٫۱ Omidvarborna; et al. (2015). "Recent studies on soot modeling for diesel combustion". Renewable and Sustainable Energy Reviews. 48: 635–647. doi:10.1016/j.rser.2015.04.019.
- ↑ ۲۲۹٫۰ ۲۲۹٫۱ Omidvarborna; et al. (2014). "Characterization of particulate matter emitted from transit buses fueled with B20 in idle modes". Journal of Environmental Chemical Engineering. 2 (4): 2335–2342. doi:10.1016/j.jece.2014.09.020.
- ↑ Seinfeld, John H.; Pandis, Spyros N. (2006). Atmospheric Chemistry and Physics: From Air Pollution to Climate Change (2nd ed.). John Wiley & Sons. ISBN 0-471-72018-6.
- ↑ D’Anna, A. (2015). Kinetics of Soot Formation (به انگلیسی). Elsevier. doi:10.1016/b978-0-12-409547-2.11524-0.
- ↑ "Health Concerns Associated with Excessive Idling". Nctcog.org. Archived from the original on 16 January 2014. Retrieved 2013-12-04.
- ↑ Miller, Kristin A.; Siscovick, David S.; Sheppard, Lianne; Shepherd, Kristen; Sullivan, Jeffrey H.; Anderson, Garnet L.; Kaufman, Joel D. (11 February 2007). "Long-Term Exposure to Air Pollution and Incidence of Cardiovascular Events in Women". New England Journal of Medicine (به انگلیسی). Massachusetts Medical Society. 356 (5). doi:10.1056/nejmoa054409. ISSN 0028-4793.
- ↑ "Full text of "Encyclopaedia Britannica Dict.A.S.L.G.I.11thEd.Chisholm.1910-1911-1922.33vols."". Internet Archive (به انگلیسی). 2020-06-10. Retrieved 2021-02-17.
- ↑ "Application Examples of carbon black". Mitsubishi Chemical. Archived from the original on 27 September 2017. Retrieved 2013-01-14.
- ↑ Jin, Zhong; Lu, Wei; O’Neill, Kevin J.; Parilla, Philip A.; Simpson, Lin J.; Kittrell, Carter; Tour, James M. (2011-02-22). "Nano-Engineered Spacing in Graphene Sheets for Hydrogen Storage". Chemistry of Materials. 23 (4): 923–925. doi:10.1021/cm1025188. ISSN 0897-4756.
- ↑ Meetyoucarbide (22 May 2019). "Characteristics of cemented carbide". Meetyoucarbide. Archived from the original on 4 December 2020. Retrieved 14 August 2020.
- ↑ Norman, J. Hyne (2001). Nontechnical guide to petroleum geology, exploration, drilling, and production (2nd ed.). Tulsa, OK: Penn Well Corp. pp. 1–4. ISBN 978-0-87814-823-3. OCLC 49853640.
- ↑ Romeo, Tony (2008). Bacterial biofilms. Berlin: Springer. pp. 258–263. ISBN 978-3-540-75418-3.
- ↑ "Classification of Carbon and Low-Alloy Steels :: KEY to METALS Articles". Key to Metals AG (به انگلیسی). Archived from the original on 8 April 2016. Retrieved 2020-12-15.
- ↑ topdealsonline (2020-09-17). "How Long Do Carbon Brushes Last in Power Tools?". Top Deals Online (به انگلیسی). Archived from the original on 9 October 2020. Retrieved 2020-10-06.
- ↑ Cantwell, W. J.; Morton, J. (1991). "The impact resistance of composite materials – a review". Composites. 22 (5): 347–62. doi:10.1016/0010-4361(91)90549-V.
- ↑ Wu Zhao (1987). A study of wool carbonizing (PhD). University of New South Wales. School of Fibre Science and Technology. Archived from the original on 30 October 2014.
- ↑ Astudillo, Miguel F.; Thalwitz, Gunnar; Vollrath, Fritz (October 2014). "Life cycle assessment of Indian silk". Journal of Cleaner Production. 81: 158–167. doi:10.1016/j.jclepro.2014.06.007.
- ↑ Ebbing, Darrell; Gammon, Steven D. (2016). General Chemistry (به انگلیسی). Cengage Learning. ISBN 978-1-305-88729-9. Archived from the original on 15 December 2020. Retrieved 15 December 2020.
- ↑ Wikipedians, B. Chemical Elements (به انگلیسی). PediaPress. p. 229. Archived from the original on 11 July 2022. Retrieved 2020-12-15.
- ↑ Holtzapffel, Ch. (1856). Turning And Mechanical Manipulation. Charles Holtzapffel. Archived from the original on 26 March 2016. Retrieved 27 June 2020.Internet Archive
- ↑ "Industrial Diamonds Statistics and Information". United States Geological Survey. Archived from the original on 2009-05-06. Retrieved 2009-05-05.
- ↑ Coelho, R. T.; Yamada, S.; Aspinwall, D. K.; Wise, M. L. H. (1995). "The application of polycrystalline diamond (PCD) tool materials when drilling and reaming aluminum-based alloys including MMC". International Journal of Machine Tools and Manufacture. 35 (5): 761–774. doi:10.1016/0890-6955(95)93044-7.
- ↑ Harris, D. C. (1999). Materials for infrared windows and domes: properties and performance. SPIE Press. pp. 303–334. ISBN 978-0-8194-3482-1.
- ↑ Nusinovich, G. S. (2004). Introduction to the physics of gyrotrons. JHU Press. p. 229. ISBN 978-0-8018-7921-0.
- ↑ Sakamoto, M.; Endriz, J. G.; Scifres, D. R. (1992). "120 W CW output power from monolithic AlGaAs (800 nm) laser diode array mounted on diamond heatsink". Electronics Letters. 28 (2): 197–199. Bibcode:1992ElL....28..197S. doi:10.1049/el:19920123.
- ↑ Engelkemeir, Antoinette G.; Hamill, W.H.; Inghram, Mark G.; Libby, W.F. (1949). "The Half-Life of Radiocarbon (14C)". Physical Review. 75 (12): 1825. Bibcode:1949PhRv...75.1825E. doi:10.1103/PhysRev.75.1825.
- ↑ H. Godwin (1962). "Half-life of Radiocarbon". Nature. 195 (4845): 984. Bibcode:1962Natur.195..984G. doi:10.1038/195984a0. S2CID 27534222.
- ↑ J.van der Plicht and A.Hogg (2006). "A note on reporting radiocarbon" (PDF). Quaternary Geochronology. 1 (4): 237–240. doi:10.1016/j.quageo.2006.07.001. Retrieved 9 December 2017.[پیوند مرده]
- ↑ Chang, T.M.S (1996). "Editorial: past, present and future perspectives on the 40th anniversary of hemoglobin based red blood cell substitutes". Artificial Cells Blood Substit Immobil Biotechnol. 24: ixxxvi.
- ↑ Dunea G, Kolff WJ (1965). "Clinical Experience with the Yatzidis Charcoal Artificial Kidney". Transactions of the American Society for Artificial Internal Organs. 11: 178–82. doi:10.1097/00002480-196504000-00035. PMID 14329080.
- ↑ Rappazzo, Kristen; Daniels, Julie; Messer, Lynne (2015). "Exposure to Elemental Carbon, Organic Carbon, Nitrate, and Sulfate Fractions of Fine Particulate Matter and Risk of Preterm Birth in New Jersey, Ohio, and Pennsylvania (2000–2005)". Environ Health Perspect. 123 (12): 1059–1065. doi:10.1002/chem.200401299. PMID 25910280.
- ↑ Dorfer, Leopold; Moser, M.; Spindler, K.; Bahr, F.; Egarter-Vigl, E.; Dohr, G. (1998). "5200-year old acupuncture in Central Europe?". Science. 282 (5387): 242–243. Bibcode:1998Sci...282..239D. doi:10.1126/science.282.5387.239f. PMID 9841386.
- ↑ Donaldson, K.; Stone, V.; Clouter, A.; Renwick, L.; MacNee, W. (2001). "Ultrafine particles". Occupational and Environmental Medicine. 58 (3): 211–216. doi:10.1136/oem.58.3.211. PMC 1740105. PMID 11171936. Archived from the original on 2009-05-01.
- ↑ "Carbon Nanoparticles Toxic To Adult Fruit Flies But Benign To Young -- ScienceDaily". ScienceDaily (به انگلیسی). 2021-02-16. Retrieved 2021-02-17.
- ↑ "Carbon Nanoparticles Toxic to Adult Fruit Flies but Benign to Young". NSF (به انگلیسی). 2009-08-06. Retrieved 2021-02-17.
- ↑ "Press Release – Titanic Disaster: New Theory Fingers Coal Fire". www.geosociety.org. Archived from the original on 2016-04-14. Retrieved 2016-04-06.
- ↑ McSherry, Patrick. "Coal bunker Fire". www.spanamwar.com. Archived from the original on 2016-03-23. Retrieved 2016-04-06.
- ↑ "Meeting of RG2 with Windscale Pile 1 Decommissioning Project Team" (PDF). Nuclear Safety Advisory Committee. 2005-09-29. NuSAC(2005)P 18. Archived from the original (PDF) on 19 October 2020. Retrieved 2008-11-26.
- ↑ Marsden, B.J.; Preston, S.D.; Wickham, A.J. (8–10 September 1997). "Evaluation of graphite safety issues for the British production piles at Windscale". AEA Technology. IAEA. IAEA-TECDOC—1043. Archived from the original on 12 October 2008. Retrieved 13 November 2010.
- ↑ "Environmental and Health Effects of Cyanide". International Cyanide Management Institute. 2006. Archived from the original on 30 November 2012. Retrieved 4 August 2009.
- ↑ Dorland's Illustrated Medical Dictionary (به انگلیسی) (32 ed.). Elsevier Health Sciences. 2011. p. 1481. ISBN 978-1-4557-0985-4. Archived from the original on 8 September 2017.
- ↑ ۲۶۹٫۰ ۲۶۹٫۱ Anseeuw, K; Delvau, N; Burillo-Putze, G; De Iaco, F; Geldner, G; Holmström, P; Lambert, Y; Sabbe, M (February 2013). "Cyanide poisoning by fire smoke inhalation: a European expert consensus". European Journal of Emergency Medicine. 20 (1): 2–9. doi:10.1097/mej.0b013e328357170b. PMID 22828651.
- ↑ Hamel, J (February 2011). "A review of acute cyanide poisoning with a treatment update". Critical Care Nurse. 31 (1): 72–81, quiz 82. doi:10.4037/ccn2011799. PMID 21285466.
کتابشناسی
[ویرایش]- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link)
پیوند به بیرون
[ویرایش]- کربن (دانشنامه بریتانیکا)
- کربن (دانشگاه ایالتی آریزونا)
- کاربردهای الکتروشیمیایی کربن
- کربن (برنامه در دوران ما، بیبیسی)
- کربن (ویدئوهای جدول تناوبی از دانشگاه ناتینگهام)
| جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||






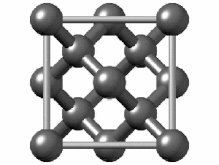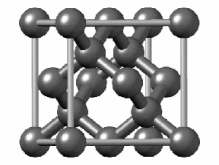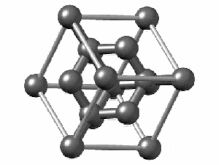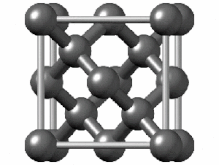





















![یکی از مشتقات فروسن که بهعنوان عامل ضدکوبش[ah] به بنزین اضافه میشود.](http://upload.wikimedia.org/wikipedia/commons/thumb/6/63/Josiphos.png/169px-Josiphos.png)












