سرب
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرب | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /ˈlɛd/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | Metallic gray | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۲۰۷٫۲(۱)[۱] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرب در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 82 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | گروه ۱۴ (گروه کربن) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره 6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Post-transition metal | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Xe] 4f14 5d10 6s2 6p2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 600.61 K (327.46 °C, 621.43 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 2022 K (1749 °C, 3180 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 11.34 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 10.66 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 4.77 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 179.5 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 26.650 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | −4, −2, −1, +1, +2, +3, +4 (an amphoteric اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 2.33 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 175 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 146±5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 202 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | (fcc) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 28.9 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 35.3 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 208 n Ω·m (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | diamagnetic | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 16 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 5.6 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 46 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبت پواسون | 0.44 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی موس | 1.5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 38.3 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7439-92-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای سرب | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
سرب (/lɛd/) یک عنصر شیمیایی است که نماد شیمیایی آن Pb (برگرفته از واژه لاتین plumbum) و عدد اتمی آن ۸۲ است. این عنصر یک فلز سنگین است که چگالی آن از بیشتر مواد رایج بالاتر است. سرب دارای سختی موس کم و شکلپذیری بالا است و همچنین نقطه ذوب نسبتاً پایینی دارد. هنگامی که تازه بریده میشود، سطح آن به رنگ خاکستری براق با تهرنگی آبی است، اما پس از قرار گرفتن در معرض هوا، به رنگ خاکستری کدر تغییر مییابد. سرب دارای بالاترین عدد اتمی در میان ایزوتوپهای پایدار است و سه مورد از ایزوتوپهای آن نقطه پایان زنجیره واپاشی اصلی عناصر سنگینتر هستند.
سرب یک فلز پسواسطه نسبتاً غیرفعال است. ویژگی فلزی ضعیف آن با آمفوتر بودن آن مشخص میشود؛ سرب و اکسیدهای سرب با اسیدها و بازها واکنش نشان میدهند و تمایل به تشکیل پیوند کووالانسی دارند. ترکیبهای شیمیایی سرب معمولاً در عدد اکسایش +۲ پایدارترند تا در +۴ که در اعضای سبکتر گروه کربن رایج است. استثناهای این قاعده عمدتاً به ترکیب آلی سرب محدود میشوند. همانند سایر اعضای این گروه، سرب تمایل دارد با خودش پیوند برقرار کند (catenation) و میتواند زنجیرهها و ساختارهای چندوجهی تشکیل دهد.
از آنجایی که سرب بهراحتی از کانسنگهای خود استخراج میشود، مردمان پیشاتاریخ در خاور نزدیک با آن آشنا بودند. گالن، یکی از سنگهای معدنی اصلی سرب، اغلب دارای نقره نیز هست. علاقه به نقره موجب آغاز استخراج گسترده و استفاده از سرب در روم باستان شد. تولید سرب پس از سقوط امپراتوری روم غربی کاهش یافت و تا انقلاب صنعتی به سطح قابل مقایسهای نرسید. سرب نقش مهمی در توسعه چاپ فشاری داشت، زیرا چاپ سربی را میتوان بهراحتی از آلیاژهای سرب قالبگیری کرد.[۲] در سال ۲۰۱۴، تولید سالانه جهانی سرب حدود ده میلیون تن بود که بیش از نیمی از آن از بازیافت به دست میآمد.
چگالی بالا، نقطه ذوب پایین، شکلپذیری و پایداری نسبی در برابر اکسایش-کاهش، سرب را به فلزی کاربردی تبدیل کرده است. این ویژگیها، همراه با فراوانی نسبی و هزینه پایین، منجر به استفاده گسترده از آن در ساختوساز، لولهکشی، باتری اسید-سرب، گلوله، ساچمه، جرم (فیزیک)، لحیمها، مسوارها، آلیاژهای گدازپذیر، رنگ سربی، تترااتیلسرب و محافظهای سربی شده است.
سرب یک نوروتوکسین است که در بافتهای نرم و استخوانها تجمع مییابد. این عنصر به سیستم عصبی آسیب میزند و با اختلال در عملکرد آنزیمهای زیستی، باعث اختلال عصبی میشود که میتواند از مشکلات رفتاری تا آسیب مغزی متغیر باشد. همچنین، بر سلامت عمومی، سیستمهای قلبیعروقی و کلیوی تأثیر منفی میگذارد. سمیت سرب نخستین بار توسط نویسندگان یونانی و رومی باستان ثبت شد که به برخی از نشانههای مسمومیت با سرب اشاره کردند، اما این موضوع تا اواخر قرن ۱۹ میلادی در اروپا بهطور گسترده شناخته نشد.
ویژگی فیزیکی
[ویرایش]اتمی
[ویرایش]یک اتم سرب دارای ۸۲ الکترون است که در یک آرایش الکترونی بهصورت [زنون]4f145d106s26p2 مرتب شدهاند. مجموع اولین و دومین انرژی یونش سرب—یعنی کل انرژی مورد نیاز برای حذف دو الکترون 6p—به مقدار انرژی یونش قلع، عنصر بالاتر از سرب در گروه کربن، نزدیک است. این امر غیرمعمول است؛ زیرا بهطور کلی، انرژیهای یونش در یک گروه با پایین رفتن کاهش مییابند، زیرا الکترونهای لایهٔ خارجی عنصر از هسته اتم دورتر شده و بیشتر در معرض اثر پوششی الکترون قرار میگیرند.
مجموع چهار انرژی یونش اول سرب از مقدار مشابه در قلع بیشتر است،[۳] برخلاف آنچه روندهای تناوبی پیشبینی میکند. این پدیده با شیمی کوانتومی نسبیتی توضیح داده میشود که در اتمهای سنگین اهمیت مییابد[۴] و منجر به فشردگی اوربیتالهای s و p میشود؛ در نتیجه، الکترونهای 6s سرب انرژی اتصال بیشتری نسبت به الکترونهای 5s آن دارند.[۵] پیامد این امر، اثر جفت غیرفعال است که باعث میشود الکترونهای 6s سرب تمایلی به شرکت در پیوند نداشته باشند، عدد اکسایش +۲ را پایدار کنند و فاصله بین نزدیکترین اتمها در بلور سرب بهطور غیرمعمولی طولانی شود.[۶]
همگروههای سبکتر سرب در گروه کربن، دگرشکلی (شیمی)های پایدار یا نیمهپایدار با ساختار پیوند کووالانسی ساختار الماس و هماهنگی چهاروجهی تشکیل میدهند. سطوح انرژی اوربیتالهای خارجی آنها به اندازهای نزدیک است که امکان ترکیب آنها در چهار اوربیتال sp3 هیبریداسیون اوربیتال فراهم شود. در سرب، اثر جفت غیرفعال باعث افزایش فاصله بین اوربیتالهای s و p میشود و این فاصله با انرژی آزادشده از پیوندهای اضافی حاصل از هیبریداسیون قابل جبران نیست.[۷] به جای داشتن ساختار مکعبی الماسی، سرب پیوند فلزی تشکیل میدهد که در آن فقط الکترونهای p بهصورت غیرموضعی توزیع شده و بین یونهای Pb2+ به اشتراک گذاشته میشوند. ازاینرو، سرب دارای یک دستگاه بلوری مکعبی است،[۸] مشابه فلزات ظرفیت شیمیایی با اندازه مشابه مانند کلسیم و استرانسیم.[۹]
تودهای
[ویرایش]سرب خالص ظاهری براق و خاکستری با تهرنگ آبی دارد.[۱۰] در تماس با هوای مرطوب تیره شده و رنگ آن بسته به شرایط محیطی تغییر میکند. خواص مشخصهٔ سرب شامل چگالی بالا، چکشخواری، انعطافپذیری، و مقاومت بالا در برابر خوردگی به دلیل غیرفعالسازی است.[۱۱]

ساختار فشردهٔ مکعبی سرب و وزن اتمی بالای آن منجر به چگالی[۱۲] ۱۱٫۳۴ g/cm3 میشود که از فلزات رایجی مانند آهن (۷٫۸۷ g/cm3)، مس (۸٫۹۳ g/cm3) و روی (۷٫۱۴ g/cm3) بیشتر است.[۱۳] این چگالی بالا منشأ اصطلاح انگلیسی to go over like a lead balloon است.[۱۴][۱۵]
سرب یک فلز بسیار نرم با سختی موس ۱٫۵ است؛ بهگونهای که میتوان آن را با ناخن خراشید.[۱۶] همچنین چکشخوار و تا حدی انعطافپذیر است.[۱۷] مدول حجمی آن—بهعنوان معیاری از سهولت فشردهشدن—۴۵٫۸ پاسکال (یکا) است. برای مقایسه، این مقدار برای آلومینیم ۷۵٫۲ GPa، مس ۱۳۷٫۸ GPa و فولاد کربنی ۱۶۰–۱۶۹ GPa است.[۱۸] مقاومت کششی نهایی سرب، در محدودهٔ ۱۲–۱۷ مگاپاسکال، پایین است (برای مقایسه، این مقدار برای آلومینیوم ۶ برابر، مس ۱۰ برابر و فولاد نرم ۱۵ برابر بیشتر است)؛ اما افزودن مقادیر اندکی مس یا آنتیموان میتواند آن را تقویت کند.[۱۹]
نقطه ذوب سرب—در ۳۲۷٫۵ °C (621.5 °F)[۲۰]—بسیار پایینتر از اکثر فلزات است.[۱۲] نقطه جوش آن ۱۷۴۹ °C (3180 °F)[۲۰] است که کمترین مقدار در بین عناصر گروه کربن محسوب میشود. مقاومت ویژه و رسانندگی الکتریکی سرب در ۲۰ °C برابر با ۱۹۲ اهم-متر است که تقریباً یک مرتبه بزرگی بیشتر از سایر فلزات صنعتی مانند مس (۱۵٫۴۳ nΩ·m)، طلا (۲۰٫۵۱ nΩ·m) و آلومینیم (۲۴٫۱۵ nΩ·m) است.[۲۱] سرب در دماهای پایینتر از ۷٫۱۹ کلوین یک ابررسانا است،[۲۲] که بالاترین ابررسانایی را در میان ابررسانا نوع یک دارد و از نظر دمای بحرانی در بین عناصر ابررسانا سوم است.[۲۳]
ایزوتوپها
[ویرایش]
سرب طبیعی شامل چهار ایزوتوپ پایدار با عدد جرمی ۲۰۴، ۲۰۶، ۲۰۷ و ۲۰۸ است،[۲۴] و همچنین دارای آثار کمی از شش ایزوتوپ پرتوزا با عمر کوتاه و اعداد جرمی ۲۰۹ تا ۲۱۴ میباشد. تعداد بالای ایزوتوپهای سرب با عدد اتمی زوج آن همخوانی دارد.[الف] سرب دارای عدد جادویی (فیزیک) پروتونها (۸۲) است که بهوسیله مدل پوستهای هسته بهعنوان یک هسته بهویژه پایدار پیشبینی میشود.[۲۵] سرب-۲۰۸ دارای ۱۲۶ نوترون، یک عدد جادویی دیگر است، که ممکن است دلیل پایداری فوقالعاده آن باشد.[۲۵]
با داشتن عدد اتمی بالا، سرب سنگینترین عنصری است که ایزوتوپهای طبیعی آن پایدار در نظر گرفته میشوند؛ سرب-۲۰۸ سنگینترین هسته پایدار است. (این ویژگی پیشتر به بیسموت، با عدد اتمی ۸۳، اختصاص داشت تا اینکه در سال ۲۰۰۳ مشخص شد تنها نوکلید دیرینه آن، بیسموت-۲۰۹، با سرعت بسیار کمی واپاشی میکند)[ب] چهار ایزوتوپ پایدار سرب میتوانند از نظر تئوری دچار واپاشی آلفا به ایزوتوپهای جیوه شوند، اما این پدیده در هیچکدام مشاهده نشده است؛ نیمهعمر پیشبینیشده آنها بین ۱۰۳۵ تا ۱۰۱۸۹ سال است[۲۸] (حداقل ۱۰۲۵ برابر عمر کنونی جهان).
سه ایزوتوپ پایدار سرب در سه مورد از چهار زنجیره واپاشی اصلی وجود دارند: سرب-۲۰۶، سرب-۲۰۷ و سرب-۲۰۸ محصولات نهایی واپاشی اورانیوم-۲۳۸، اورانیوم-۲۳۵ و توریوم-۲۳۲ هستند.[۲۹] غلظت این ایزوتوپها در نمونههای سنگی طبیعی به میزان اورانیوم و توریوم موجود بستگی دارد. بهعنوان مثال، فراوانی نسبی سرب-۲۰۸ میتواند از ۵۲٪ در نمونههای معمولی تا ۹۰٪ در سنگهای توریوم تغییر کند.[۳۰] به همین دلیل، وزن اتمی استاندارد سرب تنها تا یک رقم اعشار ارائه میشود.[۳۱] با گذشت زمان، نسبت سرب-۲۰۶ و سرب-۲۰۷ به سرب-۲۰۴ افزایش مییابد، زیرا دو ایزوتوپ اول از واپاشی عناصر سنگینتر تأمین میشوند در حالی که سرب-۲۰۴ اینگونه نیست؛ این ویژگی مبنای سنجش سن سرب-سرب است. علاوه بر این، تغییر نسبت اورانیوم به سرب در طول زمان، اساس سنجش سن اورانیوم-سرب را تشکیل میدهد.[۳۲] سرب-۲۰۷ دارای خاصیت رزونانس مغناطیسی هستهای است که برای مطالعه ترکیبات آن در محلول و حالت جامد،[۳۳][۳۴] و حتی در بدن انسان مورد استفاده قرار گرفته است.[۳۵]

گذشته از ایزوتوپهای پایدار، که تقریباً تمام سرب طبیعی را تشکیل میدهند، چندین ایزوتوپ پرتوزای ناچیز نیز وجود دارند. یکی از آنها سرب-۲۱۰ است که با نیمهعمر ۲۲٫۲ سال،[۲۴] به دلیل تولید مداوم در زنجیره واپاشی اورانیوم-۲۳۸ در طبیعت یافت میشود. سرب-۲۱۱٬۲۱۲ و -۲۱۴ در زنجیرههای واپاشی اورانیوم-۲۳۵، توریوم-۲۳۲ و اورانیوم-۲۳۸ حضور دارند، بنابراین ردپای آنها نیز در طبیعت دیده میشود.[۳۶]
در مجموع، ۴۳ ایزوتوپ سرب با عدد جرمی ۱۷۸ تا ۲۲۰ سنتز شدهاند.[۲۴] پایدارترین ایزوتوپ پرتوزا، سرب-۲۰۵ است که نیمهعمری در حدود ۱٫۷۰×۱۰۷ سال دارد.الگو:NUBASE2020 دومین ایزوتوپ پرتوزای پایدار، سرب-۲۰۲ است که نیمهعمری حدود ۵۲٬۵۰۰ سال دارد.[۲۴]
ویژگی شیمیایی
[ویرایش]
سرب حجمی که در معرض هوای مرطوب قرار میگیرد، یک لایه محافظ با ترکیب متغیر تشکیل میدهد. سرب کربنات یکی از اجزای رایج است؛[۳۷][۳۸][۳۹] سرب(II) سولفات یا سرب(II) کلرید نیز ممکن است در محیطهای شهری یا دریایی حضور داشته باشند.[۴۰] این لایه باعث میشود که سرب حجمی بهطور مؤثر در هوا بیاثر شیمیایی شود.[۴۰] سرب پودری ریز شده، همانند بسیاری از فلزات، آتشزایی است،[۴۱] و با شعلهای آبی-سفید میسوزد.[۴۲]
فلوئور در دمای اتاق با سرب واکنش نشان میدهد و فلورید سرب (II) تشکیل میدهد. واکنش با کلر مشابه است اما نیاز به حرارت دارد، زیرا لایه کلرید تشکیل شده، واکنشپذیری عناصر را کاهش میدهد.[۴۰] سرب مذاب با کالکوژنها واکنش نشان میدهد و سرب(II) کالکوژنیدها را تشکیل میدهد.[۴۳]
فلز سرب در برابر سولفوریک اسید و فسفریک اسید مقاوم است اما در برابر هیدروکلریک اسید یا نیتریک اسید مقاومتی ندارد؛ نتیجه این واکنشها به نامحلول بودن و سپس غیرفعال شدن نمک حاصل بستگی دارد.[۴۴] اسیدهای آلی مانند استیک اسید در حضور اکسیژن سرب را حل میکنند.[۴۰] قلیاهای غلیظ سرب را حل کرده و plumbiteها را تشکیل میدهند.[۴۵]
ترکیبات معدنی
[ویرایش]سرب دو حالت اکسیداسیون اصلی دارد: +۴ و +۲. حالت ظرفیت شیمیایی برای گروه کربن رایج است. حالت دو ظرفیتی برای کربن و سیلیسیم نادر است، برای ژرمانیوم جزئی است، برای قلع مهم (اما نه غالب) است و برای سرب از دو حالت اکسیداسیون، مهمتر است.[۴۰] این به شیمی کوانتومی نسبیتی مربوط است، به ویژه اثر جفت ساکن، که زمانی که تفاوت زیادی در الکترونگاتیوی بین سرب و آنیونهای اکسید، هالید یا نیترید وجود دارد، بروز میکند و باعث ایجاد بار مثبت جزئی زیادی روی سرب میشود. نتیجه این است که اوربیتال 6s سرب بیشتر از اوربیتال 6p آن منقبض میشود، که آن را در ترکیبات یونی نسبتاً بیاثر میکند. اثر جفت ساکن در ترکیباتی که در آن سرب پیوندهای کووالانسی با عناصری با الکترونگاتیوی مشابه تشکیل میدهد، مانند کربن در ترکیبات ارگانوسرب، کمتر قابل اعمال است. در این ترکیبات، اوربیتالهای 6s و 6p مشابه اندازه باقی میمانند و هیبریداسیون sp3 همچنان از نظر انرژی مطلوب است. سرب، مشابه کربن، در چنین ترکیباتی عمدتاً چهار ظرفیتی است.[۴۶]
تفاوت نسبتاً زیادی در الکترونگاتیوی سرب(II) با مقدار ۱٫۸۷ و سرب(IV) با مقدار ۲٫۳۳ وجود دارد. این تفاوت معکوس شدن روند افزایش پایداری حالت اکسیداسیون +۴ را در پایینتر رفتن گروه کربن نشان میدهد؛ در مقایسه، قلع دارای مقادیر ۱٫۸۰ در حالت +۲ و ۱٫۹۶ در حالت +۴ است.[۴۷]
سرب(II)
[ویرایش]
ترکیبات سرب(II) ویژگیهای شیمیایی معدنی سرب را نشان میدهند. حتی عوامل اکسنده قوی مانند فلوئور و کلر با سرب واکنش نشان میدهند و فقط فلورید سرب (II) و سرب(II) کلرید تشکیل میدهند.[۴۰] یونهای سرب(II) معمولاً در محلول بیرنگ هستند،[۴۸] و جزئی به هیدرولیز شده و Pb(OH)+ تشکیل میدهند و در نهایت [Pb4(OH)4]4+ (که در آن یونهای هیدروکسیل به عنوان لیگاند واسطه عمل میکنند) تشکیل میشود،[۴۹][۵۰] اما مانند یونهای قلع(II) عامل کاهنده نیستند. تجزیه کیفی معدنی برای شناسایی وجود یون Pb2+ در آب معمولاً بر روی رسوب کردن سرب(II) کلرید با استفاده از اسید هیدروکلریک رقیق تمرکز دارد. از آنجا که نمک کلرید در آب به سختی حل میشود، در محلولهای رقیق بسیار، رسوب سرب(II) سولفید به جای آن با عبور هیدروژن سولفید از محلول حاصل میشود.[۵۱]
اکسید سرب (II) در دو چندریختی (علم مواد), لیترج α-PbO (قرمز) و مسیکوت β-PbO (زرد) وجود دارد که دومی تنها در دماهای بالاتر از حدود ۴۸۸ درجه سانتیگراد پایدار است. لیترج معمولترین ترکیب معدنی سرب است.[۵۲] هیچ هیدروکسید سرب(II) وجود ندارد؛ افزایش pH محلولهای نمکهای سرب(II) منجر به هیدرولیز و کندانسیون میشود.[۵۳] سرب معمولاً با چالکوجنهای سنگینتر واکنش نشان میدهد. سرب سولفید یک نیمرسانا، فوتورسانندگی و یک آشکارساز ذرات بسیار حساس است. دو چالکوجنید دیگر، سلنید سرب و تلورید سرب نیز فوتورسانا هستند. آنها در این که رنگ آنها در هنگام حرکت به سمت پایین گروه روشنتر میشود، غیرعادی هستند.[۵۴]

دیهالیدهای سرب بهخوبی شناسایی شدهاند؛ این شامل دیاستاتید[۵۵] و هالیدهای ترکیبی، مانند PbFCl است. حلناپذیری نسبی اینها مبنای مفیدی برای تعیین گراویمتری فلوئور است. دیفلورید اولین ترکیب هدایت یونی (حالت جامد) کشفشده بود (در ۱۸۳۴، توسط مایکل فارادی).[۵۶] سایر دیهالیدها هنگام قرار گرفتن در معرض نور فرابنفش یا مرئی تجزیه میشوند، بهویژه سرب (II) یدید.[۵۷] بسیاری از پسو دو هالیدها سرب(II) شناختهشدهاند، مانند سیانید، سیانات و تیوسیانات سرب (II).[۵۴][۵۸] سرب(II) یک تنوع گسترده از کمپلکسهای هالیدی کمپلکس شیمیایی را تشکیل میدهد، مانند [PbCl4]2−, [PbCl6]4− و [Pb2Cl9]n5n− آنیون زنجیرهای.[۵۷]
سرب(II) سولفات در آب حل نمیشود، مانند سولفاتهای سایر یونهای دو ارزشی سنگین. سرب (II) نیترات و سرب(II) استات بسیار حلشدنی هستند و از این ویژگی برای سنتز دیگر ترکیبهای سرب استفاده میشود.[۵۹]
سرب(IV)
[ویرایش]چند ترکیب معدنی سرب(IV) شناخته شده است. این ترکیبها فقط در محلولهای اکسیدکننده قوی تشکیل میشوند و معمولاً تحت شرایط استاندارد وجود ندارند.[۶۰] اکسید سرب(II) در اکسیداسیون بیشتر به یک اکسید ترکیبی Pb3O4 تبدیل میشود. این ترکیب بهعنوان سرنج توصیف میشود، یا بهطور ساختاری ۲PbO·PbO2، و شناختهشدهترین ترکیب سرب با بار ترکیبی است. دیاکسید سرب یک عامل اکسیدکننده قوی است که قادر به اکسید کردن اسید هیدروکلریک به گاز کلر است.[۶۱] این به این دلیل است که PbCl4 پیشبینیشدهای که تولید میشود، ناپایدار است و بهطور خودبهخود به PbCl2 و Cl2 تجزیه میشود.[۶۲] مشابه با اکسید سرب (II), دیاکسید سرب قادر به تشکیل آنیونهای plumbate است. سولفید سرب (IV)[۶۳] و دیسلنید سرب[۶۴] تنها در فشارهای بالا پایدار هستند. فلورید سرب چهارگانه، یک پودر بلوری زرد، پایدار است، اما کمتر از فلورید سرب (II). کلرید سرب چهارگانه (یک روغن زرد) در دمای اتاق تجزیه میشود، تترابروماستیل سرب کمتر از آن پایدار است، و وجود سرب تتراآیدید مورد سؤال است.[۶۵]
سایر حالات اکسیداسیون
[ویرایش]
برخی ترکیبهای سرب در حالات اکسیداسیون غیر از +۴ یا +۲ وجود دارند. سرب(III) ممکن است بهعنوان یک واسطه بین سرب(II) و سرب(IV) در کمپلکسهای بزرگتر ارگانوسرب بهدست آید؛ این حالت اکسیداسیون ناپایدار است، زیرا هم یون سرب(III) و هم کمپلکسهای بزرگتری که آن را دارند، رادیکال آزاد هستند.[۶۷][۶۸][۶۹] همین امر برای سرب(I) صادق است که میتواند در چنین گونههای رادیکالی یافت شود.[۷۰]
اکسیدهای مخلوط سرب(II,IV) بسیاری شناخته شده است. هنگامی که PbO2 در هوا گرم میشود، در دمای ۲۹۳ درجه سانتیگراد به Pb12O19 تبدیل میشود، در دمای ۳۵۱ درجه سانتیگراد به Pb12O17، در دمای ۳۷۴ درجه سانتیگراد به Pb3O4 و در نهایت در ۶۰۵ درجه سانتیگراد به PbO تبدیل میشود. یک سسکوکسید دیگر، Pb2O3، میتواند تحت فشار بالا بهدست آید، همراه با چندین فاز غیر استوکیومتریک. بسیاری از آنها ساختارهای فلوریت معیوب نشان میدهند که در آن برخی اتمهای اکسیژن با خلأها جایگزین شدهاند: PbO میتواند چنین ساختاری داشته باشد، بهطوریکه هر لایهای از اتمهای اکسیژن بهطور متناوب غایب است.[۷۱] واحدهای اکسیداسیون منفی میتوانند به صورت فاز زینتل وجود داشته باشند، بهعنوان آنیونهای آزاد سرب، مانند Ba2Pb که در آن سرب بهطور رسمی سرب(−IV) است، [۷۲] یا در یونهای خوشهای حلقوی یا چندوجهی حساس به اکسیژن مانند یون هندسه مولکولی دو هرمی مثلثی Pb52− که در آن دو اتم سرب سرب(−I) و سه اتم دیگر سرب(۰) هستند.[۷۳] در چنین آنیونهایی، هر اتم در یک رأس چندوجهی قرار دارد و دو الکترون به هر پیوند کووالانسی در امتداد یک لبه از اوربیتالهای هیبریدی sp3 خود میدهد، و دو الکترون دیگر جفت الکترون غیرپیوندی خارجی هستند.[۴۹] این آنیونها ممکن است در آمونیاک از طریق کاهش سرب توسط سدیم ساخته شوند.[۷۴]
ترکیبهای آلی سرب
[ویرایش]
کربن
هیدروژن
سرب
سرب میتواند زنجیرههای با پیوندهای چندگانه بسازد، ویژگیای که آن را با همخانوادههای سبکتر خود در گروه کربن مشترک است. ظرفیت آن برای این کار بسیار کمتر است، زیرا انرژی پیوند Pb–Pb بیش از سه و نیم برابر کمتر از پیوند کربن-کربن است.[۴۳] سرب میتواند با خود پیوندهای فلز–فلز از ترتیبی تا سه بسازد.[۷۵] با کربن، سرب ترکیبهای آلی سرب میسازد که شبیه به ترکیبهای آلی معمولی است، اما معمولاً پایداری کمتری دارند (به دلیل ضعیف بودن پیوند Pb–C).[۴۹] این موضوع باعث میشود که شیمی آلی فلزی سرب بسیار محدودتر از قلع باشد.[۷۶] سرب عمدتاً ترکیبهای آلی سرب(IV) میسازد، حتی زمانی که با واکنشدهندههای سرب(II) غیرآلی شروع میشود؛ تعداد کمی ترکیب آلی سرب(II) شناخته شدهاند. شناختهشدهترین استثناها عبارتند از Pb[CH(SiMe3)2]2 و پلمبوسن.[۷۶]
آنالوگ سربی سادهترین ترکیب آلی، متان، پلامبان است. پلامبان ممکن است در واکنشی بین سرب فلزی و هیدروژن اتمی به دست آید.[۷۷] دو مشتق ساده، tetramethyllead و تترااتیلسرب، بهترین ترکیبهای شناختهشده ترکیب آلی سرب هستند. این ترکیبها نسبتاً پایدارند: تترااتیلسرب تنها در صورتی تجزیه میشود که گرم شود[۷۸] یا در معرض نور خورشید یا نور ماوراء بنفش قرار گیرد.[۷۹][پ] با سدیم فلزی، سرب به راحتی آلیاژی به میزان مساوی تشکیل میدهد که با هالوآلکان واکنش داده و ترکیبهای شیمی آلی فلزی مانند تترااتیلسرب را میسازد.[۸۰] طبیعت اکسیدکنندگی بسیاری از ترکیبهای آلی سرب بهطور مفید مورد استفاده قرار میگیرد: استات سرب (IV) یک معرف مهم آزمایشگاهی برای اکسیداسیون در سنتز آلی است.[۸۱] تترااتیلسرب، زمانی که به بنزین خودرویی افزوده میشد، در مقادیر بیشتری نسبت به هر ترکیب آلی فلزی دیگر تولید میشد،[۷۶] و هنوز هم در بنزین هوایی بهطور گستردهای استفاده میشود.[۸۲] سایر ترکیبهای آلی سرب از نظر شیمیایی کمتر پایدار هستند.[۸۳] برای بسیاری از ترکیبهای آلی، آنالوگ سربی وجود ندارد.[۷۷]
منشأ و وقوع
[ویرایش]| Atomic number |
Element | Relative amount |
|---|---|---|
| ۴۲ | مولیبدن | ۰٫۷۹۸ |
| ۴۶ | پالادیم | ۰٫۴۴۰ |
| ۵۰ | قلع | ۱٫۱۴۶ |
| ۷۸ | پلاتین | ۰٫۴۱۷ |
| ۸۰ | جیوه | ۰٫۱۲۷ |
| ۸۲ | Lead | ۱ |
| ۹۰ | توریم | ۰٫۰۱۱ |
| ۹۲ | اورانیوم | ۰٫۰۰۳ |
در فضا
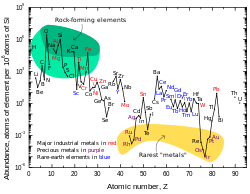
[ویرایش]مقدار سرب به ازای هر ذره در منظومه شمسی برابر با ۰٫۱۲۱ بخش در یکای سنجش (parts per billion) است.[۸۴][ت] این عدد دو و نیم برابر بیشتر از پلاتین، هشت برابر بیشتر از جیوه و هفده برابر بیشتر از طلا است.[۸۴] مقدار سرب در گیتی بهطور تدریجی در حال افزایش است[۸۵] زیرا بیشتر اتمهای سنگینتر (که همه آنها ناپایدار هستند) بهطور تدریجی به سرب تجزیه میشوند.[۸۶] میزان سرب در منظومه شمسی از زمان تشکیل آن حدود ۴٫۵ میلیارد سال پیش، تقریباً ۰٫۷۵٪ افزایش یافته است.[۸۷] جدول فراوانیهای منظومه شمسی نشان میدهد که سرب با وجود شماره اتمی نسبتاً بالای خود، بیشتر از بیشتر عناصر دیگر با شماره اتمی بالای ۴۰ رایجتر است.[۸۴]
سرب اولیه—که شامل ایزوتوپهای سرب-۲۰۴، سرب-۲۰۶، سرب-۲۰۷ و سرب-۲۰۸ است—بیشتر بهعنوان نتیجهای از فرایندهای جذب نوترون تکراری در ستارگان ایجاد شده است. دو حالت اصلی جذب، s و فرایند تند گیراندازی نوترون هستند.[۸۸]
در فرایند s (که s به معنی «آهسته» است)، جذبها با فاصله سالها یا دههها از یکدیگر انجام میشود و این فرصت را به هستههای ناپایدار میدهد تا واپاشی بتا انجام دهند.[۸۹] یک هسته پایدار تالیم-۲۰۳ میتواند نوترونی جذب کرده و به تالیم-۲۰۴ تبدیل شود؛ این هسته سپس از طریق واپاشی بتا به سرب-۲۰۴ پایدار تبدیل میشود؛ با جذب نوترون دیگری، به سرب-۲۰۵ تبدیل میشود که نیمهعمر آن حدود ۱۷ میلیون سال است. جذبهای بعدی منجر به سرب-۲۰۶، سرب-۲۰۷ و سرب-۲۰۸ میشود. با جذب نوترون دیگری، سرب-۲۰۸ به سرب-۲۰۹ تبدیل میشود که بهسرعت به بیسموت-۲۰۹ تجزیه میشود. با جذب نوترون دیگری، بیسموت-۲۰۹ به بیسموت-۲۱۰ تبدیل میشود و این از طریق واپاشی بتا به پولونیوم-۲۱۰ تبدیل میشود که از طریق واپاشی آلفا به سرب-۲۰۶ تجزیه میشود؛ بنابراین چرخه به سرب-۲۰۶، سرب-۲۰۷، سرب-۲۰۸ و بیسموت-۲۰۹ خاتمه مییابد.[۹۰]
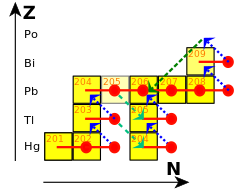
در فرایند r (که r به معنی «سریع» است)، جذبها سریعتر از آن که هستهها بتوانند تجزیه شوند، رخ میدهند.[۹۱] این در محیطهایی با چگالی بالای نوترون مانند یک ابرنواختر یا همپیوستگی دو ستاره نوترونی رخ میدهد. جریان نوترونهای involved ممکن است به میزان 1022 نوترون در هر سانتیمتر مربع در ثانیه باشد.[۹۲] فرایند r به اندازه فرایند s سرب تولید نمیکند.[۹۳] این فرایند تمایل دارد زمانی که هستههای غنی از نوترون به ۱۲۶ نوترون برسند متوقف شود.[۹۴] در این مرحله، نوترونها در پوستههای کامل در هسته اتمی قرار میگیرند و پذیرش نوترونهای بیشتر از نظر انرژی دشوار میشود.[۹۵] زمانی که جریان نوترون کاهش مییابد، این هستهها از طریق واپاشی بتا به ایزوتوپهای پایدار اسمیم، ایریدیم، پلاتین تبدیل میشوند.[۹۶]
در زمین
[ویرایش]سرب به عنوان یک طبقهبندی گلداشمیت در طبقهبندی گلداشمیت طبقهبندی میشود، به این معنی که معمولاً با گوگرد ترکیب میشود.[۹۷] این عنصر بهندرت بهصورت فلز بومی و شکل فلزی خود یافت میشود.[۹۸] بسیاری از کانیهای سرب نسبتاً سبک هستند و در طول تاریخ زمین، در پوسته (سیاره) باقیماندهاند بهجای آنکه به عمق بیشتر درون زمین فروروند. این امر توضیح میدهد که چرا فراوانی سرب در پوسته زمین به 14 ppm میرسد؛ سرب بیست و ششمین عنصر از نظر فراوانی در پوسته زمین است.[۹۹][ث]
مینرال اصلی سرب گالن (PbS) است که عمدتاً با سنگهای معدن روی یافت میشود.[۱۰۱] بیشتر کانیهای سرب دیگر بهنوعی با گالن مرتبط هستند؛ بولانژریت، Pb5Sb4S11، یک سولفید ترکیبی است که از گالن بهدست میآید؛ آنگلزیت، PbSO4، یک محصول اکسیداسیون گالن است؛ و سروزیت یا سنگ معدن سفید سرب، PbCO3، یک محصول تجزیه شیمیایی از گالن است. آرسنیک، قلع، آنتیموان، نقره، طلا، مس و بیسموت ناخالصیهای معمول در کانیهای سرب هستند.[۱۰۱]
منابع جهانی سرب بیش از دو میلیارد تن است. ذخایر قابلتوجهی در استرالیا، چین، ایرلند، مکزیک، پرو، پرتغال، روسیه و ایالات متحده آمریکا یافت میشود. ذخایر جهانی—منابعی که از نظر اقتصادی قابل استخراج هستند—در سال ۲۰۱۶ به ۸۸ میلیون تن رسید که از این مقدار، استرالیا ۳۵ میلیون، چین ۱۷ میلیون و روسیه ۶٫۴ میلیون تن سهم داشتند.[۱۰۲]
مقادیر معمولی پسزمینه سرب در جو از ۰٫۱ μg/m3 فراتر نمیروند؛ 100 mg/kg در خاک؛ 4 mg/kg در گیاهان، ۵ μg/L در آبهای شیرین و آب دریا.[۱۰۳]
واژهشناسی
[ویرایش]کلمه مدرن انگلیسی "lead" از ریشه ژرمنی است؛ این واژه از انگلیسی میانه leed و زبان انگلیسی باستان lēad آمده است (علامت ماکرون بالای "e" نشاندهنده صدای بلند آن حرف است).[۱۰۴] واژه انگلیسی باستان از زبان نیاژرمنی بازسازیشده *lauda- ('سرب') مشتق شده است.[۱۰۵] بر اساس نظریه زبانشناسی، این واژه در زبانهای ژرمنی مختلف با همان معنی به ارث رسیده است.[۱۰۵]
در مورد منشأ زبان نیاژرمنی *lauda- توافقنظر وجود ندارد. یکی از فرضیهها این است که این واژه از زبان نیاهندواروپایی *lAudh- ('سرب') مشتق شده است؛ که در آن، بزرگنویسی حرف صدا معادل ماکرون است.[۱۰۶] فرضیه دیگر این است که این واژه از زبان سلتی اولیه *ɸloud-io- ('سرب') وام گرفته شده است. این واژه با لاتین plumbum ارتباط دارد که نماد شیمیایی عنصر را به عنوان Pb بهدست داده است. واژه *ɸloud-io- بهعنوان منشأ زبان نیاژرمنی *bliwa- (که آن نیز به معنی 'سرب' است) شناخته میشود، از این واژه، واژه آلمانی Blei مشتق شده است.[۱۰۷]
نام عنصر شیمیایی به فعل همنام خود ارتباطی ندارد، که خود از *laidijan- ('رهبری کردن') در زبان نیاژرمنی آمده است.[۱۰۸]
تاریخ
[ویرایش]پیش از تاریخ و تاریخ اولیه
[ویرایش]گویهای سربی فلزی که به ۷۰۰۰–۶۵۰۰ پیش از میلاد تعلق دارند در آناتولی پیدا شدهاند و ممکن است نخستین نمونههای ذوب فلز را نشان دهند.[۱۰۹] در آن زمان، سرب کاربردهای زیادی نداشت (یا اصلاً نداشت) به دلیل نرمی و ظاهر کدر آن.[۱۰۹] دلیل اصلی گسترش تولید سرب ارتباط آن با نقره بود که از طریق سوزاندن گالن (معدن سرب معمول) بهدست میآمد.[۱۱۰] مصر باستانیان اولین کسانی بودند که از مواد معدنی سرب در لوازم آرایشی استفاده کردند، کاربردی که به یونان باستان و مناطق دیگر گسترش یافت؛[۱۱۱] مصریان از سرب برای تهیه غرقکنندهها در تور ماهیگیری، لاک (قالبدهی)، شیشه، میناکاری و زینتآلات استفاده میکردند.[۱۱۰] تمدنهای مختلف هلال حاصلخیز از سرب به عنوان ماده نوشتاری، سکه،[۱۱۲] و مواد ساختمانی استفاده میکردند.[۱۱۰] چینیها باستان از سرب به عنوان محرک (دارو),[۱۱۰] به عنوان پول رایج، [۱۱۳] به عنوان پیشگیری از بارداری، [۱۱۴] و در چوب غذاخوری استفاده میکردند.[۱۱۵] تمدن دره سند و آمریکای میانه نیز از آن برای ساخت تعویذ استفاده میکردند؛[۱۱۰] و مردم شرق و جنوب آفریقا از سرب در کشش مفتول استفاده میکردند.[۱۱۶]
دوران کلاسیک
[ویرایش]از آنجا که نقره بهطور گستردهای به عنوان یک ماده تزئینی و وسیله مبادله مورد استفاده قرار میگرفت، ذخایر سرب از ۳۰۰۰ پیش از میلاد در آناتولی استخراج میشدند؛ سپس ذخایر سرب در جزایر اژه و لوریوم توسعه یافت.[۱۱۷] این سه منطقه بهطور مشترک تولید سرب استخراج شده را تا حدود ۱۲۰۰ پیش از میلاد سلطه داشتند.[۱۱۸] از حدود ۲۰۰۰ پیش از میلاد، فنیقیها ذخایر را در شبهجزیره ایبری استخراج میکردند؛ تا سال ۱۶۰۰ پیش از میلاد، استخراج سرب در قبرس، یونان، و ساردینیا وجود داشت.[۱۱۹]

گسترش سرزمینی جمهوری روم در اروپا و سراسر مدیترانه و توسعه استخراج معادن باعث شد تا روم به بزرگترین تولیدکننده سرب در دوران اروپای دوران باستان تبدیل شود، با برآورد تولید سالانه به ۸۰٬۰۰۰ تن. مانند پیشینیانشان، رومیها عمدتاً سرب را به عنوان محصول جانبی از ذوب نقره بهدست میآوردند.[۱۲۱][۱۲۲] استخراج سرب در اروپای مرکزی، بریتانیا (استان روم), بالکان، یونان، آناتولی، هیسپانیا انجام میشد و این مناطق ۴۰٪ از تولید جهانی را به خود اختصاص میدادند.[۱۲۱]

تختههای سربی بهطور معمول به عنوان مادهای برای نوشتن استفاده میشدند.[۱۲۳] تابوتهای سربی که در قالبهای شنی صاف ریخته میشدند و با موتیفهای قابل تعویض متناسب با ایمان متوفی ساخته میشدند، در یهودیه (استان رومی) استفاده میشدند.[۱۲۴] سرب برای ساخت گلولههای تلسکوپی از قرن پنجم پیش از میلاد مورد استفاده قرار گرفت. در دوران روم، گلولههای سربی بهطور گسترده استفاده میشدند و مؤثر در فاصله بین ۱۰۰ تا ۱۵۰ متر بودند. سنگاندازهای بالئاریک که به عنوان مزدور در ارتشهای کارتاژی و رومی استفاده میشدند، به دلیل فاصله شلیک و دقت خود معروف بودند.[۱۲۵]

سرب در ساخت لولههای آب در امپراتوری روم استفاده میشد؛ واژه لاتین این فلز، plumbum، منبع واژه انگلیسی «لولهکشی» است. سهولت کار با آن، نقطه ذوب پایین که امکان ساخت جوشهای کاملاً ضدآب را فراهم میکرد، و مقاومت آن در برابر خوردگی باعث شد تا در سایر کاربردها مانند داروسازی، سقفسازی، سکهسازی و جنگاوری نیز بهطور گستردهای استفاده شود[۱۲۶][۱۲۷][۱۲۸] نویسندگان آن زمان، مانند کاتوی بزرگ، کولوملا و پلینیوس، استفاده از ظروف سربی (و سربپوش) را برای تهیه شیره انگور افزوده شده به شراب و غذا توصیه میکردند. سرب طعمی مطلوب ایجاد میکرد زیرا «شکر سرب» (سرب(II) استات) ایجاد میکرد، در حالی که ظروف مسی طعمی تلخ به دلیل تشکیل سبز مسی داشتند[۱۲۹].
این فلز بدون شک پر استفادهترین ماده در دوران باستان کلاسیک بود و مناسب است که به این دوره به عنوان عصر سرب رومی اشاره کنیم. سرب برای رومیها همان نقشی را داشت که پلاستیک برای ما دارد.
Heinz Eschnauer and Markus Stoeppler
"Wine—An enological specimen bank", 1992[۱۳۰]
نویسنده رومی ویترویوس خطرات سلامتی سرب را گزارش کرده است[۱۳۱] و نویسندگان مدرن اشاره کردهاند که مسمومیت با سرب ممکن است نقش عمدهای در سقوط امپراتوری روم غربی داشته باشد[۱۳۲][۱۳۳]. برخی محققان این ادعاها را مورد انتقاد قرار دادهاند و یادآور شدهاند که تمامی درد شکمی به دلیل مسمومیت با سرب نیست[۱۳۴][۱۳۵]. تحقیقات باستانشناسی نشان میدهند که لولههای رومی سطح سرب را در آب شیر افزایش دادند، اما این اثر «بعید است که واقعاً مضر بوده باشد»[۱۳۶][۱۳۷]. زمانی که مسمومیت با سرب رخ میداد، قربانیان را «ساتورنینی» مینامیدند، تاریک و بدبین، به یاد پدر وحشتناک خدایان، ساترن. به این ترتیب، سرب به عنوان پدر تمام فلزات شناخته میشد[۱۳۸]. وضعیت اجتماعی آن در روم پایین بود، زیرا به راحتی در دسترس و ارزان بود[۱۳۹][۱۴۰].
اشتباهات در تشخیص سرب و قلع و آنتیموان
[ویرایش]از عصر برنز، فلزگران و مهندسان تفاوت بین قلع کمیاب و ارزشمند، که برای آلیاژ کردن با مس به منظور تولید برنز مقاوم و ضد خوردگی ضروری بود، و سرب "ارزان و شاد" را درک کردهاند. با این حال، نامگذاری در برخی زبانها مشابه است. رومیها به سرب plumbum nigrum ("سرب سیاه") و به قلع plumbum candidum ("سرب روشن") میگفتند. ارتباط سرب و قلع را میتوان در دیگر زبانها نیز مشاهده کرد: واژه olovo در زبان چکی به معنای "سرب" است، اما در زبان روسی، همخانواده آن олово (olovo) به معنی "قلع" است[۱۴۱]. به علاوه، سرب ارتباط نزدیکی با آنتیموان داشت: هر دو عنصر معمولاً به صورت سولفید (گالن و استیبین) وجود دارند و اغلب با هم یافت میشوند. پلینیوس اشتباه نوشته بود که استیبنیت با حرارت دادن سرب تولید میکند، به جای آنتیموان[۱۴۲]. در کشورهایی مانند ترکیه و هند، نام اصیل فارسی surma به سولفید آنتیموان یا سولفید سرب اشاره دارد[۱۴۳] و در برخی زبانها، مانند روسی، نام آنتیموان را به خود گرفته است (сурьма)[۱۴۴].
قرون وسطی و رنسانس
[ویرایش]
استخراج سرب در اروپای غربی پس از سقوط امپراتوری روم غربی کاهش یافت، با اندلس (اسلامی) که تنها منطقهای بود که تولید قابل توجهی داشت[۱۴۶][۱۴۷]. بزرگترین تولید سرب در جنوب آسیا و شرق آسیا، به ویژه چین و هند، صورت گرفت که در آنجا استخراج سرب به سرعت رشد کرد[۱۴۷].
در اروپا، تولید سرب از قرن یازدهم و دوازدهم شروع به افزایش کرد، زمانی که دوباره از آن برای سقفسازی و لولهکشی استفاده شد. از قرن سیزدهم، سرب برای تولید شیشه رنگی قرون وسطی به کار میرفت[۱۴۸]. در سنتهای کیمیا و کیمیاگری و شیمی در اسلام قرون وسطی، سرب (نماد ♄ در سنت اروپایی)[۱۴۹] به عنوان یک فلز پایه ناخالص در نظر گرفته میشد که با جدا کردن، تصفیه و تعادل essences آن، میتوان آن را به طلا خالص و ناب تبدیل کرد[۱۵۰]. در این دوره، استفاده از سرب بهطور فزایندهای برای آلودهسازی شراب رایج شد. استفاده از چنین شرابی در مراسم مسیحی توسط مهر و موم پاپ در ۱۴۹۸ ممنوع شد، اما همچنان مصرف میشد و منجر به مسمومیتهای گسترده تا اواخر قرن هجدهم شد[۱۴۶][۱۵۱]. سرب ماده اصلی در قسمتهای چاپ فشاری بود و گرد و غبار سرب بهطور معمول توسط کارگران چاپ استنشاق میشد که منجر به مسمومیت با سرب میشد[۱۵۲]. سرب همچنین ماده اصلی ساخت گلولهها برای سلاحهای آتشین شد: ارزان بود، آسیب کمتری به لولههای تفنگ آهنی وارد میکرد، چگالی بالاتری داشت (که اجازه میداد سرعت بهتری حفظ شود) و نقطه ذوب پایین آن تولید گلولهها را آسانتر میکرد زیرا میتوانستند با آتش چوبی ساخته شوند[۱۵۳]. سرب، به صورت سفیداب، بهطور گستردهای در لوازم آرایشی توسط اشرافزادگان اروپای غربی استفاده میشد، زیرا صورتهای سفید به عنوان نشانهای از تواضع محسوب میشدند[۱۵۴][۱۵۵]. این روش بعدها به پرچمهای سفید و خط چشمها گسترش یافت و تنها با انقلاب فرانسه در اواخر قرن هجدهم از بین رفت. مد مشابهی در قرن هجدهم در ژاپن با ظهور گیشاها پدید آمد، که این سنت تا اوایل قرن بیستم ادامه یافت. صورتهای سفید زنان «نماد فضیلت زنانگی آنها به عنوان زنان ژاپنی» شدند[۱۵۶] و سرب معمولاً در سفیدکنندهها استفاده میشد[۱۵۷].
خارج از اروپا و آسیا
[ویرایش]در جهان جدید، تولید سرب بلافاصله پس از ورود استعمارگران اروپایی ثبت شد. اولین رکورد به سال ۱۶۲۱ در مستعمره ویرجینیا انگلیس بازمیگردد که چهارده سال پس از تأسیس آن بود.[۱۵۸] در استرالیا، اولین معدن افتتاح شده توسط استعمارگران در سال ۱۸۴۱ معدن سرب بود.[۱۵۹] در آفریقا، استخراج و ذوب سرب در Benue Trough[۱۶۰] و حوضه پایین حوضه کنگو شناخته شده بود، جایی که سرب برای تجارت با اروپاییها و بهعنوان ارز از قرن ۱۷ مورد استفاده قرار میگرفت،[۱۶۱] مدتها پیش از تقسیم آفریقا.
انقلاب صنعتی
[ویرایش]
در نیمه دوم قرن ۱۸، بریتانیا و بعدها کشورهای قارهای اروپا و ایالات متحده شاهد انقلاب صنعتی بودند. این اولین باری بود که نرخ تولید سرب از دوران روم فراتر رفت.[۱۶۲] بریتانیا تولیدکننده پیشرو بود، اما تا میانه قرن ۱۹ با کاهش منابع معادن خود و توسعه استخراج سرب در آلمان، اسپانیا و ایالات متحده این جایگاه را از دست داد.[۱۶۳] تا سال ۱۹۰۰، ایالات متحده بزرگترین تولیدکننده جهانی سرب شد و کشورهای غیراروپایی نظیر کانادا، مکزیک و استرالیا شروع به تولید چشمگیر کردند؛ تولید خارج از اروپا از تولید در اروپا بیشتر شد.[۱۶۴] بخش زیادی از تقاضا برای سرب از لولهکشی و نقاشیها بود—رنگ سرب بهطور منظم استفاده میشد.[۱۶۵] در این زمان، افراد بیشتری در طبقه کارگر در معرض فلز قرار گرفتند و موارد مسمومیت با سرب افزایش یافت. این امر منجر به تحقیقاتی در مورد اثرات مصرف سرب شد. ثابت شد که مسمومیت با سرب در فرم بخار آن خطرناکتر از حالت فلز جامد است. مسمومیت با سرب و نقرس به هم مرتبط بودند؛ پزشک بریتانیایی آلفرد بارینگ گارود اشاره کرد که یکسوم از بیماران مبتلا به نقرس او لولهکشها و نقاشان بودند. اثرات بلع مزمن سرب، از جمله اختلالات ذهنی، در قرن ۱۹ مطالعه شد. اولین قوانین برای کاهش مسمومیت با سرب در کارخانهها در دهههای ۱۸۷۰ و ۱۸۸۰ در بریتانیا وضع شد.[۱۶۵]
دوران معاصر
[ویرایش]
شواهد بیشتری از تهدیدی که سرب برای انسانها ایجاد میکرد در اواخر قرن ۱۹ و اوایل قرن ۲۰ کشف شد. مکانیزمهای آسیب بهتر درک شدند، کوری ناشی از سرب ثبت شد و این عنصر از استفاده عمومی در ایالات متحده و اروپا خارج شد. بریتانیا با معرفی بازرسیهای اجباری کارخانهها در سال ۱۸۷۸ و انتصاب اولین بازرس پزشکی کارخانهها در سال ۱۸۹۸؛ در نتیجه، کاهش ۲۵ برابری در موارد مسمومیت با سرب از ۱۹۰۰ تا ۱۹۴۴ گزارش شد.[۱۶۶] بیشتر کشورهای اروپایی تا سال ۱۹۳۰ رنگ سرب را برای استفاده در داخل ساختمانها ممنوع کردند.[۱۶۷]
آخرین قرار گرفتن انسانها در معرض سرب به افزودن تترااتیلسرب به بنزین بهعنوان ضدکوبنده مربوط میشود، روشی که در ایالات متحده در سال ۱۹۲۱ آغاز شد. این استفاده در ایالات متحده و اتحادیه اروپا تا سال ۲۰۰۰ از دور خارج شد.[۱۶۵]
در دهه ۱۹۷۰، ایالات متحده و کشورهای غربی اروپایی قوانین جدیدی برای کاهش آلودگی هوای ناشی از سرب وضع کردند.[۱۶۸][۱۶۹] تأثیر این اقدام بسیار چشمگیر بود: در حالی که مطالعهای که توسط مرکز کنترل و پیشگیری از بیماری (ایالات متحده) در ایالات متحده در سالهای ۱۹۷۶–۱۹۸۰ انجام شد نشان داد که ۷۷٫۸٪ از جمعیت دارای سطح بالای lead blood level بودند، در سالهای ۱۹۹۱–۱۹۹۴، مطالعهای توسط همان مؤسسه نشان داد که سهم افرادی که دارای سطوح بالای سرب بودند به ۲٫۲٪ کاهش یافت.[۱۷۰] محصول اصلی ساختهشده از سرب تا پایان قرن ۲۰ باتری اسید-سرب بود.[۱۷۱]
از ۱۹۶۰ تا ۱۹۹۰، تولید سرب در بلوک غرب حدود ۳۱٪ افزایش یافت.[۱۷۲] سهم تولید جهانی سرب توسط بلوک شرق از ۱۰٪ به ۳۰٪ افزایش یافت، از ۱۹۵۰ تا ۱۹۹۰، با اتحاد جماهیر شوروی که در اواسط دهه ۱۹۷۰ و دهه ۱۹۸۰ بزرگترین تولیدکننده بود و چین که در اواخر قرن ۲۰ تولید سرب را بهطور عمده آغاز کرد.[۱۷۳] برخلاف کشورهای کمونیستی اروپایی، چین تا میانه قرن ۲۰ عمدتاً غیرصنعتی بود؛ در سال ۲۰۰۴، چین استرالیا را به عنوان بزرگترین تولیدکننده سرب پشت سر گذاشت.[۱۷۴] مانند آنچه در دوران صنعتی شدن اروپا رخ داد، سرب تأثیر منفی بر سلامت در چین داشته است.[۱۷۵]
تولید
[ویرایش]
تا سال ۲۰۱۴، تولید سرب در سطح جهانی به دلیل استفاده از آن در باتریهای اسید-سرب در حال افزایش بود.[۱۷۶] تولید سرب به دو دسته اصلی تقسیم میشود: اولیه از سنگ معدن و ثانویه از ضایعات. در سال ۲۰۱۴، ۴٫۵۸ میلیون تن متریک از تولید اولیه و ۵٫۶۴ میلیون تن از تولید ثانویه به دست آمد. سه تولیدکننده برتر کنسانتره معدن سرب در آن سال چین، استرالیا و ایالات متحده بودند.[۱۰۲] سه تولیدکننده برتر سرب تصفیه شده چین، ایالات متحده و هند بودند.[۱۷۷] طبق گزارش Metal Stocks in Society در سال ۲۰۱۰، مقدار کل سرب در حال استفاده، ذخیرهشده، دور ریختهشده یا پخششده به محیط زیست، بهطور جهانی، ۸ کیلوگرم به ازای هر نفر است. بیشتر این مقدار در کشورهای پیشرفته (۲۰–۱۵۰ کیلوگرم به ازای هر نفر) نسبت به کشورهای کمتر توسعهیافته (۱–۴ کیلوگرم به ازای هر نفر) است.[۱۷۸]
فرآیندهای تولید اولیه و ثانویه سرب مشابه هستند. برخی از کارخانههای تولید اولیه اکنون عملیات خود را با استفاده از ضایعات سرب تکمیل میکنند و این روند احتمالاً در آینده افزایش خواهد یافت. با استفاده از تکنیکهای مناسب، سرب به دست آمده از فرآیندهای ثانویه از سرب به دست آمده از فرآیندهای اولیه قابل تشخیص نیست. ضایعات سرب از صنعت ساختمان معمولاً نسبتاً تمیز است و بدون نیاز به ذوب مجدد، دوباره ذوب میشود، هرچند که گاهی نیاز به تصفیه دارد. تولید سرب ثانویه بنابراین ارزانتر از تولید اولیه است، اغلب تا ۵۰٪ یا بیشتر از نظر نیاز به انرژی.[۱۷۹]
تولید اولیه
[ویرایش]بیشتر سنگهای معدنی سرب درصد کمی از سرب دارند (سنگهای معدنی غنی معمولاً ۳–۸٪ محتوی سرب دارند) که باید برای استخراج تمرکز داده شوند.[۱۸۰] در مرحله اولیه پردازش، سنگها معمولاً خرد شده، از طریق جداسازی با وسط غلیظ، سنگزنی، شناورسازی کف، خشک کردن میشوند. کنسانتره حاصل که معمولاً حاوی ۳۰–۸۰٪ سرب به ازای جرم (معمولاً ۵۰–۶۰٪) است، سپس به فلز سرب (ناخالص) تبدیل میشود.
دو روش اصلی برای انجام این کار وجود دارد: یک فرایند دو مرحلهای که شامل کلسینهکردن و سپس استخراج در کوره بلند است که در ظروف جداگانه انجام میشود؛ یا یک فرایند مستقیم که استخراج کنسانتره در یک ظرف واحد انجام میشود. روش دوم بهطور معمول رایجتر است، هرچند روش اول هنوز هم مهم است.[۱۸۱]
| Country | Output (thousand tons) |
|---|---|
| 2,400 | |
| 500 | |
| 335 | |
| 310 | |
| 250 | |
| 225 | |
| 135 | |
| 80 | |
| 76 | |
| 75 | |
| 41 | |
| 41 | |
| 40 | |
| 40 | |
| 35 | |
| 33 | |
| 33 | |
| Other countries | 170 |
فرایند دو مرحلهای
[ویرایش]ابتدا کنسانتره سولفیدی در هوای آزاد به منظور اکسید کردن سولفید سرب تشویه (متالورژی) میشود:[۱۸۲]
- 2 PbS(s) + 3 O2(g) → 2 PbO(s) + 2 SO2(g)↑
چون کنسانتره اولیه بهطور کامل خالص نبوده است، فرایند تشویه نه تنها اکسید سرب (II) مورد نظر، بلکه مخلوطی از اکسیدها، سولفاتها و سیلیکاتهای سرب و سایر فلزات موجود در سنگ معدن را تولید میکند.[۱۸۳] این اکسید سرب ناخالص در یک کوره بلند با سوخت کک به فلز (ناخالص) تبدیل میشود:[۱۸۴]
- 2 PbO(s) + C(s) → 2 Pb(s) + CO2(g)↑
آلودگیها عمدتاً شامل آرسنیک، آنتیموان، بیسموت، روی، مس، نقره و طلا هستند. معمولاً این آلودگیها در یک سری فرآیندهای پیرومتالورژی حذف میشوند. مذاب در یک کوره بازتابشی با هوا، بخار و سولفور درمان میشود که آلودگیها را اکسید کرده، به جز نقره، طلا و بیسموت. آلودگیهای اکسید شده به سطح مذاب شناور شده و از آن جدا میشوند.[۱۸۵][۱۸۶] نقره و طلا بهطور اقتصادی با استفاده از فرایند Parkes process از فلز سرب جدا میشوند. در این فرایند، روی به سرب افزوده میشود. روی که در سرب حل نمیشود، نقره و طلا را حل میکند. محلول روی از سرب جدا شده و نقره و طلا بازیابی میشوند.[۱۸۶][۱۸۷] سرب فاقد نقره با استفاده از فرایند Betterton–Kroll process از بیسموت پاک میشود، با درمان آن با فلزات کلسیم و منیزیم. سرب بیسموتدار که جدا میشود میتواند از سطح مذاب گرفته شود.[۱۸۶]
بهجای فرآیندهای پیرومتالورژیکی، سرب بسیار خالص میتواند با استفاده از فرایند الکترولیتی Betts process بهدست آید. آندها از سرب ناخالص و کاتدها از سرب خالص در یک الکترولیت فلوروسیلیکات سرب (PbSiF6) قرار میگیرند. وقتی پتانسیل الکتریکی اعمال میشود، سرب ناخالص در آند حل شده و به کاتد رسوب میکند و بیشتر آلودگیها در محلول باقی میمانند.[۱۸۶][۱۸۸] این فرایند هزینه بالایی دارد و بنابراین بیشتر برای تصفیه شمشهایی با درصد بالای آلودگیها استفاده میشود.[۱۸۹]
فرایند مستقیم
[ویرایش]در این فرایند، شمش سرب و سرباره مستقیماً از کنسانترههای سرب بهدست میآید. کنسانتره سولفید سرب در کوره ذوب شده و اکسید میشود و منوکسید سرب را تشکیل میدهد. کربن (به صورت کک یا گاز زغالسنگ[چ]) به بار مذاب افزوده میشود همراه با فلاکس. منوکسید سرب در نتیجه این عمل به سرب فلزی کاهش مییابد، در حالی که سربارهای غنی از منوکسید سرب در اطراف آن تشکیل میشود.[۱۸۱]
اگر ورودی غنی از سرب باشد، تا ۸۰٪ از سرب اصلی به صورت شمش بهدست میآید؛ ۲۰٪ باقیمانده به صورت سربارهای غنی از منوکسید سرب تشکیل میشود. برای خوراک با درجه پایین، تمام سرب میتواند به سربارهای غنی از منوکسید سرب اکسید شود.[۱۸۱] سرب فلزی بیشتر از سربارههای غنی از سرب (۲۵–۴۰٪) از طریق احتراق سوخت غوطهور یا تزریق، کاهش کمکی با کوره الکتریکی، یا ترکیبی از هر دو بهدست میآید.[۱۸۱]
گزینههای جایگزین
[ویرایش]تحقیقات برای فرایند استخراج سرب پاکتر و با مصرف انرژی کمتر ادامه دارد؛ یکی از معایب عمده این است که یا مقدار زیادی سرب بهعنوان ضایعات از دست میرود، یا این گزینهها منجر به محتوای بالای سولفور در فلز سرب حاصل میشوند. استخراج به روش هیدرومتالورژی، که در آن آند (شیمی)های سرب ناخالص در یک الکترولیت غوطهور میشوند و سرب خالص بهصورت الکترو وینینگ روی کاتد رسوب میکند، یک تکنیک است که ممکن است پتانسیل داشته باشد، اما در حال حاضر از نظر اقتصادی مقرون به صرفه نیست، مگر در مواردی که هزینه برق بسیار پایین باشد.[۱۹۰]
ثانویه
[ویرایش]فرایند ذوب، که بخش ضروری تولید اولیه است، در تولید ثانویه اغلب نادیده گرفته میشود. این فرایند تنها زمانی انجام میشود که سرب فلزی دچار اکسیداسیون قابل توجهی شده باشد.[۱۷۹] فرایند مشابه با تولید اولیه در کوره بلند یا کوره دوار است، با تفاوت اصلی این که بازدههای آن بیشتر متغیر است: کورههای بلند سرب سخت (با ۱۰٪ آنتیموان) تولید میکنند، در حالی که کورههای بازتابی و کورههای دوار سرب نیمهسخت (با ۳–۴٪ آنتیموان) تولید میکنند.[۱۹۱]
فرایند ISASMELT یک روش ذوب جدیدتر است که میتواند بهعنوان یک گسترش برای تولید اولیه عمل کند؛ پاسته باتری از باتریهای سرب-اسید فرسوده (که شامل سولفات سرب و اکسیدهای سرب است) ابتدا سولفات آن با درمان با قلیایی از بین میرود، سپس در کورهای که با زغالسنگ سوخته میشود و در حضور اکسیژن قرار دارد، درمان میشود، که سرب ناخالصی تولید میکند و آنتیموان رایجترین آلودگی است.[۱۹۲] تصفیه سرب ثانویه مشابه با تصفیه سرب اولیه است؛ برخی از فرآیندهای تصفیه ممکن است بسته به ماده بازیافتی و احتمال آلودگی آن نادیده گرفته شوند.[۱۹۲]
از منابع سرب برای بازیافت، باتریهای سرب-اسید مهمترین هستند؛ لولههای سرب، ورق و پوششهای کابل نیز از اهمیت بالایی برخوردارند.[۱۷۹]
کاربردها
[ویرایش]
برخلاف باور عمومی، مغز مدادهای چوبی هرگز از سرب ساخته نشده است. زمانی که مداد بهعنوان ابزاری برای نوشتن با گرافیت پیچیدهشده ساخته شد، نوع خاصی از گرافیت که استفاده میشد به نام گرافیت (بهطور تحتاللفظی مدل سرب) نامگذاری شد.[۱۹۴]
فرم عنصری
[ویرایش]فلز سرب دارای چندین ویژگی مکانیکی مفید است که شامل چگالی بالا، نقطه ذوب پایین، قابلیت کشسانی و عدم واکنش نسبی است. بسیاری از فلزات در برخی از این جنبهها بر سرب برتری دارند، اما بهطور کلی کمتر رایج بوده و استخراج آنها از سنگهای معدنی دشوارتر است. سمیت سرب باعث شده که از برخی کاربردهای آن کاسته شود.[۱۹۵]
سرب از زمان اختراع گلولهها در قرون وسطی برای ساخت گلولهها استفاده شده است. این فلز ارزان است؛ نقطه ذوب پایین آن به این معناست که گلولههای اسلحههای کوچک و گلولههای تفنگ ساچمهای میتوانند با حداقل تجهیزات فنی ریختهگری شوند؛ همچنین چگالی آن بیشتر از سایر فلزات رایج است که این امر باعث میشود سرعت گلوله بهتر حفظ شود. این فلز همچنان ماده اصلی برای گلولهها است که با فلزات دیگر بهعنوان سختکنندهها آلیاژ میشود.[۱۵۳] نگرانیهایی در مورد آسیبهایی که گلولههای سربی در شکار میتوانند به محیط زیست وارد کنند، مطرح شده است.[ح] تفنگ ساچمهزنی کارتریجهای تفنگ ساچمهای استفادهشده برای شکار پرندگان آبزی باید امروز در ایالات متحده آمریکا،[۱۹۷] کانادا،[۱۹۸] و در اروپا.[۱۹۹]
چگالی بالا و مقاومت به خوردگی سرب در بسیاری از کاربردهای مرتبط بهرهبرداری شده است. از آن بهعنوان ballast در کیل قایقهای بادبانی استفاده میشود؛ چگالی آن بهاین معناست که میتواند حجم کمی اشغال کرده و مقاومت در برابر آب را حداقل کند، بنابراین اثر کج شدن باد روی بادبانها را متعادل میکند.[۲۰۰] از آن در غواصی اسکوبا برای سیستم وزندهی غواصی استفاده میشود تا بر شناوری غواص غلبه کند.[۲۰۱] در سال ۱۹۹۳، پایه برج کج پیزا با ۶۰۰ تن سرب تثبیت شد.[۲۰۲] بهدلیل مقاومت در برابر خوردگی، سرب بهعنوان غلاف محافظ برای کابلهای زیرآبی استفاده میشود.[۲۰۳]

سرب کاربردهای زیادی در صنعت ساختمان دارد؛ ورقهای سرب بهعنوان فلزات معماری در مواد سقفسازی، پوششدهی، آببندی، آبریزها و اتصالات آبریزها، و دیوارهای بلند سقف استفاده میشوند.[۲۰۴][۲۰۵] سرب هنوز در ساخت تندیسها و مجسمهها استفاده میشود،[خ] از جمله برای قابها.[۲۰۷] در گذشته، گاهی از آن برای متعادلسازی چرخهای خودرو استفاده میشد؛ به دلایل زیستمحیطی، این استفاده در حال کنار گذاشته شدن است و به مواد دیگری ترجیح داده میشود.[۱۰۲]
سرب به آلیاژهای مس، مانند برنج (آلیاژ) و برنز اضافه میشود تا قابلیت ماشینکاری آنها را بهبود بخشد و خواص روانکاری آن را افزایش دهد؛ زیرا سرب تقریباً در مس حل نمیشود، سرب در نواقص موجود در آلیاژ، مانند مرز دانه، بهصورت گلولههای جامد تشکیل میشود. در غلظتهای پایین، بهعلاوه نقش روانکنندهای که ایفا میکند، این گلولهها از تشکیل براده هنگام کار روی آلیاژ جلوگیری کرده و به این ترتیب قابلیت ماشینکاری را بهبود میبخشند. آلیاژهای مس با غلظتهای بالاتر سرب در یاتاقانها استفاده میشوند. سرب روانکاری فراهم میکند و مس از حمایت بار برخوردار است.[۲۰۸]
چگالی بالا، عدد اتمی، و قابلیت شکلدهی سرب، اساس استفاده از آن بهعنوان یک مانع برای جذب صدا، ارتعاش و تابش را تشکیل میدهد.[۲۰۹] سرب هیچ فرکانس رزونانس طبیعی ندارد؛[۲۰۹] به همین دلیل، ورقهای سربی بهعنوان لایهای برای کاهش صدا در دیوارها، کفها و سقفهای استودیوهای صدا استفاده میشود.[۲۱۰] لولههای ارگان معمولاً از یک آلیاژ سرب ساخته میشوند که با مقادیر مختلفی از قلع ترکیب میشود تا صدای هر لوله کنترل شود.[۲۱۱][۲۱۲] سرب بهعنوان یک ماده محافظ سربی در برابر پرتو یونیزان در علوم هستهای و در اتاقهای اشعه ایکس بهطور گستردهای استفاده میشود[۲۱۳] به دلیل چگالی و ضریب جذب بالای آن.[۲۱۴] سرب مذاب بهعنوان خنککننده در رآکتور سریع خنکشده سرب استفاده شده است.[۲۱۵]
باتریها
[ویرایش]بزرگترین استفاده از سرب در اوایل قرن بیستویکم در باتریهای اسید-سرب است. سرب در باتریها تماس مستقیم با انسان ندارد، بنابراین نگرانیهای کمتری در مورد سمیت آن وجود دارد.[د] افرادی که در تولید باتریهای سربی یا کارگاههای بازیافت آنها کار میکنند ممکن است در معرض گرد و غبار سرب قرار گیرند و آن را استنشاق کنند.[۲۱۷] واکنشهای موجود در باتری میان سرب، دیاکسید سرب و اسید سولفوریک منبع قابل اعتمادی از ولتاژ فراهم میآورد.[ذ] ابرخازنهایی که باتریهای اسید-سرب را دربردارند، در مقیاس کیلووات و مگاوات در استرالیا، ژاپن و ایالات متحده در کاربردهایی مانند تنظیم فرکانس، تسویه و تغییر خورشیدی، تسویه باد و دیگر کاربردها نصب شدهاند.[۲۱۹] این باتریها چگالی انرژی و کارایی شارژ-دشارژ کمتری نسبت به باتریهای یونلیتیم دارند، اما بهطور قابل توجهی ارزانتر هستند.[۲۲۰]
پوشش برای کابلها
[ویرایش]سرب در کابلهای برق با ولتاژ بالا بهعنوان ماده پوستهای برای جلوگیری از نفوذ آب به عایق استفاده میشود؛ این کاربرد در حال کاهش است زیرا استفاده از سرب در حال کنار گذاشته شدن است.[۲۲۱] استفاده از سرب در لحیم برای الکترونیک نیز در برخی کشورها در حال کاهش است تا میزان خطر زیستمحیطی زبالهها کاهش یابد.[۲۲۲] سرب یکی از سه فلزی است که در آزمایش اودی برای مواد موزهها استفاده میشود، که کمک میکند تا اسیدهای آلی، آلدهیدها و گازهای اسیدی شناسایی شوند.[۲۲۳][۲۲۴]
ترکیبات
[ویرایش]

علاوه بر اینکه باتریهای اسید-سرب اصلیترین کاربرد سرب فلزی هستند، این باتریها همچنین اصلیترین مصرفکننده ترکیبات سربی نیز میباشند. واکنش ذخیره/انتشار انرژی در این دستگاهها شامل سرب(II) سولفات و دیاکسید سرب است:
- Pb(s) + PbO
2(s) + 2H
2SO
4(aq) → 2PbSO
4(s) + 2H
2O(l)
سایر کاربردهای ترکیبات سربی بسیار تخصصی هستند و اغلب در حال کاهش میباشند. عوامل رنگدهنده مبتنی بر سرب در لعابها و شیشهها استفاده میشوند، بهویژه برای سایههای قرمز و زرد.[۲۲۵] در حالی که رنگهای سربی در اروپا و آمریکای شمالی کنار گذاشته شدهاند، هنوز در کشورهای کمتر توسعهیافتهای مانند چین،[۲۲۶] هند،[۲۲۷] یا اندونزی استفاده میشوند.[۲۲۸] سرب تترااستات و دیاکسید سرب بهعنوان عوامل اکسیدکننده در شیمی آلی استفاده میشوند. سرب بهطور مکرر در پوشش پلیوینیل کلراید کابلهای الکتریکی استفاده میشود.[۲۲۹][۲۳۰] همچنین میتواند برای درمان فتیلههای شمع استفاده شود تا سوزاندن یکنواخت و طولانیتری فراهم آورد. به دلیل سمیت آن، تولیدکنندگان در اروپا و آمریکای شمالی از جایگزینهایی مانند روی استفاده میکنند.[۲۳۱][۲۳۲] شیشه کریستال از ۱۲–۲۸٪ اکسید سرب (II) تشکیل شده است که ویژگیهای اپتیکی آن را تغییر میدهد و انتقال تابش یونیزهکننده را کاهش میدهد،[۲۳۳] ویژگیای که در تلویزیونها و مانیتورهای قدیمی با لامپ پرتوی کاتدی استفاده میشد. نیمهرساناهای مبتنی بر سرب مانند تلورید سرب و سلنید سرب در سلولهای فتوولتائیک و آشکارسازهای فروسرخ استفاده میشوند.[۲۳۴]
اثرات بیولوژیکی
[ویرایش]| سرب | |
|---|---|
| خطرات | |
| GHS pictograms |  
|
| سیستم هماهنگ جهانی طبقهبندی و برچسبگذاری مواد شیمیایی | Danger |
| GHS hazard statements | H302, H332, H351, <span class="abbr" style="color: blue; border-bottom: 1px dotted blue" title="Error in hazard statements">H360Df, H373, H410 |
| GHS precautionary statements | P201, P261, P273, P304, P340, P312, P308, P313, <span class="abbr" style="color: blue; border-bottom: 1px dotted blue" title="Error in hazard statements">P391[۲۳۵] |
| لوزی آتش |  |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| Infobox references | |
|
| |
سرب هیچ نقش بیولوژیکی تأیید شدهای ندارد و هیچ سطح ایمنی تأیید شدهای برای قرارگیری در معرض سرب وجود ندارد.[۲۳۶] مطالعهای که در سال ۲۰۰۹ توسط کانادا و آمریکا انجام شد، به این نتیجه رسید که حتی در سطوحی که به نظر میرسد خطر کمی دارند یا هیچ خطری ندارند، سرب میتواند «نتایج منفی در سلامت روانی» ایجاد کند.[۲۳۷] شیوع آن در بدن انسان—بهطور متوسط ۱۲۰ میلیگرم در بزرگسالان[ر]—فقط از روی (۲۵۰۰ میلیگرم) و آهن (۴۰۰۰ میلیگرم) بیشتر است و تنها فلزات سنگین میباشند.[۲۳۹] نمک (شیمی)های سرب بهطور بسیار مؤثری توسط بدن جذب میشوند.[۲۴۰] مقدار کمی از سرب (۱٪) در استخوانها ذخیره میشود؛ بقیه آن در ادرار و مدفوع طی چند هفته از قرارگیری در معرض، دفع میشود. حدود یکسوم از سرب در بدن کودک دفع میشود. قرارگیری مداوم در معرض سرب میتواند منجر به زیستانباشتگی آن شود.[۲۴۱]
سمیت
[ویرایش]سرب یک فلز بسیار سمی است (چه استنشاق شود و چه بلعیده شود) و تقریباً تمام ارگانها و سیستمهای بدن انسان را تحت تأثیر قرار میدهد.[۲۴۲] در سطوح هوایی ۱۰۰ میلیگرم بر مترمکعب، سرب بلافاصله برای زندگی و سلامت خطرناک است.[۲۴۳] بیشتر سرب بلعیدهشده در خون جذب میشود.[۲۴۴] علت اصلی سمیت سرب تمایل آن به اختلال در عملکرد صحیح آنزیمها است. این کار را با پیوستن به تیول (شیمی) موجود در بسیاری از آنزیمها انجام میدهد،[۲۴۵] یا با شبیهسازی و جابجایی فلزات دیگر که بهعنوان کوفاکتور (بیوشیمی) در بسیاری از واکنشهای آنزیمی عمل میکنند.[۲۴۶] فلزات ضروری که سرب با آنها تعامل دارد شامل کلسیم، آهن و روی است.[۲۴۷] سطوح بالای کلسیم و آهن معمولاً برخی حفاظت از مسمومیت با سرب فراهم میکنند؛ سطوح پایین آنها باعث افزایش حساسیت به سرب میشود.[۲۴۰]
اثرات
[ویرایش]سرب میتواند آسیب شدیدی به مغز و کلیهها وارد کرده و در نهایت منجر به مرگ شود. با تقلید از کلسیم، سرب قادر است از سد خونی مغزی عبور کند. این عنصر باعث تخریب غلافهای میلین در نورونها، کاهش تعداد آنها، اختلال در مسیرهای ناقل عصبی و کاهش رشد نورونی میشود.[۲۴۵] در بدن انسان، سرب آنزیمهای پروفوبیلیروژن سنتاز و فروکلاتاز را مهار کرده و از تشکیل پروفوبیلیروژن و ترکیب آهن با پروتوپرفیرین IX، که آخرین مرحله در سنتز هم است، جلوگیری میکند. این امر منجر به سنتز ناکارآمد هم و ایجاد کمخونی میکروسیتیک میشود.[۲۴۸]

علائم مسمومیت با سرب شامل بیماری کلیوی، دردهای شکمی شبیه کولیک و احتمالاً ضعف در انگشتان، مچ یا مچ پا است. افزایش اندک فشار خون، بهویژه در افراد میانسال و سالمند، ممکن است آشکار باشد و میتواند به کمخونی منجر شود.[نیازمند منبع] چندین مطالعه، عمدتاً مقطعی، ارتباط بین افزایش مواجهه با سرب و کاهش تغییرپذیری ضربان قلب را نشان دادهاند.[۲۴۹] در زنان باردار، قرارگیری در معرض مقادیر زیاد سرب ممکن است منجر به سقط جنین شود. همچنین مواجهه مزمن و شدید با سرب میتواند موجب کاهش باروری در مردان شود.[۲۵۰]
در مغز در حال رشد کودکان، سرب در تشکیل سیناپس در قشر مغز، رشد مواد شیمیایی عصبی (از جمله ناقلهای عصبی) و سازماندهی مجرای یونی اختلال ایجاد میکند.[۲۵۱] قرارگیری در معرض سرب در دوران کودکی با افزایش خطر اختلالات خواب و خوابآلودگی بیش از حد در دوران بعدی زندگی مرتبط است.[۲۵۲] سطح بالای سرب در خون با تأخیر در بلوغ دختران ارتباط دارد.[۲۵۳] افزایش و کاهش سطح مواجهه با سرب موجود در هوا، ناشی از احتراق تترااتیل سرب در بنزین طی قرن بیستم، با نوسانات تاریخی در سطح جرم و جنایت مرتبط دانسته شده است.
منابع مواجهه
[ویرایش]مواجهه با سرب یک مسئله جهانی است، زیرا استخراج و ذوب سرب، تولید، دفع و بازیافت باتری در بسیاری از کشورها رایج است. سرب از طریق استنشاق، بلع یا جذب از طریق پوست وارد بدن میشود. تقریباً تمام سرب استنشاقشده جذب بدن میشود؛ در حالی که میزان جذب از طریق بلع بین ۲۰ تا ۷۰ درصد متغیر است و کودکان نسبت به بزرگسالان درصد بیشتری را جذب میکنند.[۲۵۴]
مسمومیت معمولاً از طریق مصرف غذا یا آب آلوده به سرب ایجاد میشود و بهندرت بر اثر بلع تصادفی خاک، گرد و غبار یا رنگهای حاوی سرب رخ میدهد.[۲۵۵] محصولات دریایی میتوانند در صورت قرارگیری در معرض پسابهای صنعتی حاوی سرب آلوده شوند.[۲۵۶] میوهها و سبزیجات نیز در خاکهای دارای سطوح بالای سرب آلوده میشوند. خاک ممکن است از طریق تجمع ذرات سرب از لولههای آب، رنگ سرب و بقایای انتشار سرب از بنزین آلوده شود.[۲۵۷]
استفاده از سرب در لولههای آب در مناطقی که آب نرم یا اسیدی دارند، مشکلی جدی محسوب میشود.[۲۵۸] آب سخت لایههای محافظ نامحلولی را در سطح داخلی لولهها تشکیل میدهد، در حالی که آب نرم و اسیدی باعث حل شدن سرب موجود در لولهها میشود.[۲۵۹] حل شدن دیاکسید کربن در آب میتواند منجر به تشکیل بیکربنات سرب محلول شود؛ آب اکسیژنه نیز ممکن است سرب را به صورت هیدروکسید سرب (II) حل کند. مصرف طولانیمدت چنین آبی میتواند به مشکلات جدی سلامتی ناشی از سمیت سرب منجر شود. هرچه آب سخت حاوی کلسیم بیکربنات و کلسیم سولفات بیشتری باشد، لایه محافظ داخلی لولهها از کربنات سرب یا سولفات سرب بیشتر تشکیل میشود.[۲۶۰]

بلعیدن رنگهای حاوی سرب مهمترین منبع تماس کودکان با این ماده است؛ یکی از منابع مستقیم، جویدن لبههای رنگشدهٔ پنجرههای قدیمی است. علاوه بر این، زمانی که رنگ حاوی سرب روی یک سطح تخریب میشود، به شکل پوستهپوسته در میآید و به گرد و غبار تبدیل میشود. این گرد و غبار سپس از طریق تماس دست با دهان یا از طریق غذای آلوده یا نوشیدنی وارد بدن میشود. بلعیدن برخی طب سنتی ممکن است منجر به تماس با سرب یا ترکیبات آن شود.[۲۶۱]
استنشاق، دومین مسیر اصلی مواجهه با سرب است که افراد سیگاری و بهویژه کارگران شاغل در مشاغل مرتبط با سرب را تحت تأثیر قرار میدهد.[۲۴۴] دود سیگار علاوه بر مواد سمی دیگر، حاوی ایزوتوپهای سرب رادیواکتیو است.[۲۶۲] «در نتیجهٔ تلاشهای نظارتی آژانس حفاظت از محیط زیست ایالات متحده، سطح سرب در هوا [در ایالات متحده] بین سالهای ۲۰۱۰ تا ۲۰۲۰ حدود ۸۶ درصد کاهش یافته است.»[۲۶۳] میزان غلظت سرب در هوای ایالات متحده در سال ۲۰۱۴ به کمتر از استاندارد ملی ۰٫۱۵ μg/m3 رسید.[۲۶۴][۲۶۵]
تماس پوستی ممکن است برای افرادی که با ترکیبات آلی سرب کار میکنند، قابل توجه باشد. میزان جذب پوستی سرب معدنی کمتر از سرب آلی است.[۲۶۶]
سرب در مواد غذایی
[ویرایش]سرب ممکن است در غذا وجود داشته باشد اگر مواد غذایی در خاک آلوده به سرب رشد کرده باشند، آلودگی سرب موجود در هوا بر محصولات تأثیر بگذارد، حیوانات در رژیم غذایی خود سرب مصرف کنند، یا این ماده از طریق ظروف ذخیرهسازی یا پختوپز وارد غذا شود.[۲۶۷] بلعیدن رنگهای حاوی سرب و باتریها یکی دیگر از مسیرهای تماس دامها با این ماده است که میتواند در نهایت بر سلامت انسان تأثیر بگذارد.[۲۶۸] شیر تولید شده توسط دامهای آلوده میتواند با رقیقسازی به سطح پایینتری از غلظت سرب برسد و برای مصرف فروخته شود.[۲۶۹]
در بنگلادش، ترکیبات سرب به زردچوبه اضافه شدهاند تا رنگ آن زردتر شود.[۲۷۰] باور بر این است که این عمل از دهه ۱۹۸۰ آغاز شده و تا تا تاریخ ۲۰۱۹[بروزرسانی] ادامه داشته است.[۲۷۰] این موضوع یکی از منابع اصلی سطوح بالای سرب در این کشور محسوب میشود.[۲۷۱]
در هنگکنگ، حداکثر میزان مجاز سرب در مواد غذایی، ۶ قسمت در میلیون برای مواد جامد و ۱ قسمت در میلیون برای مایعات است.[۲۷۲]
گرد و غبار حاوی سرب میتواند بر روی دانههای کاکائو که در فضای باز و نزدیک به کارخانههای آلاینده خشک میشوند، بنشیند.[۲۷۳] در دسامبر ۲۰۲۲، Consumer Reports با آزمایش ۲۸ برند شکلات تلخ دریافت که ۲۳ مورد از آنها دارای سطوح بالقوه خطرناک سرب، کادمیم یا هر دو هستند. این سازمان از تولیدکنندگان شکلات خواسته است که سطح سرب را کاهش دهند، زیرا میتواند به ویژه برای جنین در حال رشد مضر باشد.[۲۷۴]
در مارس ۲۰۲۴، سازمان غذا و دارو (آمریکا) بهطور داوطلبانه فراخوانی برای شش برند دارچین به دلیل آلودگی به سرب صادر کرد.[۲۷۵] این اقدام پس از دریافت ۵۰۰ گزارش از مسمومیت با سرب در کودکان انجام شد.[۲۷۶] سازمان غذا و دارو (FDA) تشخیص داد که دارچین با سرب(II) کرومات تقلب شده است.[۲۷۷]
سرب در اسباببازیهای پلاستیکی
[ویرایش]بر اساس گزارش مرکز کنترل و پیشگیری از بیماری (ایالات متحده), استفاده از سرب در پلاستیکها تا سال ۲۰۲۴ ممنوع نشده است. سرب باعث نرم شدن پلاستیک و افزایش انعطافپذیری آن میشود تا بتواند به شکل اولیه خود بازگردد. مشخص شده که جویدن مداوم عایق پلاستیکی رنگی از سیمهای برق لختشده، در یک مرد ۴۶ ساله منجر به افزایش سطح سرب در بدن او شده است.[۲۷۸] ممکن است از سرب در اسباببازیهای پلاستیکی برای پایدارسازی مولکولها در برابر گرما استفاده شود. گرد و غبار سرب زمانی تشکیل میشود که پلاستیک در معرض نور خورشید، هوا و مواد شوینده قرار بگیرد، زیرا این عوامل باعث شکستن پیوند شیمیایی بین سرب و پلاستیک میشوند.[۲۷۹]
درمان
[ویرایش]درمان معمول برای مسمومیت با سرب شامل تجویز دیمرکاپرول و دی مرکاپتو سوکسینیک اسید است.[۲۸۰] در موارد حاد، ممکن است از سدیم کلسیم ادتات، چنگاله کلسیم و نمک دیسدیم اتیلندیآمینتترااستیک اسید (اتیلندیآمینتترااستیک اسید) استفاده شود. این ماده تمایل بیشتری به سرب نسبت به کلسیم دارد، بنابراین با جایگزینی آن، ترکیب چنگالهای سرب تشکیل شده و از طریق ادرار دفع میشود، درحالیکه کلسیم بیضرر باقی میماند.[۲۸۱]
تأثیرات زیستمحیطی
[ویرایش]
استخراج، تولید، استفاده و دفع سرب و محصولات آن باعث آلودگی گسترده خاکها و منابع آبی زمین شده است. انتشار جوی سرب در دوران انقلاب صنعتی و همچنین دورهٔ استفاده از بنزین سربدار در نیمه دوم قرن بیستم به اوج خود رسید.[۲۸۲]
منابع انتشار سرب شامل منابع طبیعی (یعنی غلظت طبیعی سرب موجود)، تولیدات صنعتی، سوزاندن زباله و بازیافت، و جابجایی سرب دفنشدهٔ پیشین هستند.[۲۸۲] بهویژه در مناطق جنوبی جهان، با حذف تدریجی سرب از سایر مصارف، فعالیتهای بازیافت سرب بهعنوان روشی ارزان برای تأمین سرب مورد نیاز تولید جهانی، به منبعی مستند از قرار گرفتن در معرض سرب تبدیل شده است.[۲۸۳] غلظتهای بالای سرب همچنان در خاکها و رسوبات مناطق پساصنعتی و شهری باقی ماندهاند؛ انتشار صنعتی، از جمله انتشار ناشی از سوزاندن زغالسنگ،[۲۸۴] در بسیاری از نقاط جهان، بهویژه در کشورهای در حال توسعه، ادامه دارد.[۲۸۵]
سرب میتواند در خاکها، بهویژه خاکهای دارای محتوای آلی بالا، تجمع یافته و صدها تا هزاران سال باقی بماند. سرب محیطی میتواند با فلزات دیگر موجود در سطح و داخل گیاهان رقابت کند و احتمالاً فتوسنتز را مهار کرده و در غلظتهای بالا، رشد و بقای گیاهان را تحت تأثیر قرار دهد. آلودگی خاکها و گیاهان میتواند منجر به ورود سرب به زنجیره غذایی شود و بر میکروارگانیسمها و جانوران تأثیر بگذارد. در جانوران، سرب در بسیاری از اندامها سمیت نشان میدهد و پس از بلع، استنشاق یا جذب از طریق پوست، به سیستم عصبی، کلیه، تولیدمثل، خونسازی و سیستم قلبیعروقی آسیب میرساند.[۲۸۶] ماهیان از هر دو منبع آب و رسوب، سرب را جذب میکنند؛[۲۸۷] تجمع زیستی آن در زنجیره غذایی تهدیدی برای ماهیان، پرندگان و پستانداران دریایی محسوب میشود.[۲۸۸]
سرب حاصل از فعالیتهای انسانی شامل سرب موجود در ساچمه و وزنه ماهیگیری است. این منابع همراه با مکانهای تولید سرب، از مهمترین منابع آلودگی محسوب میشوند.[۲۸۹] استفاده از سرب در ساچمه و وزنه ماهیگیری در ایالات متحده در سال ۲۰۱۷ ممنوع شد،[۲۹۰] اما این ممنوعیت تنها برای یک ماه اجرایی بود،[۲۹۱] و ممنوعیت مشابهی در اتحادیه اروپا در حال بررسی است.[۲۹۲]
روشهای تحلیلی برای تعیین مقدار سرب در محیط شامل طیفنورسنجی، طیفسنجی فلورسانس پرتو ایکس، طیفسنجی اتمی و الکتروشیمی هستند. یک الکترود انتخابی یونی ویژه بر اساس یونوفور S,S'-متیلنبیس(N,N-دیایزوبوتیلدیتیوکربامات) توسعه یافته است.[۲۹۳] یکی از مهمترین آزمایشهای زیستی برای سنجش مسمومیت با سرب، اندازهگیری سطح δ-آمینولوولینیک اسید در پلاسما، سرم و ادرار است.[۲۹۴]
محدودیتها و روشهای کاهش آلودگی
[ویرایش]
تا اواسط دهه ۱۹۸۰، استفاده از سرب در صنایع بهطور قابلتوجهی کاهش یافت.[۲۹۵] در ایالات متحده، قوانین زیستمحیطی موجب کاهش یا حذف سرب از محصولات غیر باتری، از جمله بنزین، رنگها، لحیمکاریها و سیستمهای آبرسانی شدند. همچنین، در نیروگاههای زغالسنگسوز تجهیزات کنترلی برای جلوگیری از انتشار ذرات سرب نصب گردید.[۲۸۴] در سال ۱۹۹۲، کنگره ایالات متحده، آژانس حفاظت از محیط زیست را موظف کرد تا سطح سرب در خون کودکان این کشور را کاهش دهد.[۲۹۶] استفاده از سرب همچنین با اجرای دستورالعمل محدودیت مواد خطرناک اتحادیه اروپا در سال ۲۰۰۳، محدودتر شد.[۲۹۷] ممنوعیت استفاده از ساچمههای سربی برای شکار و تیراندازی ورزشی در هلند در سال ۱۹۹۳، میزان رسوب سرب را از ۲۳۰ تن در سال ۱۹۹۰ به ۴۷٫۵ تن در سال ۱۹۹۵ کاهش داد.[۲۹۸] با این حال، استفاده از سرب در بنزین هوایی برای هوانوردی عمومی در اتحادیه اروپا همچنان تا سال ۲۰۲۲ مجاز بوده است.[۲۹۹]
در ایالات متحده، حد مجاز مواجهه با سرب در محیط کار برای سرب فلزی، ترکیبات معدنی سرب و صابونهای سربی، به میزان ۵۰ میکروگرم بر متر مکعب در یک شیفت کاری ۸ ساعته تعیین شده است. همچنین، حد مجاز سطح سرب در خون در سال ۲۰۱۲ به ۵ میکروگرم در هر ۱۰۰ گرم خون کاهش یافت.[۳۰۰] با این حال، سرب همچنان ممکن است در مقادیر خطرناک در برخی محصولات مانند ظروف سفالی،[۳۰۱] وینیل[۳۰۲] (مانند عایقهای سیمهای برق) و برنج چینی یافت شود.[ز] خانههای قدیمی ممکن است همچنان دارای رنگهای سربدار باشند.[۳۰۲] اگرچه رنگ سفید سربی در کشورهای صنعتی از بازار حذف شده است، اما برخی رنگدانههای سربی، مانند سرب(II) کرومات زرد، هنوز برای کاربردهای خاص، بهویژه در رنگآمیزی خطوط جادهها استفاده میشوند.[۳۰۴][۳۰۵]
سنبادهزنی رنگهای قدیمی حاوی سرب، گرد و غبار سمی تولید میکند که استنشاق آن خطرناک است.[۳۰۶] برخی مقامات، اجرای برنامههای کاهش آلودگی سرب را در املاک مسکونی دارای کودکان خردسال اجباری کردهاند.[۳۰۷] استفاده از سرب در بنزین هوایی برای هوانوردی عمومی در ایالات متحده همچنان تا سال ۲۰۲۳ مجاز بوده است.[۳۰۸]
زبالههای سربی، بسته به حوزه قضائی و ماهیت زبالهها، ممکن است بهعنوان زبالههای خانگی (برای تسهیل فعالیتهای کاهش آلودگی سرب) [۳۰۹] یا بهعنوان زبالههای خطرناک که نیاز به درمان یا ذخیرهسازی ویژه دارند، در نظر گرفته شوند.[۳۱۰] سرب در مکانهای تیراندازی به محیطزیست وارد میشود و چندین روش مدیریت سرب برای مقابله با آلودگی ناشی از آن توسعه یافته است.[۳۱۱] مهاجرت سرب در خاکهای اسیدی میتواند افزایش یابد؛ برای مقابله با این مسئله، توصیه میشود خاکها با آهک خنثایش شوند تا از زهکشی سرب جلوگیری شود.[۳۱۲]
تحقیقات زیادی در مورد چگونگی حذف سرب از سیستمهای زیستی از طریق روشهای زیستی انجام شده است: استخوانهای ماهی در حال تحقیق هستند تا توانایی آنها در زیستپالایی سرب در خاکهای آلوده بررسی شود.[۳۱۳][۳۱۴] قارچ Aspergillus versicolor برای جذب یونهای سرب از زبالههای صنعتی قبل از رهاسازی در منابع آب مؤثر است.[۳۱۵] چندین باکتری نیز برای توانایی آنها در حذف سرب از محیط زیست مورد تحقیق قرار گرفتهاند، از جمله باکتریهای کاهشدهنده سولفات Desulfovibrio و Desulfotomaculum که هر دو در محلولهای آبی بسیار مؤثر هستند.[۳۱۶] گیاه Urochloa ramosa (چمن ارزن) توانایی تجمع مقادیر زیادی از فلزات مانند سرب و روی را در بافتهای شاخه و ریشه خود دارد و آن را به گیاهی مهم برای پاکسازی خاکهای آلوده تبدیل میکند.[۳۱۷]
یادداشتها
[ویرایش]- ↑ یک عدد زوج از پروتون یا نوترون معمولاً پایداری هستهای ایزوتوپها را افزایش میدهد. هیچ عنصری با عدد اتمی فرد بیش از دو ایزوتوپ پایدار ندارد؛ عناصر زوج دارای چندین ایزوتوپ پایدار هستند که قلع (عنصر ۵۰) بیشترین تعداد ایزوتوپها، یعنی ده عدد، را دارد.[۲۴] برای جزئیات بیشتر، به هستههای اتمی زوج و فرد مراجعه کنید.
- ↑ نیمهعمر مشاهدهشده در آزمایش ۱٫۹×۱۰۱۹ سال بود.[۲۶] یک کیلوگرم بیسموت طبیعی تقریباً ۰٫۰۰۳ بکرل (واپاشی در ثانیه) فعالیت دارد. در مقایسه، میزان تابش طبیعی در بدن انسان حدود ۶۵ بکرل در هر کیلوگرم از وزن بدن (بهطور میانگین ۴۵۰۰ بکرل) است.[۲۷]
- ↑ Tetraphenyllead حتی از نظر حرارتی پایدارتر است و در 270 °C تجزیه میشود.[۷۶]
- ↑ مقادیر در منبع نسبت به سیلیکون ذکر شدهاند نه بهصورت ذرهای. مجموع تمام عناصر در 106 قسمت سیلیکون برابر با 2.6682×۱۰۱۰ قسمت است؛ سرب شامل ۳٫۲۵۸ قسمت میباشد.
- ↑ آمار فراوانی عناصر تخمین زدهشده است و جزئیات آنها ممکن است از منبعی به منبع دیگر متفاوت باشد.[۱۰۰]
- ↑ نوشته نوشته میگوید: "ساخته شده زمانی که امپراتور وسپاسیان برای نهمین بار و امپراتور تیتوس برای هفتمین بار کنسول بودند، زمانی که نئوس ژولیوس آگریکولا فرماندار امپراتوری (بریتانیا) بود."
- ↑ گاز فرعی از فرایند ککسازی، شامل کربن منوکسید، هیدروژن و متان; بهعنوان سوخت استفاده میشود.
- ↑ کالیفرنیا از ژوئیه ۲۰۱۵ گلولههای سربی برای شکار را بر اساس این نگرانیها ممنوع کرده است.[۱۹۶]
- ↑ برای مثال، یک شرکت «... برای بیش از یک قرن، تزئینات باغی سربی با کیفیت را از استودیو خود در غرب لندن تولید میکند».[۲۰۶]
- ↑ صدمات بالقوه برای کاربران معمولی این باتریها به سمیت سرب مرتبط نیست.[۲۱۶]
- ↑ برای جزئیات بیشتر در مورد نحوه عملکرد باتری اسید-سرب، به [۲۱۸] مراجعه کنید.
- ↑ میزانها بهطور قابل توجهی در کشورهای مختلف متفاوت است.[۲۳۸]
- ↑ آلیاژی از برنج (آلیاژ) (مس و روی) همراه با سرب، آهن، قلع و گاهی آنتیموان.[۳۰۳]
منابع
[ویرایش]- ↑ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Theodore Low De Vinne 1899, pp. 9–36.
- ↑ Lide 2005, p. 10–179.
- ↑ Pyykkö 1988, pp. 563–594.
- ↑ Claudio, Godwin & Magyar 2002, pp. 1–144.
- ↑ Norman 1996, p. 36.
- ↑ Greenwood & Earnshaw 1998, pp. 226–227, 374.
- ↑ Christensen 2002, p. 867.
- ↑ Considine & Considine 2013, pp. 501, 2970.
- ↑ Greenwood & Earnshaw 1998, p. 372.
- ↑ Greenwood & Earnshaw 1998, pp. 372–373.
- ↑ ۱۲٫۰ ۱۲٫۱ Thornton, Rautiu & Brush 2001, p. 6.
- ↑ Lide 2005, pp. 12–35, 12–40.
- ↑ Brenner 2003, p. 396.
- ↑ Jones 2014, p. 42.
- ↑ Vogel & Achilles 2013, p. 8.
- ↑ Anderson 1869, pp. 341–343.
- ↑ Gale & Totemeier 2003, pp. 15–2–15–3.
- ↑ Thornton, Rautiu & Brush 2001, p. 8.
- ↑ ۲۰٫۰ ۲۰٫۱ Lide 2005, p. 12–219.
- ↑ Lide 2005, p. 12–45.
- ↑ Blakemore 1985, p. 272.
- ↑ Webb, Marsiglio & Hirsch 2015.
- ↑ ۲۴٫۰ ۲۴٫۱ ۲۴٫۲ ۲۴٫۳ ۲۴٫۴ IAEA - Nuclear Data Section 2017.
- ↑ ۲۵٫۰ ۲۵٫۱ Stone 1997.
- ↑ de Marcillac et al. 2003, pp. 876–78.
- ↑ World Nuclear Association 2015.
- ↑ Beeman et al. 2013.
- ↑ Radioactive Decay Series 2012.
- ↑ Smirnov, Borisevich & Sulaberidze 2012.
- ↑ Greenwood & Earnshaw 1998, p. 368.
- ↑ Levin 2009, pp. 40–41.
- ↑ Webb 2000, p. 115.
- ↑ Wrackmeyer & Horchler 1990.
- ↑ Cangelosi & Pecoraro 2015.
- ↑ Fiorini 2010, pp. 7–8.
- ↑ Thürmer, Williams & Reutt-Robey 2002, pp. 2033–2035.
- ↑ Tétreault, Sirois & Stamatopoulou 1998, pp. 17–32.
- ↑ Thornton, Rautiu & Brush 2001, pp. 10–11.
- ↑ ۴۰٫۰ ۴۰٫۱ ۴۰٫۲ ۴۰٫۳ ۴۰٫۴ ۴۰٫۵ Greenwood & Earnshaw 1998, p. 373.
- ↑ Bretherick 2016, p. 1442.
- ↑ Harbison, Bourgeois & Johnson 2015, p. 132.
- ↑ ۴۳٫۰ ۴۳٫۱ Greenwood & Earnshaw 1998, p. 374.
- ↑ Thornton, Rautiu & Brush 2001, pp. 11–12.
- ↑ Polyanskiy 1986, p. 20.
- ↑ Kaupp 2014, pp. 9–10.
- ↑ Dieter & Watson 2009, p. 509.
- ↑ Hunt 2014, p. 215.
- ↑ ۴۹٫۰ ۴۹٫۱ ۴۹٫۲ King 1995, pp. 43–63.
- ↑ Bunker & Casey 2016, p. 89.
- ↑ Whitten, Gailey & David 1996, pp. 904–905.
- ↑ Greenwood & Earnshaw 1998, p. 384.
- ↑ Greenwood & Earnshaw 1998, p. 387.
- ↑ ۵۴٫۰ ۵۴٫۱ Greenwood & Earnshaw 1998, p. 389.
- ↑ Zuckerman & Hagen 1989, p. 426.
- ↑ Funke 2013.
- ↑ ۵۷٫۰ ۵۷٫۱ Greenwood & Earnshaw 1998, p. 382.
- ↑ Bharara & Atwood 2006, p. 4.
- ↑ Greenwood & Earnshaw 1998, p. 388.
- ↑ Toxicological Profile for Lead 2007, p. 277.
- ↑ Downs & Adams 2017, p. 1128.
- ↑ Brescia 2012, p. 234.
- ↑ Macintyre 1992, p. 3775.
- ↑ Silverman 1966, pp. 2067–2069.
- ↑ Greenwood & Earnshaw 1998, p. 381.
- ↑ Yong, Hoffmann & Fässler 2006, pp. 4774–4778.
- ↑ Becker et al. 2008, pp. 9965–9978.
- ↑ Mosseri, Henglein & Janata 1990, pp. 2722–2726.
- ↑ Konu & Chivers 2011, pp. 391–392.
- ↑ Hadlington 2017, p. 59.
- ↑ Greenwood & Earnshaw 1998, pp. 384–386.
- ↑ Röhr 2017.
- ↑ Alsfasser 2007, pp. 261–263.
- ↑ Greenwood & Earnshaw 1998, p. 393.
- ↑ Stabenow, Saak & Weidenbruch 2003.
- ↑ ۷۶٫۰ ۷۶٫۱ ۷۶٫۲ ۷۶٫۳ Greenwood & Earnshaw 1998, p. 404.
- ↑ ۷۷٫۰ ۷۷٫۱ Wiberg, Wiberg & Holleman 2001, p. 918.
- ↑ Toxicological Profile for Lead 2007, p. 287.
- ↑ Polyanskiy 1986, p. 44.
- ↑ Windholz 1976.
- ↑ Zýka 1966, p. 569.
- ↑ "When will we see unleaded AvGas?". 5 August 2019. Retrieved 2024-05-26.
- ↑ Polyanskiy 1986, p. 43.
- ↑ ۸۴٫۰ ۸۴٫۱ ۸۴٫۲ ۸۴٫۳ Lodders 2003, pp. 1222–1223.
- ↑ Roederer et al. 2009, pp. 1963–1980.
- ↑ Lochner, Rohrbach & Cochrane 2005, p. 12.
- ↑ Lodders 2003, p. 1224.
- ↑ Burbidge et al. 1957, pp. 608–615.
- ↑ Burbidge et al. 1957, p. 551.
- ↑ Burbidge et al. 1957, pp. 608–609.
- ↑ Burbidge et al. 1957, p. 553.
- ↑ Frebel 2015, pp. 114–115.
- ↑ Burbidge et al. 1957, pp. 608–610.
- ↑ Burbidge et al. 1957, p. 595.
- ↑ Burbidge et al. 1957, p. 596.
- ↑ Burbidge et al. 1957, pp. 582, 609–615.
- ↑ Langmuir & Broecker 2012, pp. 183–184.
- ↑ Davidson et al. 2014, pp. 4–5.
- ↑ Emsley 2011, pp. 286, passim.
- ↑ Cox 1997, p. 182.
- ↑ ۱۰۱٫۰ ۱۰۱٫۱ Davidson et al. 2014, p. 4.
- ↑ ۱۰۲٫۰ ۱۰۲٫۱ ۱۰۲٫۲ ۱۰۲٫۳ United States Geological Survey 2017, p. 97.
- ↑ Rieuwerts 2015, p. 225.
- ↑ Merriam-Webster.
- ↑ ۱۰۵٫۰ ۱۰۵٫۱ Kroonen 2013, *lauda-.
- ↑ Nikolayev 2012.
- ↑ Kroonen 2013, *bliwa- 2.
- ↑ Kroonen 2013, *laidijan-.
- ↑ ۱۰۹٫۰ ۱۰۹٫۱ Rich 1994, p. 4.
- ↑ ۱۱۰٫۰ ۱۱۰٫۱ ۱۱۰٫۲ ۱۱۰٫۳ ۱۱۰٫۴ Winder 1993b.
- ↑ History of Cosmetics.
- ↑ Chapurukha Kusimba 2017.
- ↑ Yu & Yu 2004, p. 26.
- ↑ Toronto museum explores 2003.
- ↑ Neiburger 2018.
- ↑ Bisson & Vogel 2000, p. 105.
- ↑ Wood, Hsu & Bell 2021.
- ↑ Rich 1994, p. 5.
- ↑ United States Geological Survey 1973.
- ↑ Lead sling bullet.
- ↑ ۱۲۱٫۰ ۱۲۱٫۱ Hong et al. 1994, pp. 1841–1843.
- ↑ de Callataÿ 2005, pp. 361–372.
- ↑ Ceccarelli 2013, p. 35.
- ↑ Ossuaries and Sarcophagi.
- ↑ Calvo Rebollar 2019, p. 45.
- ↑ Thornton, Rautiu & Brush 2001, pp. 179–184.
- ↑ Bisel & Bisel 2002, pp. 459–460.
- ↑ Retief & Cilliers 2006, pp. 149–151.
- ↑ Grout 2017.
- ↑ Eschnauer & Stoeppler 1992, p. 58.
- ↑ Hodge 1981, pp. 486–491.
- ↑ Gilfillan 1965, pp. 53–60.
- ↑ Nriagu 1983, pp. 660–663.
- ↑ Scarborough 1984.
- ↑ Waldron 1985, pp. 107–108.
- ↑ Reddy & Braun 2010, p. 1052.
- ↑ Delile et al. 2014, pp. 6594–6599.
- ↑ Finger 2006, p. 184.
- ↑ Lewis 1985, p. 15.
- ↑ Thornton, Rautiu & Brush 2001, p. 183.
- ↑ Polyanskiy 1986, p. 8.
- ↑ Thomson 1830, p. 74.
- ↑ Oxford English Dictionary, surma.
- ↑ Vasmer & 1986–1987, сурьма.
- ↑ Kellett 2012, pp. 106–107.
- ↑ ۱۴۶٫۰ ۱۴۶٫۱ Winder 1993a.
- ↑ ۱۴۷٫۰ ۱۴۷٫۱ Rich 1994, p. 7.
- ↑ Rich 1994, p. 8.
- ↑ Ede & Cormack 2016, p. 54.
- ↑ Cotnoir 2006, p. 35.
- ↑ Samson 1885, p. 388.
- ↑ Sinha et al. 1993.
- ↑ ۱۵۳٫۰ ۱۵۳٫۱ Ramage 1980, p. 8.
- ↑ Tungate 2011, p. 14.
- ↑ Donnelly 2014, pp. 171–172.
- ↑ Ashikari 2003, p. 65.
- ↑ Nakashima et al. 1998, p. 59.
- ↑ Rabinowitz 1995, p. 66.
- ↑ Gill & Libraries Board of South Australia 1974, p. 69.
- ↑ Bisson & Vogel 2000, p. 85.
- ↑ Bisson & Vogel 2000, pp. 131–132.
- ↑ Hong et al. 1994, pp. 1841–43.
- ↑ Lead mining.
- ↑ Rich 1994, p. 11.
- ↑ ۱۶۵٫۰ ۱۶۵٫۱ ۱۶۵٫۲ Riva et al. 2012, pp. 11–16.
- ↑ Hernberg 2000, p. 246.
- ↑ Markowitz & Rosner 2000, p. 37.
- ↑ More et al. 2017.
- ↑ American Geophysical Union 2017.
- ↑ Centers for Disease Control and Prevention 1997.
- ↑ Rich 1994, p. 117.
- ↑ Rich 1994, p. 17.
- ↑ Rich 1994, pp. 91–92.
- ↑ United States Geological Survey 2005.
- ↑ Zhang et al. 2012, pp. 2261–2273.
- ↑ Tolliday 2014.
- ↑ Guberman 2016, pp. 42.14–15.
- ↑ Graedel 2010.
- ↑ ۱۷۹٫۰ ۱۷۹٫۱ ۱۷۹٫۲ Thornton, Rautiu & Brush 2001, p. 56.
- ↑ Davidson et al. 2014, p. 6.
- ↑ ۱۸۱٫۰ ۱۸۱٫۱ ۱۸۱٫۲ ۱۸۱٫۳ Davidson et al. 2014, p. 17.
- ↑ Thornton, Rautiu & Brush 2001, p. 51.
- ↑ Davidson et al. 2014, pp. 11–12.
- ↑ Thornton, Rautiu & Brush 2001, pp. 51–52.
- ↑ Davidson et al. 2014, p. 25.
- ↑ ۱۸۶٫۰ ۱۸۶٫۱ ۱۸۶٫۲ ۱۸۶٫۳ Primary Lead Refining.
- ↑ Pauling 1947.
- ↑ Davidson et al. 2014, p. 34.
- ↑ Davidson et al. 2014, p. 23.
- ↑ Thornton, Rautiu & Brush 2001, pp. 52–53.
- ↑ United States Environmental Protection Agency 2010, p. 1.
- ↑ ۱۹۲٫۰ ۱۹۲٫۱ Thornton, Rautiu & Brush 2001, p. 57.
- ↑ Street & Alexander 1998, p. 181.
- ↑ Evans 1908, pp. 133–179.
- ↑ Baird & Cann 2012, pp. 537–538, 543–547.
- ↑ California Department of Fish and Wildlife.
- ↑ "Nontoxic Shot Regulations For Hunting Waterfowl and Coots in the U.S. | U.S. Fish & Wildlife Service". www.fws.gov (به انگلیسی). 2022-04-19. Retrieved 2024-09-12.
- ↑ Canada, Environment and Climate Change (2018-04-05). "Moving towards using more lead-free ammunition". www.canada.ca. Retrieved 2024-09-12.
- ↑ "Regulation - 2021/57 - EN - EUR-Lex". eur-lex.europa.eu (به انگلیسی). Retrieved 2024-09-12.
- ↑ Parker 2005, pp. 194–195.
- ↑ Krestovnikoff & Halls 2006, p. 70.
- ↑ Street & Alexander 1998, p. 182.
- ↑ Jensen 2013, p. 136.
- ↑ Think Lead research.
- ↑ Weatherings to Parapets.
- ↑ Lead garden ornaments 2016.
- ↑ Putnam 2003, p. 216.
- ↑ Copper Development Association.
- ↑ ۲۰۹٫۰ ۲۰۹٫۱ Rich 1994, p. 101.
- ↑ Guruswamy 2000, p. 31.
- ↑ Audsley 1965, pp. 250–251.
- ↑ Palmieri 2006, pp. 412–413.
- ↑ National Council on Radiation Protection and Measurements 2004, p. 16.
- ↑ Thornton, Rautiu & Brush 2001, p. 7.
- ↑ Tuček, Carlsson & Wider 2006, p. 1590.
- ↑ Concordia University 2016.
- ↑ Toxicological Profile for Lead 2007, pp. 5–6.
- ↑ Progressive Dynamics, Inc.
- ↑ Olinsky-Paul 2013.
- ↑ Gulbinska 2014.
- ↑ Rich 1994, pp. 133–134.
- ↑ Zhao 2008, p. 440.
- ↑ Beiner et al. 2015.
- ↑ Szczepanowska 2013, pp. 84–85.
- ↑ Burleson 2001, p. 23.
- ↑ Insight Explorer & IPEN 2016.
- ↑ Singh 2017.
- ↑ Ismawati et al. 2013, p. 2.
- ↑ Zweifel 2009, p. 438.
- ↑ Wilkes et al. 2005, p. 106.
- ↑ Randerson 2002.
- ↑ Nriagu & Kim 2000, pp. 37–41.
- ↑ Amstock 1997, pp. 116–119.
- ↑ Rogalski 2010, pp. 485–541.
- ↑ "Lead 695912".
- ↑ World Health Organization 2018.
- ↑ Bouchard et al. 2009.
- ↑ World Health Organization 2000, pp. 149–153.
- ↑ Emsley 2011, pp. 280, 621, 255.
- ↑ ۲۴۰٫۰ ۲۴۰٫۱ Luckey & Venugopal 1979, pp. 177–178.
- ↑ Toxic Substances Portal.
- ↑ United States Food and Drug Administration 2015, p. 42.
- ↑ National Institute for Occupational Safety and Health.
- ↑ ۲۴۴٫۰ ۲۴۴٫۱ Occupational Safety and Health Administration.
- ↑ ۲۴۵٫۰ ۲۴۵٫۱ Rudolph et al. 2003, p. 369.
- ↑ Dart, Hurlbut & Boyer-Hassen 2004, p. 1426.
- ↑ Kosnett 2006, p. 238.
- ↑ Cohen, Trotzky & Pincus 1981, pp. 904–906.
- ↑ Sokol 2005, p. 133, passim.
- ↑ Mycyk, Hryhorczuk & Amitai 2005, p. 462.
- ↑ Liu et al. 2015, pp. 1869–1874.
- ↑ Schoeters et al. 2008, pp. 168–175.
- ↑ Tarragó 2012, p. 16.
- ↑ Toxicological Profile for Lead 2007, p. 4.
- ↑ Bremner 2002, p. 101.
- ↑ Agency for Toxic Substances and Disease Registry 2007.
- ↑ Thornton, Rautiu & Brush 2001, p. 17.
- ↑ Moore 1977, pp. 109–115.
- ↑ Wiberg, Wiberg & Holleman 2001, p. 914.
- ↑ Tarragó 2012, p. 11.
- ↑ Centers for Disease Control and Prevention 2015.
- ↑ "آلودگی هوای ناشی از سرب (Pb)". epa.gov. آژانس حفاظت از محیط زیست ایالات متحده. ۸ ژوئیه ۲۰۲۲. Retrieved 22 July 2022.
در نتیجهٔ تلاشهای نظارتی آژانس حفاظت از محیط زیست، سطح سرب در هوا در سطح ملی بین سالهای ۲۰۱۰ تا ۲۰۲۰ حدود ۸۶ درصد کاهش یافته است.
- ↑ "جدول NAAQS". epa.gov. آژانس حفاظت از محیط زیست ایالات متحده. ۵ آوریل ۲۰۲۲. Retrieved 22 July 2022.
استانداردهای ملی کیفیت هوای محیطی (۴۰ CFR بخش ۵۰) برای شش آلایندهٔ اصلی
- ↑ "روندهای سرب". epa.gov. آژانس حفاظت از محیط زیست ایالات متحده. ۱ ژوئن ۲۰۲۲.
- ↑ Wani, Ara & Usman 2015, pp. 57, 58.
- ↑ Castellino, Nicolo; Sannolo, Nicola; Castellino, Pietro (1994). قرار گرفتن در معرض سرب معدنی و مسمومیتهای ناشی از آن. CRC Press. p. 86. ISBN 978-0-87371-997-1. Archived from the original on 2017-11-05.
- ↑ Hesami, Reza; Salimi, Azam; Ghaderian, Seyed Majid (10 ژانویه ۲۰۱۸). "جذب، انباشت و گیاهپالایی سرب، روی و کادمیوم توسط گیاهان رشد یافته در اطراف معدن سرب-روی تنگ دوزان، ایران". Environmental Science and Pollution Research. 25 (9): 8701–8714. Bibcode:2018ESPR...25.8701H. doi:10.1007/s11356-017-1156-y. ISSN 0944-1344. PMID 29322395. S2CID 3938066.
- ↑ Mielke, Howard W.; Reagan, Patrick L. (فوریه ۱۹۹۸). "خاک، یکی از مسیرهای مهم مواجهه انسانی با سرب". Environmental Health Perspectives. 106 (Suppl 1): 217–229. doi:10.2307/3433922. ISSN 0091-6765. JSTOR 3433922. PMC 1533263. PMID 9539015.
- ↑ ۲۷۰٫۰ ۲۷۰٫۱ Jordan, Rob (24 September 2019). "یافت شدن سرب در زردچوبه". Stanford News. Retrieved 25 September 2019.
- ↑ "پژوهشگران در زردچوبه سرب یافتند". phys.org. 24 September 2019. Retrieved 25 September 2019.
- ↑ "حداکثر میزان مجاز برخی فلزات در غذاهای خاص". Cap. 132V Food Adulteration (Metallic Contamination) Regulations [Past Version]. Hong Kong e-Legislation. Retrieved 15 April 2020.
- ↑ Young, Robin; Miller-Medzon, Karyn (1 February 2023). "شکلات تلخ حاوی کادمیوم و سرب است. چه مقدار مصرف آن ایمن است؟". Here & Now (به انگلیسی). WBUR. Archived from the original on 8 February 2024.
- ↑ Stempel, Jonathan (23 January 2023). "Consumer Reports از تولیدکنندگان شکلات تلخ میخواهد میزان سرب و کادمیوم را کاهش دهند". Yahoo Life (به انگلیسی). Reuters. Retrieved 28 January 2023.
- ↑ "هشدار FDA دربارهٔ برخی محصولات دارچین به دلیل سطح بالای سرب". سازمان غذا و دارو (آمریکا). 6 March 2024. Retrieved 27 May 2024.
- ↑ Aleccia, Jonel (8 March 2024). "دارچین آلوده به سرب فراخوان شد. آنچه باید بدانید". Retrieved 27 May 2024.
- ↑ "بررسی افزایش سطح سرب و کروم: بستههای سس سیب دارچینی (نوامبر ۲۰۲۳)". سازمان غذا و دارو (آمریکا). 16 April 2024. Retrieved 27 May 2024.
- ↑ "Lead Intoxication Associated with Chewing Plastic Wire Coating – Ohio". www.cdc.gov (به انگلیسی). Retrieved 8 June 2024.
- ↑ "About Lead in Consumer Products | Exposure | CDC". www.cdc.gov (به انگلیسی). 16 April 2024. Retrieved 8 June 2024.
- ↑ Prasad 2010, pp. 651–652.
- ↑ Masters, Trevor & Katzung 2008, pp. 481–483.
- ↑ ۲۸۲٫۰ ۲۸۲٫۱ United Nations Environment Programme 2010, p. 4.
- ↑ Renfrew 2019, p. 8.
- ↑ ۲۸۴٫۰ ۲۸۴٫۱ Trace element emission 2012.
- ↑ United Nations Environment Programme 2010, p. 6.
- ↑ Assi et al. 2016.
- ↑ World Health Organization 1995.
- ↑ UK Marine SACs Project 1999.
- ↑ United Nations Environment Programme 2010, p. 9.
- ↑ McCoy 2017.
- ↑ Cama 2017.
- ↑ Layton 2017.
- ↑ Hauser 2017, pp. 49–60.
- ↑ Lauwerys & Hoet 2001, pp. 115, 116–117.
- ↑ "Lead Poisoning: A Historical Perspective".
- ↑ Auer et al. 2016, p. 4.
- ↑ Petzel, Juuti & Sugimoto 2004, pp. 122–124.
- ↑ Deltares & Netherlands Organisation for Applied Scientific Research 2016.
- ↑ Calderwood, Dave (8 March 2022). "Europe moves to ban lead in avgas". FLYER. Retrieved 28 July 2024.
- ↑ Agency for Toxic Substances and Disease Registry 2017.
- ↑ Grandjean 1978, pp. 303–321.
- ↑ ۳۰۲٫۰ ۳۰۲٫۱ Levin et al. 2008, p. 1288.
- ↑ Duda 1996, p. 242.
- ↑ Crow 2007.
- ↑ "Lead Chromate: Why it is Banned in Most Industries Apart From Road Markings". Road Traffic Technology. Verdict Media Limited. Archived from the original on 5 March 2024. Retrieved 2024-05-27.
- ↑ Marino et al. 1990, pp. 1183–1185.
- ↑ Schoch 1996, p. 111.
- ↑ Davoren, Haley (6 June 2023). "From 100LL to G100UL: What comes next for avgas and why today is historic". Globalair.com. Retrieved 28 July 2024.
- ↑ United States Environmental Protection Agency 2000.
- ↑ Lead in Waste 2016.
- ↑ United States Environmental Protection Agency 2005, p. I-1.
- ↑ United States Environmental Protection Agency 2005, p. III-5–III-6.
- ↑ Freeman 2012, pp. a20–a21.
- ↑ Young 2012.
- ↑ Acton 2013, pp. 94–95.
- ↑ Park et al. 2011, pp. 162–174.
- ↑ Lakshmi, P.M.; Jaison, S.; Muthukumar, T.; Muthukumar, M. (1 November 2013). "Assessment of metal accumulation capacity of Brachiaria ramosa collected from cement waste dumping area for the remediation of metal contaminated soil". Ecological Engineering. 60: 96–98. Bibcode:2013EcEng..60...96L. doi:10.1016/j.ecoleng.2013.07.043.
کتابشناسی
[ویرایش]- Acton, Q. A., ed. (2013). Issues in Global Environment—Pollution and Waste Management: 2012 Edition. ScholarlyEditions. ISBN 978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry (August 20, 2007). "Information for the Community: Lead Toxicity" (MP4 webcast, 82 MB). Archived from the original on 16 October 2022. Retrieved 11 February 2017.
- Agency for Toxic Substances and Disease Registry (2017). "Lead Toxicity. What Are U.S. Standards for Lead Levels?". Archived from the original on 12 March 2020. Retrieved 12 June 2018.
- Alsfasser, R. (2007). Moderne anorganische Chemie [Modern inorganic chemistry] (به آلمانی). Walter de Gruyter. ISBN 978-3-11-019060-1.
- American Geophysical Union (2017). "Human Activity Has Polluted European Air for 2000 Years". Eos Science News. Archived from the original on 27 June 2017. Retrieved 4 July 2017.
- Amstock, J. S. (1997). Handbook of Glass in Construction. مکگرا-هیل اجوکیشن. ISBN 978-0-07-001619-4.
- Anderson, J. (1869). "Malleability and ductility of metals". ساینتیفیک آمریکن. 21 (22): 341–43. doi:10.1038/scientificamerican11271869-341.
- Ashikari, M. (2003). "The memory of the women's white faces: Japaneseness and the ideal image of women". Japan Forum. 15 (1): 55–79. doi:10.1080/0955580032000077739. S2CID 144510689.
- Assi, M. A.; Hezmee, M. N. M.; Haron, A. W.; et al. (2016). "The detrimental effects of lead on human and animal health". Veterinary World. 9 (6): 660–671. doi:10.14202/vetworld.2016.660-671. ISSN 0972-8988. PMC 4937060. PMID 27397992.
- Auer, Charles M.; Kover, Frank D.; Aidala, James V.; Greenwood, Mark (1 March 2016). Toxic Substances: A Half Century of Progress (PDF) (Report). EPA Alumni Association. Retrieved 1 January 2019.
- Audsley, G. A. (1965). The Art of Organ Building. Vol. 2. Courier. ISBN 978-0-486-21315-6.
- Baird, C.; Cann, N. (2012). Environmental Chemistry (5th ed.). W. H. Freeman and Company. ISBN 978-1-4292-7704-4.
- Becker, M.; Förster, C.; Franzen, C.; et al. (2008). "Persistent radicals of trivalent tin and lead". Inorganic Chemistry. 47 (21): 9965–78. doi:10.1021/ic801198p. PMID 18823115.
- Beeman, J. W.; Bellini, F.; Cardani, L.; et al. (2013). "New experimental limits on the α decays of lead isotopes". European Physical Journal A. 49 (50): 50. arXiv:1212.2422. Bibcode:2013EPJA...49...50B. doi:10.1140/epja/i2013-13050-7. S2CID 119280082.
- Beiner, G. G.; Lavi, M.; Seri, H.; et al. (2015). "Oddy Tests: Adding the Analytical Dimension". Collection Forum. 29 (1–2): 22–36. doi:10.14351/0831-4985-29.1.22. ISSN 0831-4985.
- Bharara, M. S.; Atwood, D. A. (2006). "Lead: Inorganic ChemistryBased in part on the article Lead: Inorganic Chemistry by Philip G. Harrison which appeared in the Encyclopedia of Inorganic Chemistry, First Edition". Lead: Inorganic Chemistry. doi:10.1002/0470862106.ia118. ISBN 978-0-470-86078-6.
- Bisel, S. C.; Bisel, J. F. (2002). "Health and nutrition at Herculaneum". In Jashemski, W. F.; Meyer, F. G. (eds.). The Natural History of Pompeii. انتشارات دانشگاه کمبریج. pp. 451–75. ISBN 978-0-521-80054-9.
- Bisson, M. S.; Vogel, J. O. (2000). Ancient African Metallurgy: The Sociocultural Context. رومن و لیتلفیلد. ISBN 978-0-7425-0261-1.
- Blakemore, J. S. (1985). Solid State Physics. Cambridge University Press. ISBN 978-0-521-31391-9.
- Bouchard, M. F.; Bellinger, D. C.; Weuve, J.; et al. (2009). "Blood Lead Levels and Major Depressive Disorder, Panic Disorder, and Generalized Anxiety Disorder in US Young Adults". Archives of General Psychiatry. 66 (12): 1313–9. doi:10.1001/archgenpsychiatry.2009.164. ISSN 0003-990X. PMC 2917196. PMID 19996036.
- Bremner, H. A. (2002). Safety and Quality Issues in Fish Processing. الزویر. ISBN 978-1-85573-678-8.
- Brenner, G. A. (2003). Webster's New World American Idioms Handbook. جان وایلی و پسران. ISBN 978-0-7645-2477-6.
- Brescia, F. (2012). Fundamentals of Chemistry: A Modern Introduction. Elsevier. ISBN 978-0-323-14231-1.
- Bretherick, L. (2016). Bretherick's Handbook of Reactive Chemical Hazards. Elsevier. ISBN 978-1-4831-6250-8.
- Bunker, B. C.; Casey, W. H. (2016). The Aqueous Chemistry of Oxides. انتشارات دانشگاه آکسفورد. ISBN 978-0-19-938425-9.
- Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; et al. (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547–654. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- Burleson, M. (2001). The Ceramic Glaze Handbook: Materials, Techniques, Formulas. Sterling. ISBN 978-1-57990-439-5.
- California Department of Fish and Wildlife. "Nonlead Ammunition in California". www.wildlife.ca.gov. Retrieved 17 May 2017.
- de Callataÿ, F. (2005). "The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks". Journal of Roman Archaeology. 18: 361–72. doi:10.1017/S104775940000742X. S2CID 232346123.
- Cama, T. (2017). "Interior secretary repeals ban on lead bullets". هیل (روزنامه). Retrieved 30 May 2018.
- Cangelosi, V. M.; Pecoraro, V. L. (2015). "Lead". In Roduner, E. (ed.). Nanoscopic Materials: Size-Dependent Phenomena and Growth Principles. Royal Society of Chemistry. pp. 843–875. ISBN 978-1-78262-494-3.
- Casciani, D. (2014). "Did removing lead from petrol spark a decline in crime?". بیبیسی نیوز. Retrieved 30 January 2017.
- Calvo Rebollar, Miguel (2019). Construyendo la Tabla Periódica. Zaragoza, Spain: Prames. ISBN 978-84-8321-908-9.
- Ceccarelli, P. (2013). Ancient Greek Letter Writing: A Cultural History (600 BC- 150 BC). OUP Oxford. ISBN 978-0-19-967559-3.
- Centers for Disease Control and Prevention (1997). "Update: blood lead levels--United States, 1991-1994". Morbidity and Mortality Weekly Report. 46 (7): 141–146. ISSN 0149-2195. PMID 9072671.
- Centers for Disease Control and Prevention (2015). "Radiation and Your Health". Retrieved 28 February 2017.
- Chapurukha Kusimba (June 20, 2017). "Making Cents of Currency's Ancient Rise". Smithsonian Magazine. Retrieved 5 November 2021.
- Christensen, N. E. (2002). "Relativistic Solid State Theory". In Schwerdtfeger, P. (ed.). Relativistic Electronic Structure Theory — Fundamentals. Theoretical and Computational Chemistry. Vol. 11. Elsevier. pp. 867–68. doi:10.1016/s1380-7323(02)80041-3. ISBN 978-0-08-054046-7.
- Claudio, Elizabeth S.; Godwin, Hilary Arnold; Magyar, John S. (2002). "Fundamental Coordination Chemistry, Environmental Chemistry, and Biochemistry of Lead(II)". Progress in Inorganic Chemistry, Volume 51 (به انگلیسی). John Wiley & Sons, Inc. pp. 1–144. doi:10.1002/0471267287.ch1. ISBN 978-0-471-26534-4.
- Cohen, A. R.; Trotzky, M. S.; Pincus, D. (1981). "Reassessment of the Microcytic Anemia of Lead Poisoning". Pediatrics. 67 (6): 904–906. doi:10.1542/peds.67.6.904. PMID 7232054. S2CID 42146120.
- Committee on Evaluation of EPA Guidelines for Exposure to Naturally Occurring Radioactive Materials; Commission on Life Sciences; Division on Earth and Life Studies; National Research Council (1999). Evaluation of Guidelines for Exposures to Technologically Enhanced Naturally Occurring Radioactive Materials. National Academies Press. pp. 26, 30–32. ISBN 978-0-309-58070-0.
- دانشگاه کنکوردیا (2016). Lead acid batteries (PDF) (Report). Retrieved 17 February 2019.
- Considine, D. M.; Considine, G. D. (2013). Van Nostrand's Scientific Encyclopedia. Springer Science & Business Media. ISBN 978-1-4757-6918-0.
- Copper Development Association. "Leaded Coppers". copper.org. Retrieved 10 July 2016.
- Cotnoir, B. (2006). The Weiser Concise Guide to Alchemy. Weiser Books. ISBN 978-1-57863-379-1.
- Cox, P. A. (1997). The Elements: Their Origin, Abundance and Distribution. Oxford University Press. ISBN 978-0-19-855298-7.
- Crow, J. M. (2007). "Why use lead in paint?". Chemistry World. انجمن سلطنتی شیمی. Retrieved 22 February 2017.
- Dart, R. C.; Hurlbut, K. M.; Boyer-Hassen, L. V. (2004). "Lead". In Dart, R. C. (ed.). Medical Toxicology (3rd ed.). Lippincott Williams & Wilkins. p. 1426. ISBN 978-0-7817-2845-4.
- Davidson, A.; Ryman, J.; Sutherland, C. A.; et al. (2014). "Lead". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- de Marcillac, Pierre; Coron, Noël; Dambier, Gérard; et al. (2003). "Experimental detection of α-particles from the radioactive decay of natural bismuth". نیچر. 422 (6934): 876–78. Bibcode:2003Natur.422..876D. doi:10.1038/nature01541. PMID 12712201. S2CID 4415582.
- Delile, H.; Blichert-Toft, J.; Goiran, J. -P.; et al. (2014). "Lead in ancient Rome's city waters". مقالات آکادمی ملی علوم ایالات متحده آمریکا. 111 (18): 6594–99. Bibcode:2014PNAS..111.6594D. doi:10.1073/pnas.1400097111. ISSN 0027-8424. PMC 4020092. PMID 24753588.
- Deltares; Netherlands Organisation for Applied Scientific Research (2016). Lood en zinkemissies door jacht [Lead and zinc emissions from hunting] (PDF) (Report) (به هلندی). Archived from the original (PDF) on 12 April 2019. Retrieved 18 February 2017.
- Dieter, R. K.; Watson, R. T. (2009). "Transmetalation reactions producing organocopper compounds". In Rappoport, Z.; Marek, I. (eds.). The Chemistry of Organocopper Compounds. Vol. 1. John Wiley & Sons. pp. 443–526. ISBN 978-0-470-77296-6.
- Donnelly, J. (2014). Deep Blue. اشت بوک گروپ. ISBN 978-1-4449-2119-9.
- Downs, A. J.; Adams, C. J. (2017). The Chemistry of Chlorine, Bromine, Iodine and Astatine: Pergamon Texts in Inorganic Chemistry. Elsevier. ISBN 978-1-4831-5832-7.
- Duda, M. B. (1996). Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet. ISBN 978-981-4260-61-9.
- Ede, A.; Cormack, L. B. (2016). A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press. ISBN 978-1-4426-3503-6.
- Emsley, J. (2011). Nature's Building Blocks: An A-Z Guide to the Elements. Oxford University Press. ISBN 978-0-19-960563-7.
- "Encyclopedia Judaica: Ossuaries and Sarcophagi". www.jewishvirtuallibrary.org. Retrieved 14 July 2018.
- Eschnauer, H. R.; Stoeppler, M. (1992). "Wine—An enological specimen bank". In Stoeppler, M. (ed.). Hazardous Materials in the Environment. Elsevier Science. pp. 49–72 (58). doi:10.1016/s0167-9244(08)70103-3. ISBN 978-0-444-89078-8.
- Evans, J. W. (1908). "V. — The meanings and synonyms of plumbago". Transactions of the Philological Society. 26 (2): 133–79. doi:10.1111/j.1467-968X.1908.tb00513.x.
- Finger, S. (2006). Doctor Franklin's Medicine. University of Pennsylvania Press. ISBN 978-0-8122-3913-3.
- Fiorini, E. (2010). "2.000 years-old Roman Lead for physics" (PDF). ASPERA: 7–8. Archived from the original (PDF) on 26 April 2018. Retrieved 29 October 2016.
- Frankenburg, F. R. (2014). Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO. ISBN 978-1-4408-2932-1.
- Frebel, A. (2015). Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University. ISBN 978-0-691-16506-6.
- Freeman, K. S. (2012). "Remediating soil lead with fishbones". Environmental Health Perspectives. 120 (1): a20–a21. doi:10.1289/ehp.120-a20a. PMC 3261960. PMID 22214821.
- Funke, K. (2013). "Solid State Ionics: from Michael Faraday to green energy—the European dimension". Science and Technology of Advanced Materials. 14 (4): 1–50. Bibcode:2013STAdM..14d3502F. doi:10.1088/1468-6996/14/4/043502. PMC 5090311. PMID 27877585.
- Gale, W. F.; Totemeier, T. C. (2003). Smithells Metals Reference Book. Butterworth-Heinemann. ISBN 978-0-08-048096-1.
- Gilfillan, S. C. (1965). "Lead poisoning and the fall of Rome". Journal of Occupational Medicine. 7 (2): 53–60. ISSN 0096-1736. PMID 14261844.
- Gill, T.; Libraries Board of South Australia (1974). The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia. ISBN 978-0-7243-0035-8.
- Graedel, T. E.; et al. (2010). Metal stocks in Society – Scientific Synthesis (PDF) (Report). International Resource Panel. p. 17. ISBN 978-92-807-3082-1. Archived from the original (PDF) on 26 April 2018. Retrieved 18 April 2017.
- Grandjean, P. (1978). "Widening perspectives of lead toxicity". پژوهشهای زیستمحیطی. 17 (2): 303–21. Bibcode:1978ER.....17..303G. doi:10.1016/0013-9351(78)90033-6. PMID 400972.
- Greenwood, N. N.; Earnshaw, A. (1998). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- Grout, J. (2017). "Lead poisoning and Rome". Encyclopaedia Romana. Retrieved 15 February 2017.
- Guberman, D. E. (2016). "Lead" (PDF). 2014 Minerals Yearbook (Report). سازمان زمینشناسی ایالات متحده آمریکا. Retrieved 8 May 2017.
- Gulbinska, M. K. (2014). Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. اشپرینگر ساینس+بیزینس مدیا. p. 96. ISBN 978-1-4471-6548-4.
- Guruswamy, S. (2000). Engineering properties and applications of lead alloys. Marcel Dekker. ISBN 978-0-8247-8247-4.
- Hadlington, T. J. (2017). On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer. ISBN 978-3-319-51807-7.
- Harbison, R. D.; Bourgeois, M. M.; Johnson, G. T. (2015). Hamilton and Hardy's Industrial Toxicology. John Wiley & Sons. ISBN 978-0-470-92973-5.
- Hauser, P. C. (2017). "Analytical Methods for the Determination of Lead in the Environment". In Astrid, S.; Helmut, S.; Sigel, R. K. O. (eds.). Lead: Its Effects on Environment and Health (PDF). Metal Ions in Life Sciences. Vol. 17. دگرویتر. pp. 49–60. doi:10.1515/9783110434330-003. ISBN 978-3-11-043433-0. PMID 28731296.
- Hernberg, S. (2000). "Lead Poisoning in a Historical Perspective" (PDF). American Journal of Industrial Medicine. 38 (3): 244–54. doi:10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F. PMID 10940962. Archived from the original (PDF) on 21 September 2017. Retrieved 1 March 2017.
- "A History of Cosmetics from Ancient Times". Cosmetics Info. Archived from the original on 14 July 2016. Retrieved 18 July 2016.
- Hodge, T. A. (1981). "Vitruvius, lead pipes and lead poisoning". American Journal of Archaeology. 85 (4): 486–91. doi:10.2307/504874. JSTOR 504874. S2CID 193094209.
- Hong, S.; Candelone, J. -P.; Patterson, C. C.; et al. (1994). "Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations" (PDF). ساینس (مجله). 265 (5180): 1841–43. Bibcode:1994Sci...265.1841H. doi:10.1126/science.265.5180.1841. PMID 17797222. S2CID 45080402.
- Hunt, A. (2014). Dictionary of Chemistry. روتلج. ISBN 978-1-135-94178-9.
- IAEA - Nuclear Data Section (2017). "Livechart - Table of Nuclides - Nuclear structure and decay data". www-nds.iaea.org. آژانس بینالمللی انرژی اتمی. Retrieved 31 March 2017.
- Insight Explorer; IPEN (2016). New Study Finds Lead Levels in a Majority of Paints Exceed Chinese Regulation and Should Not be on Store Shelves (PDF) (Report). Retrieved 3 May 2018.
- Ismawati, Yuyun; Primanti, Andita; Brosché, Sara; Clark, Scott; Weinberg, Jack; Denney, Valerie (2013). Timbal dalam Cat Enamel Rumah Tangga di Indonesia (PDF) (Report) (به اندونزیایی). BaliFokus & IPEN. Retrieved 26 December 2018.
- Jensen, C. F. (2013). Online Location of Faults on AC Cables in Underground Transmission. Springer. ISBN 978-3-319-05397-4.
- Jones, P. A. (2014). Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Constable. ISBN 978-1-4721-1389-4.
- Kaupp, M. (2014). "Chemical bonding of main-group elements" (PDF). In Frenking, G.; Shaik, S. (eds.). The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons. pp. 1–24. doi:10.1002/9783527664658.ch1. ISBN 978-3-527-66465-8. S2CID 17979350.
- Kellett, C. (2012). Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press. ISBN 978-1-909335-05-9. Archived from the original on 9 June 2019.
- King, R. B. (1995). Inorganic Chemistry of Main Group Elements. VCH Publishers. ISBN 978-1-56081-679-9.
- Konu, J.; Chivers, T. (2011). "Stable Radicals of the Heavy p-Block Elements". In Hicks, R. G. (ed.). Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons. doi:10.1002/9780470666975.ch10. ISBN 978-0-470-77083-2.
- Kosnett, M. J. (2006). "Lead". In Olson, K. R. (ed.). Poisoning and Drug Overdose (5th ed.). مکگرا-هیل اجوکیشن. p. 238. ISBN 978-0-07-144333-3.
- Krestovnikoff, M.; Halls, M. (2006). Scuba Diving. دورلینگ کیندرزلی. ISBN 978-0-7566-4063-7.
- Kroonen, G. (2013). Etymological Dictionary of Proto-Germanic. Leiden Indo-European Etymological Dictionary Series. Vol. 11. انتشارات بریل. ISBN 978-90-04-18340-7.
- Langmuir, C. H.; Broecker, W. S. (2012). How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. انتشارات دانشگاه پرینستون. ISBN 978-0-691-14006-3.
- Lauwerys, R. R.; Hoet, P. (2001). Industrial Chemical Exposure: Guidelines for Biological Monitoring, Third Edition. CRC Press. ISBN 978-1-4822-9383-8.
- Layton, M. (2017). "Lead faces threat of new Euro ban". shootinguk.co.uk. Retrieved 30 May 2018.
- "Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI "Catch!"". موزه بریتانیا. Archived from the original on 14 February 2012. Retrieved 30 April 2012.
- "Lead garden ornaments". H. Crowther Ltd. 2016. Retrieved 20 February 2017.
- "Lead in Waste Disposal". آژانس حفاظت محیط زیست ایالات متحده آمریکا. 2016. Retrieved 28 February 2017.
- "Lead mining". The Northern Echo. Retrieved 16 February 2016.
- Levin, H. L. (2009). The Earth Through Time. John Wiley & Sons. ISBN 978-0-470-38774-0.
- Levin, R.; Brown, M. J.; Kashtock, M. E.; et al. (2008). "Lead exposures in U.S. children, 2008: Implications for prevention". Environmental Health Perspectives. 116 (10): 1285–93. Bibcode:2008EnvHP.116.1285L. doi:10.1289/ehp.11241. PMC 2569084. PMID 18941567.
- Lewis, J. (1985). "Lead Poisoning: A Historical Perspective". EPA Journal. 11 (4): 15–18. Retrieved 31 January 2017.
- Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (85th ed.). انتشارات سیآرسی. ISBN 978-0-8493-0484-2.
- Liu, J.; Liu, X.; Pak, V.; et al. (2015). "Early blood lead levels and sleep disturbance in preadolescence". Sleep. 38 (12): 1869–74. doi:10.5665/sleep.5230. PMC 4667382. PMID 26194570.
- Lochner, J. C.; Rohrbach, G.; Cochrane, K. (2005). "What is Your Cosmic Connection to the Elements?" (PDF). مرکز پروازهای فضایی گادرد. Archived from the original (PDF) on 29 December 2016. Retrieved 2 July 2017.
- Lodders, K. (2003). "Solar System abundances and condensation temperatures of the elements" (PDF). ژورنال اخترفیزیکی. 591 (2): 1220–47. Bibcode:2003ApJ...591.1220L. doi:10.1086/375492. ISSN 0004-637X. S2CID 42498829.
- Luckey, T. D.; Venugopal, B. (1979). Physiologic and Chemical Basis for Metal Toxicity. Plenum Press. ISBN 978-1-4684-2952-7.
- Macintyre, J. E. (1992). Dictionary of Inorganic Compounds. CRC Press. ISBN 978-0-412-30120-9.
- Marino, P. E.; Landrigan, P. J.; Graef, J.; et al. (1990). "A case report of lead paint poisoning during renovation of a Victorian farmhouse". American Journal of Public Health. 80 (10): 1183–85. doi:10.2105/AJPH.80.10.1183. PMC 1404824. PMID 2119148.
- Markowitz, G.; Rosner, D. (2000). ""Cater to the children": the role of the lead industry in a public health tragedy, 1900–55". American Journal of Public Health. 90 (1): 36–46. doi:10.2105/ajph.90.1.36. PMC 1446124. PMID 10630135.
- Masters, S. B.; Trevor, A. J.; Katzung, B. G. (2008). Katzung & Trevor's Pharmacology: Examination & Board Review (8th ed.). مکگرا-هیل اجوکیشن. ISBN 978-0-07-148869-3.
- McCoy, S. (2017). "The End of Lead? Federal Gov't Order Bans Sinkers, Ammo". GearJunkie. Archived from the original on 8 March 2020. Retrieved 30 May 2018.
- Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- Merriam-Webster. "Definition of LEAD". www.merriam-webster.com. Retrieved 12 August 2016.
- Moore, M. R. (1977). "Lead in drinking water in soft water areas—health hazards". Science of the Total Environment. 7 (2): 109–15. Bibcode:1977ScTEn...7..109M. doi:10.1016/0048-9697(77)90002-X. PMID 841299.
- More, A. F.; Spaulding, N. E.; Bohleber, P.; et al. (2017). "Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death" (PDF). GeoHealth. 1 (4): 211–219. Bibcode:2017GHeal...1..211M. doi:10.1002/2017GH000064. ISSN 2471-1403. PMC 7007106. PMID 32158988. Archived from the original (PDF) on 18 April 2020. Retrieved 28 August 2019.
- Mosseri, S.; Henglein, A.; Janata, E. (1990). "Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species". Journal of Physical Chemistry. 94 (6): 2722–26. doi:10.1021/j100369a089.
- Mycyk, M.; Hryhorczuk, D.; Amitai, Y.; et al. (2005). "Lead". In Erickson, T. B.; Ahrens, W. R.; Aks, S. (eds.). Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional. ISBN 978-0-07-141736-5.
- Nakashima, T.; Hayashi, H.; Tashiro, H.; et al. (1998). "Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period". Journal of Occupational Health. 40 (1): 55–60. doi:10.1539/joh.40.55. S2CID 71451911.
- National Council on Radiation Protection and Measurements (2004). Structural Shielding Design for Medical X-ray Imaging Facilities. ISBN 978-0-929600-83-3.
- National Institute for Occupational Safety and Health. "NIOSH Pocket Guide to Chemical Hazards — Lead". www.cdc.gov. Retrieved 18 November 2016.
- Navas-Acien, A. (2007). "Lead Exposure and Cardiovascular Disease—A Systematic Review". Environmental Health Perspectives. 115 (3): 472–482. Bibcode:2007EnvHP.115..472N. doi:10.1289/ehp.9785. PMC 1849948. PMID 17431501.
- Neiburger, E.J. (April 2018). "X-Rays, Archaeology and the Chopsticks of Death". Central States Archaeological Journal. 65 (2): 70–74. JSTOR 44715698.
- Nikolayev, S., ed. (2012). "*lAudh-". Indo-European Etymology. Retrieved 21 August 2016.
- Norman, N. C. (1996). Periodicity and the s- and p-Block Elements. Oxford University Press. ISBN 978-0-19-855961-0.
- Nriagu, J. O. (1983). "Saturnine gout among Roman aristocrats — Did lead poisoning contribute to the fall of the Empire?". ژورنال پزشکی نیوانگلند. 308 (11): 660–63. doi:10.1056/NEJM198303173081123. PMID 6338384.
- Nriagu, J. O.; Kim, M-J. (2000). "Emissions of lead and zinc from candles with metal-core wicks". Science of the Total Environment. 250 (1–3): 37–41. Bibcode:2000ScTEn.250...37N. doi:10.1016/S0048-9697(00)00359-4. PMID 10811249.
- Occupational Safety and Health Administration. "Substance data sheet for occupational exposure to lead". www.osha.gov. Archived from the original on 16 March 2018. Retrieved 1 July 2017.
- Olinsky-Paul, T. (2013). "East Penn and Ecoult battery installation case study webinar" (PDF). Clean Energy States Alliance. Retrieved 28 February 2017.
- Palmieri, R., ed. (2006). The Organ. گروه تیلور و فرانسیس. ISBN 978-0-415-94174-7.
- "surma". Oxford English Dictionary (2nd ed.). Oxford University Press. 2009.
- Park, J. H.; Bolan, N.; Meghara, M.; et al. (2011). "Bacterial-assisted immobilization of lead in soils: Implications for remediation" (PDF). خاکشناسی: 162–74. Archived from the original (PDF) on 26 November 2015.
- Parker, R. B. (2005). The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books. ISBN 978-0-937822-89-0.
- Parthé, E. (1964). Crystal Chemistry of Tetrahedral Structures. CRC Press. ISBN 978-0-677-00700-7.
- Pauling, L. (1947). General Chemistry. W. H. Freeman and Company. ISBN 978-0-486-65622-9.
- Peneva, S. K.; Djuneva, K. D.; Tsukeva, E. A. (1981). "RHEED study of the initial stages of crystallization and oxidation of lead and tin". Journal of Crystal Growth. 53 (2): 382–396. Bibcode:1981JCrGr..53..382P. doi:10.1016/0022-0248(81)90088-9. ISSN 0022-0248.
- Petzel, S.; Juuti, M.; Sugimoto, Yu. (2004). "Environmental Stewardship with Regional Perspectives and Drivers of the Lead-free Issue". In Puttlitz, K. J.; Stalter, K. A. (eds.). Handbook of Lead-Free Solder Technology for Microelectronic Assemblies. CRC Press. ISBN 978-0-8247-5249-1.
- Polyanskiy, N. G. (1986). Fillipova, N. A (ed.). Аналитическая химия элементов: Свинец [Analytical Chemistry of the Elements: Lead] (به روسی). Nauka.
- Prasad, P. J. (2010). Conceptual Pharmacology. Universities Press. ISBN 978-81-7371-679-9. Retrieved 21 June 2012.
- "Primary Lead Refining Technical Notes". LDA International. Archived from the original on 22 March 2007. Retrieved 7 April 2007.
- Progressive Dynamics, Inc. "How Lead Acid Batteries Work: Battery Basics". progressivedyn.com. Archived from the original on 19 November 2018. Retrieved 3 July 2016.
- Putnam, B. (2003). The Sculptor's Way: A Guide to Modelling and Sculpture. انتشارات داور. ISBN 978-0-486-42313-5.
- Pyykkö, P. (1988). "Relativistic effects in structural chemistry". کمیکال ریویوز. 88 (3): 563–94. doi:10.1021/cr00085a006.
- Rabinowitz, M. B. (1995). "Imputing lead sources from blood lead isotope ratios". In Beard, M. E.; Allen Iske, S. D. (eds.). Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM. pp. 63–75. doi:10.1520/stp12967s. ISBN 978-0-8031-1884-3.
- "Radioactive Decay Series" (PDF). Nuclear Systematics. درسافزار باز امآیتی. 2012. Retrieved 28 April 2018.
- Ramage, C. K., ed. (1980). Lyman Cast Bullet Handbook (3rd ed.). Lyman Products Corporation.
- Randerson, J. (2002). "Candle pollution". نیو ساینتیست (2348). Retrieved 7 April 2007.
- Reddy, A.; Braun, C. L. (2010). "Lead and the Romans". مجله آموزش شیمی. 87 (10): 1052–55. Bibcode:2010JChEd..87.1052R. doi:10.1021/ed100631y.
- Renfrew, Daniel (2019). Life without lead: contamination, crisis, and hope in Uruguay. Oakland, California: University of California Press. ISBN 978-0-520-96824-0. OCLC 1102765674.
- Retief, F.; Cilliers, L. P. (2006). "Lead poisoning in ancient Rome". Acta Theologica. 26 (2): 147–64 (149–51). doi:10.4314/actat.v26i2.52570.
- Rich, V. (1994). The International Lead Trade. Woodhead Publishing. ISBN 978-0-85709-994-5.
- Rieuwerts, J. (2015). The Elements of Environmental Pollution. Routledge. ISBN 978-0-415-85919-6.
- Riva, M. A.; Lafranconi, A.; d'Orso, M. I.; et al. (2012). "Lead poisoning: Historical aspects of a paradigmatic "occupational and environmental disease"". Safety and Health at Work. 3 (1): 11–16. doi:10.5491/SHAW.2012.3.1.11. PMC 3430923. PMID 22953225.
- Roederer, I. U.; Kratz, K. -L.; Frebel, A.; et al. (2009). "The end of nucleosynthesis: Production of lead and thorium in the early galaxy". ژورنال اخترفیزیکی. 698 (2): 1963–80. arXiv:0904.3105. Bibcode:2009ApJ...698.1963R. doi:10.1088/0004-637X/698/2/1963. S2CID 14814446.
- Rogalski, A. (2010). Infrared Detectors (2nd ed.). CRC Press. ISBN 978-1-4200-7671-4. Retrieved 19 November 2016.
- Röhr, C. (2017). "Binare Zintl-Phasen" [Binary Zintl Phases]. Intermetallische Phasen [Intermettallic Phases] (به آلمانی). دانشگاه فریبورگ. Retrieved 18 February 2017.
- Rudolph, A. M.; Rudolph, C. D.; Hostetter, M. K.; et al. (2003). "Lead". Rudolph's Pediatrics (21st ed.). McGraw-Hill Professional. p. 369. ISBN 978-0-8385-8285-5.
- Samson, G. W. (1885). The divine law as to wines. J. B. Lippincott & Co.
- Scarborough, J. (1984). "The myth of lead poisoning among the Romans: An essay review". Journal of the History of Medicine and Allied Sciences. 39 (4): 469–475. doi:10.1093/jhmas/39.4.469. PMID 6389691.
- Schoch, R. M. (1996). Case Studies in Environmental Science. West Publishing. ISBN 978-0-314-20397-7.
- Schoeters, G.; Den Hond, E.; Dhooge, W.; et al. (2008). "Endocrine disruptors and abnormalities of pubertal development" (PDF). Basic & Clinical Pharmacology & Toxicology. 102 (2): 168–175. doi:10.1111/j.1742-7843.2007.00180.x. hdl:1854/LU-391408. PMID 18226071.
- Sharma, H. R.; Nozawa, K.; Smerdon, J. A.; et al. (2013). "Templated three-dimensional growth of quasicrystalline lead". نیچر کامیونیکیشنز. 4: 2715. Bibcode:2013NatCo...4.2715S. doi:10.1038/ncomms3715. PMID 24185350.
- Sharma, H. R.; Smerdon, J. A.; Nugent, P. J.; et al. (2014). "Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb". مجله شیمی فیزیک. 140 (17): 174710. Bibcode:2014JChPh.140q4710S. doi:10.1063/1.4873596. PMID 24811658.
- Silverman, M. S. (1966). "High-pressure (70-k) synthesis of new crystalline lead dichalcogenides". Inorganic Chemistry. 5 (11): 2067–69. doi:10.1021/ic50045a056.
- Singh, P. (2017). "Over 73% of paints found to have excessive lead: Study". تایمز هند. Retrieved 3 May 2018.
- Sinha, S. P.; Shelly; Sharma, V.; et al. (1993). "Neurotoxic effects of lead exposure among printing press workers". Bulletin of Environmental Contamination and Toxicology. 51 (4): 490–93. Bibcode:1993BuECT..51..490S. doi:10.1007/BF00192162. PMID 8400649. S2CID 26631583.
- Slater, J. C. (1964). "Atomic Radii in Crystals". مجله شیمی فیزیک. 41 (10): 3199–3204. Bibcode:1964JChPh..41.3199S. doi:10.1063/1.1725697. ISSN 0021-9606.
- Smirnov, A. Yu.; Borisevich, V. D.; Sulaberidze, A. (2012). "Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials". Theoretical Foundations of Chemical Engineering. 46 (4): 373–78. doi:10.1134/s0040579512040161. S2CID 98821122.
- Sokol, R. C. (2005). "Lead exposure and its effects on the reproductive system". In Golub, M. S. (ed.). Metals, Fertility, and Reproductive Toxicity. CRC Press. pp. 117–53. doi:10.1201/9781420023282.ch6 (inactive 1 November 2024). ISBN 978-0-415-70040-5.
{{cite book}}: CS1 maint: DOI inactive as of نوامبر 2024 (link) - Stabenow, F.; Saak, W.; Weidenbruch, M. (2003). "Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds". کمیکال کامیونیکیشنز (18): 2342–2343. doi:10.1039/B305217F. PMID 14518905.
- Stone, R. (1997). "An Element of Stability". ساینس (مجله). 278 (5338): 571–572. Bibcode:1997Sci...278..571S. doi:10.1126/science.278.5338.571. S2CID 117946028.
- Street, A.; Alexander, W. (1998). Metals in the Service of Man (11th ed.). پنگوئن بوکس. ISBN 978-0-14-025776-2.
- Szczepanowska, H. M. (2013). Conservation of Cultural Heritage: Key Principles and Approaches. Routledge. ISBN 978-0-415-67474-4.
- Takahashi, K.; Boyd, R. N.; Mathews, G. J.; et al. (1987). "Bound-state beta decay of highly ionized atoms" (PDF). Physical Review C. 36 (4): 1522–1528. Bibcode:1987PhRvC..36.1522T. doi:10.1103/physrevc.36.1522. OCLC 1639677. PMID 9954244. Archived from the original (PDF) on 21 October 2014. Retrieved 27 August 2013.
- Tarragó, A. (2012). "Case Studies in Environmental Medicine (CSEM) Lead Toxicity" (PDF). Agency for Toxic Substances and Disease Registry. Archived from the original (PDF) on 13 October 2022. Retrieved 25 February 2017.
- Tétreault, J.; Sirois, J.; Stamatopoulou, E. (1998). "Studies of lead corrosion in acetic acid environments". Studies in Conservation. 43 (1): 17–32. doi:10.2307/1506633. JSTOR 1506633.
- Theodore Low De Vinne (1899). The Practice of Typography: A Treatise on the Processes of Type-making, the Point System, the Names, Sizes, Styles, and Prices of Plain Printing Types. Century Company.
- "Think Lead research summary" (PDF). The Lead Sheet Association. Archived from the original (PDF) on 20 February 2017. Retrieved 20 February 2017.
- Thomson, T. (1830). The History of Chemistry. Henry Colburn and Richard Bentley (publishers). ISBN 978-0-405-06623-8.
- Thornton, I.; Rautiu, R.; Brush, S. M. (2001). Lead: The Facts (PDF). International Lead Association. ISBN 978-0-9542496-0-1. Archived from the original (PDF) on 26 July 2020. Retrieved 5 February 2017.
- Thürmer, K.; Williams, E.; Reutt-Robey, J. (2002). "Autocatalytic oxidation of lead crystallite surfaces". Science. 297 (5589): 2033–35. Bibcode:2002Sci...297.2033T. doi:10.1126/science.297.5589.2033. PMID 12242437. S2CID 6166273.
- Tolliday, B. (2014). "Significant growth in lead usage underlines its importance to the global economy". International Lead Association. Archived from the original on 28 February 2017. Retrieved 28 February 2017.
Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead–acid batteries
- "Toronto museum explores history of contraceptives". ABC News. 2003. Retrieved 13 February 2016.
- "Toxic Substances Portal – Lead". Agency for Toxic Substances and Disease Registry. Archived from the original on 6 June 2011.
- "Toxicological Profile for Lead" (PDF). Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine. 2007. Archived from the original (PDF) on 1 July 2017.
- "Trace element emission from coal". IEA Clean Coal Centre. 2012. Archived from the original on 11 March 2020. Retrieved 1 March 2017.
- Tuček, K.; Carlsson, J.; Wider, H. (2006). "Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues" (PDF). Nuclear Engineering and Design. 236 (14–16): 1589–98. Bibcode:2006NuEnD.236.1589T. doi:10.1016/j.nucengdes.2006.04.019.
- Tungate, M. (2011). Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers. ISBN 978-0-7494-6182-9.
- UK Marine SACs Project (1999). "Lead". Water Quality (Report). Archived from the original on 17 February 2020. Retrieved 10 June 2018.
- United Nations Environment Programme (2010). Final review of scientific information on lead (PDF). Chemicals Branch, Division of Technology, Industry and Economics. Retrieved 31 January 2017.
- United States Environmental Protection Agency (2010). "Metallurgical Industry:Secondary Lead Processing". AP 42 Compilation of Air Pollutant Emission Factors (5th ed.). Retrieved 20 May 2018.
- United States Environmental Protection Agency (2000). "Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000)". Retrieved 28 February 2017.
- United States Environmental Protection Agency (2005). "Best Management Practices for Lead at Outdoor Shooting Ranges" (PDF). Retrieved 12 June 2018.
- سازمان غذا و دارو (آمریکا) (2015). Q3D Elemental Impurities Guidance for Industry (PDF) (Report). وزارت بهداشت و خدمات انسانی ایالات متحده آمریکا. p. 41. Retrieved 15 February 2017.
- United States Geological Survey (1973). Geological Survey Professional Paper. دفتر چاپ دولت ایالات متحده آمریکا. p. 314.
- United States Geological Survey (2005). Lead (PDF) (Report). Retrieved 20 February 2016.
- United States Geological Survey (2017). "Lead" (PDF). Mineral Commodities Summaries. Retrieved 8 May 2017.
- دانشگاه کالیفرنیا (برکلی) Nuclear Forensic Search Project. "Decay Chains". Nuclear Forensics: A Scientific Search Problem. Retrieved 23 November 2015.
- Vasmer, M. (1986–1987) [1950–1958]. Trubachyov, O. N.; Larin, B. O. (eds.). Этимологический словарь русского языка [Russisches etymologisches Worterbuch] (به روسی) (2nd ed.). Progress. Retrieved 4 March 2017.
- Vogel, N. A.; Achilles, R. (2013). The Preservation and Repair of Historic Stained and Leaded Glass (PDF) (Report). وزارت کشور ایالات متحده آمریکا. Retrieved 30 October 2016.
- Waldron, H. A. (1985). "Lead and lead poisoning in antiquity". Medical History. 29 (1): 107–08. doi:10.1017/S0025727300043878. PMC 1139494.
- Wani, A. L.; Ara, A.; Usman, J. A. (2015). "Lead toxicity: A review". Interdisciplinary Toxicology. 8 (2): 55–64. doi:10.1515/intox-2015-0009. PMC 4961898. PMID 27486361.
- Weast, R. C.; Astle, M. J.; Beyer, W. H. (1983). CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press. ISBN 978-0-8493-0464-4.
- "Weatherings to Parapets and Cornices". The Lead Sheet Association. Archived from the original on 20 February 2017. Retrieved 20 February 2017.
- Webb, G. A. (2000). Nuclear Magnetic Resonance. Royal Society of Chemistry. ISBN 978-0-85404-327-9.
- Webb, G. W.; Marsiglio, F.; Hirsch, J. E. (2015). "Superconductivity in the elements, alloys and simple compounds". Physica C: Superconductivity and Its Applications. 514: 17–27. arXiv:1502.04724. Bibcode:2015PhyC..514...17W. doi:10.1016/j.physc.2015.02.037. S2CID 119290828.
- Whitten, K. W.; Gailey, K. D.; David, R. E. (1996). General chemistry with qualitative analysis (3rd ed.). Saunders College. ISBN 978-0-03-012864-6.
- Wiberg, E.; Wiberg, N.; Holleman, A. F. (2001). Inorganic Chemistry. آکادمیک پرس. ISBN 978-0-12-352651-9.
- Wilkes, C. E.; Summers, J. W.; Daniels, C. A.; et al. (2005). PVC Handbook. Hanser. ISBN 978-1-56990-379-7.
- Willey, D. G. (1999). "The physics behind four amazing demonstrations — CSI". محقق شکاک. 23 (6). Retrieved 6 September 2016.
- Winder, C. (1993a). "The history of lead — Part 1". LEAD Action News. 2 (1). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 5 February 2016.
- Winder, C. (1993b). "The history of lead — Part 3". LEAD Action News. 2 (3). ISSN 1324-6011. Archived from the original on 31 August 2007. Retrieved 12 February 2016.
- Windholz, M. (1976). Merck Index of Chemicals and Drugs (9th ed.). مرک اند کو. ISBN 978-0-911910-26-1. Monograph 8393.
- Wood, J. R.; Hsu, Y-T.; Bell, C. (2021). "Sending Laurion Back to the Future: Bronze Age Silver and the Source of Confusion" (PDF). Internet Archaeology. 56 (9). doi:10.11141/ia.56.9. S2CID 236973111.
- سازمان جهانی بهداشت (1995). Environmental Health Criteria 165: Inorganic Lead (Report). Retrieved 10 June 2018.
- World Health Organization (2000). "Lead" (PDF). Air quality guidelines for Europe. Regional Office for Europe. pp. 149–53. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Health Organization (2018). "Lead poisoning and health" (به انگلیسی). Retrieved 17 February 2019.
- World Nuclear Association (2015). "Nuclear Radiation and Health Effects". Archived from the original on 24 December 2015. Retrieved 12 November 2015.
- Wrackmeyer, B.; Horchler, K. (1990). "207Pb-NMR Parameters". Annual Reports on NMR Spectroscopy. Vol. 22. Academic Press. pp. 249–303. doi:10.1016/S0066-4103(08)60257-4. ISBN 978-0-08-058405-8.
- Yong, L.; Hoffmann, S. D.; Fässler, T. F. (2006). "A low-dimensional arrangement of [Pb9]4· clusters in [K(18-crown-6)]2K2Pb9·(en)1.5". Inorganica Chimica Acta. 359 (15): 4774–78. doi:10.1016/j.ica.2006.04.017.
- Young, S. (2012). "Battling lead contamination, one fish bone at a time". Compass. گارد ساحلی ایالات متحده آمریکا. Archived from the original on 14 June 2013. Retrieved 11 February 2017.
- Yu, L.; Yu, H. (2004). Chinese Coins: Money in History and Society. Long River Press. ISBN 978-1-59265-017-0.
- Zhang, X.; Yang, L.; Li, Y.; et al. (2012). "Impacts of lead/zinc mining and smelting on the environment and human health in China". ارزیابی و پایش زیستمحیطی. 184 (4): 2261–73. Bibcode:2012EMnAs.184.2261Z. doi:10.1007/s10661-011-2115-6. PMID 21573711. S2CID 20372810.
- Zhao, F. (2008). Information Technology Entrepreneurship and Innovation. IGI Global. p. 440. ISBN 978-1-59904-902-1.
- Zuckerman, J. J.; Hagen, A. P. (1989). Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons. ISBN 978-0-471-18656-4.
- Zweifel, H. (2009). Plastics Additives Handbook. Hanser. ISBN 978-3-446-40801-2.
- Zýka, J. (1966). "Analytical study of the basic properties of lead tetraacetate as oxidizing agent". شیمی محض و کاربردی (نشریه). 13 (4): 569–81. doi:10.1351/pac196613040569. S2CID 96821219.
برای مطالعهٔ بیشتر
[ویرایش]- Astrid, S.; Helmut, S.; Sigel, R. K. O., eds. (2017). Lead: Its Effects on Environment and Health. Metal Ions in Life Sciences. Vol. 17. De Gruyter. ISBN 978-3-11-044107-9. Table of contents
- Casas, J. S.; Sordo, J., eds. (2006). Lead Chemistry, Analytical Aspects. Environmental Impacts and Health Effects. Elsevier. ISBN 978-0-444-52945-9.
- Hunt, A.; Abraham, J. L.; Judson, B.; Berry, C. L. (2003). "Toxicologic and epidemiologic clues from the characterization of the 1952 London smog fine particulate matter in archival autopsy lung tissues". Environmental Health Perspectives. 111 (9): 1209–1214. Bibcode:2003EnvHP.111.1209H. doi:10.1289/ehp.6114. PMC 1241576. PMID 12842775.
- Ingalls, Walter Renton (1865-), Lead Smelting and Refining, With Some Notes on Lead Mining
- Zhang, Hao; Wei, Kai; Zhang, Mengyu; Liu, Rutao; Chen, Yadong (2014). "Assessing the mechanism of DNA damage induced by lead through direct and indirect interactions". Journal of Photochemistry and Photobiology B: Biology. 136: 46–53. Bibcode:2014JPPB..136...46Z. doi:10.1016/j.jphotobiol.2014.04.020. PMID 24844619.
پیوند به بیرون
[ویرایش]- The Toxicology of Heavy Metals: Getting the Lead Out, American Society for Clinical Pathology
- COVID-19 to reduce global lead production by 5,2% in 2020 (with a figure showing global lead production, 2010–2024)
| جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


