اورانیوم
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اورانیوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| تلفظ | /jʊəˈreɪniəm/ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظاهر | silvery gray metallic; corrodes to a spalling black oxide coat in air | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| جرم اتمی استاندارد (Ar، استاندارد) | ۲۳۸٫۰۲۸۹۱(۳)[۱] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| اورانیوم در جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اتمی (Z) | 92 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| گروه | n/a | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دوره | دوره ۷ | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| بلوک | بلوک-f | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دسته | Actinide | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آرایش الکترونی | [Rn] 5f3 6d1 7s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ۲, ۸, ۱۸, ۳۲, ۲۱, ۹, ۲ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای فیزیکی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| فاز در STP | جامد | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه ذوب | 1405.3 K (1132.2 °C, 2070 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نقطه جوش | 4404 K (4131 °C, 7468 °F) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| چگالی (near r.t.) | 19.1 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| در حالت مایع (at m.p.) | 17.3 g/cm3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| حرارت همجوشی | 9.14 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| آنتالپی تبخیر | 417.1 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ظرفیت حرارتی مولی | 27.665 J/(mol·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
فشار بخار
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ویژگیهای اتمی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| عدد اکسایش | +1, +2, +3,[۲] +4, +5, +6 (a weakly basic اکسید) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| الکترونگاتیوی | مقیاس پائولینگ: 1.38 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انرژی یونش | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع اتمی | empirical: 156 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع کووالانسی | pm 196±7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شعاع واندروالسی | 186 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| دیگر ویژگی ها | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ساختار بلوری | دستگاه بلوری راستلوزی | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سرعت صوت thin rod | 3155 m/s (at 20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انبساط حرارتی | 13.9 µm/(m·K) (at 25 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانندگی گرمایی | 27.5 W/(m·K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش الکتریکی | 0.280 µΩ·m (at 0 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| رسانش مغناطیسی | پارامغناطیس | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول یانگ | 208 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول برشی | 111 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| مدول حجمی | 100 GPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نسبت پواسون | 0.23 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی ویکرز | 1960–2500 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| سختی برینل | 2350–3850 MPa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| شماره ثبت سیایاس | 7440-61-1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| تاریخچه | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| نامگذاری | after planet اورانوس، itself named after Greek god of the sky اورانوس (اسطوره) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| کشف | مارتین هاینریش کلاپروت (1789) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| انزوا اول | Eugène-Melchior Péligot (1841) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ایزوتوپهای اورانیوم | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
اورانیوم (به انگلیسی: Uranium) یکی از عنصرهای شیمیایی است که عدد اتمی آن ۹۲ و نشانه آن U است. اورانیوم شناخته شدهترین فلز پرتوزایی است، که یکی از ایزوتوپهای آن در تهیه سوخت در نیروگاههای اتمی استفاده میشود. اورانیوم فلزی نقرهای-خاکستری رنگ است که جزئی از خانواده آکتینیدها محسوب میشود. یک اتم اورانیوم دارای ۹۲ پروتون و ۹۲ الکترون است که شش مورد از این الکترونها، بهعنوان الکترون ظرفیت درنظر گرفته میشوند. چون ایزوتوپهای اورانیوم ناپایدار هستند، بهطوری که نیمهعمر ایزوتوپهای طبیعی آن بین ۱۵۹۲۰۰ سال تا ۴٫۵ میلیارد سال است، این عنصر دارای خصلت ضعیف رادیواکتیو است. متداولترین ایزوتوپهای اورانیوم طبیعی، اورانیم-۲۳۸ (دارای ۱۴۶ نوترون و تشکیل دهنده بیش از ۹۹ درصد از اورانیوم موجود روی زمین) و اورانیوم-۲۳۵ (دارای ۱۴۳ نوترون و تشکیل دهنده حدود ۰٫۷۲ درصد از اورانیوم موجود روی زمین) هستند. اورانیوم در میان نوکلیدهای دیرینه دارای بالاترین جرم اتمی است. چگالی اورانیوم در حدود ۷۰ درصد چگالی سرب و کمی کمتر از طلا یا تنگستن است. اورانیوم بهصورت طبیعی و در مقادیر بسیار کم در حدود چند قسمت در میلیون (ppm) در خاک، سنگها و آب وجود دارد ولی بهصورت تجاری از کانیهای معدنی مانند اورانینیت استخراج میشود.[۳]
در طبیعت، اورانیوم بهصورت اورانیوم-۲۳۸ (فراوانی ۹۹٫۲۷۵۲–۹۹٫۲۷۳۹ درصد) و اورانیوم-۲۳۵ (فراوانی ۰٫۷۲۰۲–۰٫۷۱۹۸ درصد) و همچنین در مقادیر بسیار اندک بهشکل اورانیوم-۲۳۴ (فراوانی ۰٫۰۰۵۹–۰٫۰۰۵۰ درصد) یافت میشود.[۴] اورانیوم با انتشار ذره آلفا، به آرامی دچار واپاشی هستهای میشود. نیمهعمر اورانیوم-۲۳۸ حدود ۴٫۴۷ میلیارد سال و نیمهعمر اورانیوم-۲۳۵ برابر ۷۰۴ میلیون سال است که این موضوع موجب میشود از این عناصر در تعیین عمرسنجی زمین استفاده شوند.[۵]
بسیاری از کاربردهای امروزی اورانیوم، در خواص منحصر بهفرد هستهای آن خلاصه میشود. اورانیوم-۲۳۵ تنها عنصر طبیعی موجود است که دارای ایزوتوپهای شکافتپذیر است که این خصلت موجب میشود از آن بهصورت گسترده در نیروگاه هستهای و سلاحهای هستهای استفاده شود. با اینحال، بهعلت اینکه مقادیر ناچیزی از آن در طبیعت یافت میشود، نیاز است که تحت فرایندی موسوم به غنیسازی اورانیوم غنا و غلظت آن برای استفاده در نیروگاههای هستهای، افزایش داده شود. امکان شکافتن اورانیوم-۲۳۸ توسط نوترونهای پرسرعت وجود دارد و همچنین این ایزوتوپ اصطلاحاً ماده بارور خوانده میشود، به این معنی که توانایی تبدیل شدن به ایزوتوپ پلوتونیوم-۲۳۹ شکافتپذیر در یک رآکتور هستهای را دارد. ایزوتوپ شکافتپذیر دیگر اورانیوم، ایزوتوپ اورانیوم-۲۳۳ است که امکان تولید آن با استفاده از توریم طبیعی وجود دارد و در صنعت هستهای دارای اهمیت است. اورانیوم-۲۳۸ دارای سطح مقطع شکاف بالاتری برای نوترونهای با سرعت آهسته است. در غلظتهای کافی، این ایزوتوپها موجود شکلگیری و حفظ یک واکنش زنجیرهای هستهای میشوند. این واکنشها موجب ایجاد گرما در رآکتورهای هستهای و مواد شکافتپذیر برای سلاحهای هستهای میشوند.[۶] اورانیوم ضعیفشده (۲۳۸U) در تولید نفوذ کننده انرژی جنبشی[a] و وسایل نقلیه زرهپوش استفاده میشود. اورانیوم بهعنوان خنککننده در شیشههای اورانیومی استفاده میشود که منجر به ایجاد رنگی رزد تا سبز در آنها میشود. شیشه اورانیومی در نور فرابنفش، با انجام فلورسنس، تولید نور سبز رنگ مینماید. همچنین قبلاً، از اورانیوم برای ایجاد سایه و تهرنگ در عکاسی استفاده شدهاست.
کشف اورانیوم در سنگهای معدن اورانینیت در سال ۱۷۸۹ به مارتین هاینریش کلاپروت نسبت داده میشود، فردی که نام این عنصر را از نام سیاره اورانوس که در آن زمان به تازگی کشف شده بود، انتخاب کرد. یوجین-میشل پلیگات اولین کسی بود که موفق به جداسازی اورانیوم فلزی در سال ۱۸۴۱ شد و چندی بعد در سال ۱۸۹۶، خواص پرتوزایی آن نیز توسط هانری بکرل کشف شد. تحقیقات انجام شده توسط اتو هان، لیزه مایتنر، انریکو فرمی و سایرین مانند رابرت اوپنهایمر که در سال ۱۹۳۴ آغاز گردید، منجر به تولید سوخت مورد استفاده در رآکتورهای هستهای و در نهایت بمب هستهای پسر کوچک شد، بمبی که از آن بهعنوان اولین سلاح هستهای استفاده شده در جنگ یاد میشود. در ادامه و در طول جنگ سرد میان ایالات متحده آمریکا و شوروی موجب تولید دهها هزار سلاح هستهای شد که از اورانیوم فلزی و پلوتونیوم-۲۳۹ بهدست آمده از اورانیوم ساخته شده بودند. پس از فروپاشی اتحاد جماهیر شوروی در سال ۱۹۹۱، ایمنی این سلاحهای تولیدی و مواد قابل شکافت موجود در آنها، تبدیل به یک معضل ایمنی و سلامت عمومی شد.[۷] در همین زمان، توسعه و تولید رآکتورهای هستهای در مقیاس جهانی در حال انجام بودهاست. امروزه بهاین علت که نیروگاههای هستهای منبعی قدرتمند برای تولید انرژی عاری از کربن دیاکسید هستند، تقاضا برای ساخت آنها دارای روند روبه رشدی است. در سال ۲۰۱۹، تعداد ۴۴۰ رآکتور هستهای بیش از ۲۵۶۰ تراوات کیلو ساعت (TWh) الکتریسیته عاری از کربن دیاکسید تولید کردهاند. (مقداری بیشتر از مجموع الکتریسیتهٔ تولیدی توسط نیروگاههای بادی و خورشیدی).[۸]
تاریخچه
[ویرایش]استفاده قبل از کشف
[ویرایش]استفاده از ترکیبات اورانیوم توسط انسان عمری طولانی دارد، بهطوری که قدمت استفاده از اورانیوم اکسید برای ایجاد رنگ زرد در لعاب سرامیکها به ۷۹ سال قبل از میلاد بازمیگردد. شیشههای زرد حاوی یک درصد اورانیوم اکسید، توسط آر.تی. گانتر[b] از دانشگاه آکسفورد در یک ویلای مربوط به دوران روم باستان در دماغه پوسیلیپو[c] در خلیج ناپل کشور ایتالیا پیدا شد. از اواخر قرون وسطی، کمکم استخراج سنگ معدن اورانیوم از معادن نقره هاسبورگ[d] در یاخیموو واقع در بوهم (در جمهوری چک امروزی)، آغاز و استفاده از آن برای رنگآمیزی در محصولات شیشهای رواج یافت. در اوایل قرن نوزدهم میلادی، تنها معدن شناخته شده اورانیوم در سراسر دنیا، همین معادن بودند.
کشف
[ویرایش]
کشف اورانیوم به شیمیدانی آلمانی بهنام مارتین هاینریش کلاپروت نسبت داده میشود. زمانیکه مشغول کار کردن در آزمایشگاه خود در برلین در سال ۱۷۸۹ بود، او موفق به رسوبدادن ترکیبی زرد رنگ (احتمالاً سدیم دیواورانات (Na۲U۲O۷·۶H۲O)) با کمک حل کردن سنگ معدن اورانینیت در اسید نیتریک و سپس خنثی کردن محلول حاصل با کمک سدیم هیدروکسید شد.[۹] کلاپروت گمان کرد که این ماده حاصل، اکسید عنصری است که هنوز کشف نشدهاست و از همین رو آن را با کمک زغال حرارت داد تا پودری سیاه رنگ تولید شود که او تصور میکرد شکل فلزی عنصر مورد نظر است (در حقیقت، این پودر سیاه رنگ اورانیوم اکسید بود)[۹][۱۰] او نام عنصر تازه کشف شده را بهخاطر نام سیاره اورانوس (نامی برگرفته از ایزد آسمان در یونان باستان)، که هشت سال قبل توسط ویلیام هرشل کشف شده بود، اورانیوم نامید.[۱۱]
در سال ۱۸۴۱، یوجین-میشل پلیگات، استاد شیمی تجزیه در هنرستان ملی هنر و صنایع دستی در پاریس،[e] نخستین نمونه فلز اورانیوم را باکمک حرارت دادن اورانیوم تتراکلرید با پتاسیم تهیه کرد.[۹][۱۲]
هانری بکرل در سال ۱۸۹۶ خواص پرتوزایی اورانیوم را کشف کرد. بکرل این کشف را در پاریس و زمانی که انجام داد که نمونهای از نمک پتاسیم اورانیل سولفات (K۲UO۲(SO۴)۲) را روی یک صفحه عکاسی نپوشیده در کشوی کارش قرار داده بود و متوجه شد که این موضوع باعث ایجاد حالتی مهآلود، برروی صفحه عکاسی شدهاست.[۱۳] او به این نتیجه رسید که نوعی پرتوی نوری نامرئی یا نوعی اشعه که از اورانیوم ساطع شدهاست، عامل ماجرا است.
در طول جنگ جهانی اول، زمانی که دول محور از کمبود مولیبدن برای تولید لوله تفنگ و ابزار فولادی دارای سرعت بالا رنج میبردند، از جایگزین آلیاژ فرواورانیوم[f] که از لحاظ فیزیکی دارای خواص مشابه بسیاری است، استفاده کردند. موقعیکه این کار معروف شد، دولت ایالات متحده از چند دانشگاه برجسته خواست تا در مورد کاربردهای اورانیوم به پژوهش بپردازند. ابزار وسایلی که در نتیجه این پژوهشها تولید شد تا چندین دهه ادامه داشت و تنها در زمان شروع پروژه منهتن و دوران جنگ سرد که نیاز مبرمی به تحقیقات شکافت اتمی و توسعه تسلیحات وجود داشت، خاتمه یافت.[۱۴][۱۵][۱۶]
تحقیقات شکافت
[ویرایش]در سال ۱۹۳۴، گروهی پژوهشی به سرپرستی انریکو فرمی، مشاهده کرد که بمباران ذرات اورانیوم با نوترونها باعث نشر پرتوهای بتا میشود. (الکترونها یا پوزیترونها از عناصر تولید شده، به ذرات بتا رجوع شود) محصولاتی که از این شکافت هسته ای تولید میشدند در ابتدا با عناصر جدیدی که قرار بود با عدد اتمی ۹۳ و ۹۴ شناخته شوند، اشتباه گرفته شدند، که در ابتدا، رئیس دانشکده رم، اورسو ماریو کوربینو، آنها را آسونیوم و هسپریوم نام گذاری کرد. آزمایشها در آزمایشگاه هان در برلین توسط اتو هان و فریتس اشتراسمان باعث کشف قابلیت شکافت اورانیوم به عناصر سبکتر و آزاد شدن انرژی بستگی گردید. لیس مایتنر و خواهرزاده اش، فیزیکدان، اوتو رابرت فریش، توضیحی برای دلیل فیزیکی وقوع این پدیده را در فوریه ۱۹۳۹ پیدا کردند و این پدیده را شکافت هسته ای نامیدند. کمی بعد فرمی فرضیه ای را ارائه کرد که شکافت اورانیوم میتواند باعث تولید مقادیر کافی نوترون جهت انجام واکنش شکافت شود. اثبات این فرضیه کمی بعد در همان سال انجام شد، و تحقیقات نشان دادند که بهطور متوسط ۲/۵ نوترون از واکنش شکافت ایزوتوپ کمیاب اورانیوم-۲۳۵ آزاد میشود. فرمی از آلفرد او. سی نیر درخواست کرد تا ایزوتوپهای اورانیوم را، برای پیدا کردن اتم شکاف پذیر جدا کند، در ۲۹ فوریه ۱۹۴۰ نیر ابزاری را که در دانشگاه مینسوتا ساخته بود را برای جداسازی اولین نمونه اورانیوم-۲۳۵، را در آزمایشگاه تات استفاده کرد. بعد از این که این نمونه برای استفاده در شتابدهنده حلقوی دانشگاه کلمبیا فرستاده شد، جان دانینگ، شکاف پذیر بودن این ماده را در اول مارس همان سال تأیید کرد. با تحقیقات بیشتر، مشخص شد که ایزوتوپ نه چندان کمیاب اورانیوم-۲۳۸ میتواند به پلوتونیوم تبدیل بشود و مانند اورانیوم-۲۳۵، میتواند توسط نوترونهایی با دمای بالا شکافته شود. این یافتهها، باعث شدند که چندین کشور در سراسر جهان، تولید انرژی هستهای و سلاحهای اتمی را آغاز کنند. در ۲ دسامبر ۱۹۴۲، به عنوان بخشی از پروژه منهتن، تیم دیگری به رهبری انریکو فرمی، موفق شد که اولین واکنش زنجیرهای هستهای مصنوعی را تحت عنوان شیکاگو پایل-۱ آغاز کند.[۱۷] نقشه اولیه ای که اورانیوم-۲۳۵ غنی شده را به عنوان شروع کننده واکنش استفاده میکرد، به دلیل کمیت پایین اورانیوم بهدست آمده از غنی سازی رها شد. تیمی که در آزمایشگاه استگفیلد دانشگاه شیکاگو کار میکرد، موفق شد که شرایط بهوجود آمدن واکنشی شبیه به این را با کنار هم جمع کردن ۳۶۰ تن گرافیت، ۵۳ تن اورانیوم اکسید و ۵٫۵ تن فلز اورانیوم، که توسط کارخانه ساخت لامپ وستینگهاوس، در پروسه ای موقتی، تهیه شده بود، درست کند.[۱۸]
تسلیحات هستهای
[ویرایش]دو گونه بمب هسته ای توسط آمریکا در طول جنگ جهانی دوم ساخته شدند: اولی، یک دستگاه اورانیومی با کد رمز پسر کوچک که ماده شکافت پذیر آن، اورانیوم بسیار غنی شده بود و دومی، یک دستگاه پلوتونیومی (به آزمایش ترینیتی و مرد چاق رجوع شود) که پلوتونیوم آن از اورانیوم-۲۳۸ تهیه شده بود. بمب «پسربچه» که مبنای اورانیومی داشت، اولین سلاح هسته ای استفاده شده در جنگ بود که بر فراز شهر هیروشیما در کشور ژاپن، در ششم اوت ۱۹۴۵ منفجر شد. با نیرویی که تقریباً با ۱۲۵۰۰ تن تیانتی برابری میکرد و با موج انفجار و حرارتی که تقریباً ۵۰۰۰۰ ساختمان را نابود و ۷۵۰۰۰ نفر را کشت. (به بمباران اتمی هیروشیما و ناگاساکی رجوع شود)
رآکتورها
[ویرایش]رآکتور گرافیت ایکس-۱۰ در آزمایشگاه ملی اوک ریج در شهر اوک ریج، تنسی که قبلاً به نام کلینتون پایل و پایل ایکس ده شناخته میشد، دومین رآکتور مصنوعی اتمی جهان بود (بعد از شیکاگو پایل انریکو فرمی) و اولین رآکتور طراحی و ساخته شده برای بهرهبرداری پیوسته بود. رآکتور مولد آزمایشی آزمایشگاه ملی آرگون شماره یک، که در ایستگاه آزمایش رآکتور ملی کمیسیون انرژی اتمی در نزدیکی آرکو، آیداهو واقع شدهاست؛ اولین رآکتور هسته ای است که موفق به تولید برق در ۲۰ دسامبر ۱۹۵۱ شد. در ابتدا، چهار لامپ ۱۵۰ واتی توسط این رآکتور روشن شدند، در ادامه، بهبودهایی که به بهینگی این رآکتور داده شد توانست کل این مجموعه را برق رسانی کند (بعدها، آرکو اولین شهری شد که تمام انرژی اش را از یک نیروگاه هسته ای بگیرد، برای تولید برق این شهر از رآکتور بوراکس سوم استفاده شد، که توسط آزمایشگاه ملی آرگون طراحی و اداره میشد. اولین رآکتور هسته ای ای که در ابعاد تجاری ساخته شد، اوبنینسک در شوروی بود، که تولید خود را با رآکتور ای ام-۱ را در ۲۷ ژوئن ۱۹۵۴ شروع کرد. از اولین رآکتورهای انرژی هسته ای، همچنین میتوان به کالدر هال در انگلستان، که تولید خود را در ۱۷ اکتبر ۱۹۵۶، و ایستگاه نیروی اتمی شیپینگپورت در ایالت پنسیلوانیای آمریکا، که در بیست و ششم ماه مه سال ۱۹۵۸ تولید خودش را شروع کرد اشاره کرد. انرژی اتمی برای اولین بار به عنوان نیروی محرک زیردریایی یواساس ناتیلوس آمریکا در سال ۱۹۵۴ استفاده شد.
شکافت طبیعی ماقبل تاریخ
[ویرایش]در سال ۱۹۷۲، فیزیکدان فرانسوی، فرانسیس پرن پانزده رآکتور هسته ای طبیعی باستانی از کار افتاده را در سه نقطه ته نشست فلز در معدن اوکلو در کشور گابن واقع در غرب آفریقا پیدا کرد؛ که این یافتهها در مجموع به عنوان رآکتورهای فسیل اوکلو شناخته میشوند. این نقطه ته نشست تقریباً ۱٫۷ میلیارد سال عمر دارد و اورانیوم-۲۳۵ آن تقریباً ۳ درصد اورانیوم موجود در جهان را تشکیل میدهد. این مقدار به قدری کافی است که اجازه رخ دادن واکنش زنجیره ای شکافت پایدار را بدهد، اگر شرایط آن فراهم باشد. ظرفیت رسوب اطراف این ته نشست، که محصولات هسته ای را در خود جای میدهد، توسط دولت آمریکا، مدرکی برای امکان نگهداری سوخت هسته ای مصرف شده در انبار ضایعات اتمی کوه یوکا شناخته شد.
آلودگی و میراث جنگ سرد
[ویرایش]آزمایش سلاحهای هستهای که توسط شوروی و آمریکا در دهه ۱۹۵۰ و اوایل ۱۹۶۰ و توسط فرانسه در دهههای ۱۹۷۰ و ۱۹۸۰ صورت گرفت، مقدار زیادی بارش هستهای، ناشی از ایزوتوپهای محصول واپاشی را در سراسر جهان پخش کردهاست. همچنین مقدار زیادی باران و زبالههای رادیو اکتیو از حوادث اتفاق افتاده در نیروگاهها پخش شد. معدنکاوهای اورانیوم، ریسک بیشتری برای ابتلا به سرطان دارند. برای مثال، موارد متعددی از سرطان ریه در معدنکاوهای ناواهو ثبت شدهاست و ارتباط این سرطان با شغل آنها تأیید شدهاست. در مصوبه «جبران خسارت در معرض تشعشع قرار گرفتن» سال ۱۹۹۰ آمریکا، از کارگزاران درخواست شد که صد هزار دلار در صورت تشخیص سرطان به معدنکاوهای اورانیوم پرداخت شود. در جنگ سرد میان آمریکا و شوروی، انباشتههای بزرگی از اورانیوم برای استفاده فشرده شدند و دهها هزار سلاح هسته ای بهوسیله اورانیوم غنی شده و پلوتونیوم ساخته شده از اورانیوم تولید شدهاند. از زمان تجزیه شوروی در سال ۱۹۹۱، در روسیه و چندین ایالت مختلف شوروی سابق، ۵۴۰ تن اورانیوم بسیار غنی شده (که برای ساخت چهل هزار کلاهک هسته ای کافی است) در انبارهایی که بعضی از اوقات حتی از محافظت کافی برخوردار نیستند، یافت شدهاست. پلیس و سازمانهای امنیت ملی مختلف در آسیا، اروپا و آمریکای جنوبی حداقل شانزده واقعه از ۱۹۹۳ تا ۲۰۰۵ از حمل و نقل اورانیوم و پلوتونیوم قاچاق و قابل استفاده برای بمب پیدا کردهاند، که منبع بیشتر آنها کشوری از شوروی سابق بودهاست. از سال ۱۹۹۳ تا ۲۰۰۵، برنامه محافظت، کنترل و حسابداری ماده در آمریکا، تقریباً ۵۵۰ میلیون دلار به دولت روسیه کمک کرد تا از انبارهای اورانیوم و پلوتونیوم محافظت نشده در این کشور محافظت کند. این پول برای بهبود امنیت در سازمانهای تحقیق و نگه داری خرج شد. مجله Scientific American در فوریه ۲۰۰۶، گزارش کرد که هنوز برای محافظت از بعضی از این سازمانها، از حصارهای فلزی ای استفاده میشود که در وضعیتی هستند که نیاز به تعمیر اساسی دارند. به نقل از یکی از مصاحبهها در این مقاله، یکی از این سازمانها، قبل از پروژه بهبود سازی امنیت، اورانیم غنی شده درجه یک را در گنجه ای برای نگه داری وسایل تمیز کاری نگه داری میکرد. یکی دیگر از این سازمانها، برای شمارش و حسابداری مقدار کلاهکهای هسته ای موجود در این سازمانها، از کاغذهای نوت برداری در یک جعبه کفش استفاده میکرد.[۱۹]
ویژگیها
[ویرایش]
اورانیوم یک فلز نقرهای-سفید و بهطور ضعیف رادیواکتیو است. این عنصر دارای سختی عناصر (صفحه اطلاعات) برابر با ۶ است، که برای ایجاد خراش روی شیشه کافی بوده و تقریباً معادل با سختی تیتانیم، رودیم، منگنز و نیوبیم است. این عنصر شکلپذیری و چکشخواری دارد، اندکی پارامغناطیس است، بهشدت الکترونگاتیوی دارد و رسانایی الکتریکی ضعیفی دارد.[۲۰][۲۱] فلز اورانیوم دارای چگالی بسیار بالایی برابر با ۱۹٫۱ گرم بر سانتیمتر۳ است،[۲۲] که از سرب (۱۱٫۳ گرم بر سانتیمتر۳)[۲۳] چگالتر اما اندکی کمچگالتر از تنگستن و طلا (۱۹٫۳ گرم بر سانتیمتر۳) است.[۲۴][۲۵]
فلز اورانیوم تقریباً با تمام عناصر نافلزی (بهجز گاز نجیبها) و ترکیب شیمیایی آنها واکنش نشان میدهد و واکنشپذیری آن با افزایش دما افزایش مییابد.[۲۶] هیدروکلریک اسید و نیتریک اسید اورانیوم را حل میکنند، اما اسیدهای غیراکسیدکننده (بهجز اسید هیدروکلریک) تنها بهطور بسیار کند بر آن تأثیر میگذارند.[۲۰] هنگامی که بهصورت پودر ریز باشد، میتواند با آب سرد واکنش دهد؛ در هوا، سطح فلز اورانیوم با لایهای تیره از اکسید اورانیوم پوشیده میشود.[۲۱] اورانیوم موجود در سنگ معدن از طریق فرآیندهای شیمیایی استخراج شده و به اورانیوم دیاکسید یا سایر ترکیبات شیمیایی قابل استفاده در صنعت تبدیل میشود.
اورانیوم-۲۳۵ نخستین ایزوتوپی بود که بهعنوان شکافا شناسایی شد. دیگر ایزوتوپهای طبیعی این عنصر شکافتپذیر هستند، اما شکافا نیستند.[نیازمند منبع] هنگامی که اورانیوم-۲۳۵ با نوترونهای کند بمباران میشود، اغلب به دو هسته اتم کوچکتر تقسیم شده و انرژی بستگی هستهای آزاد کرده و نوترونهای بیشتری تولید میکند. اگر تعداد زیادی از این نوترونها توسط دیگر هستههای اورانیوم-۲۳۵ جذب شوند، یک واکنش زنجیرهای هستهای رخ میدهد که میتواند منجر به انتشار حرارت شدید یا (در برخی شرایط) انفجار شود. در یک رآکتور هستهای، این واکنش زنجیرهای با استفاده از جاذب نوترون کنترل میشود که برخی از نوترونهای آزاد را جذب میکند. این مواد جاذب نوترون معمولاً بخشی از میله کنترل رآکتور هستند (برای توضیحات بیشتر دربارهٔ این فرایند، به فیزیک رآکتور هستهای مراجعه کنید).
تنها با ۱۵ پوند (۶٫۸ کیلوگرم) اورانیوم-۲۳۵ میتوان یک بمب اتمی ساخت.[۲۷] سلاح هستهای منفجر شده بر فراز هیروشیما، با نام پسر کوچک، بر پایه شکافت اورانیوم طراحی شده بود. اما نخستین بمب هستهای (Gadget مورد استفاده در آزمایش ترینیتی) و بمبی که بر فراز ناگاساکی منفجر شد (مرد چاق)، هر دو بمبهای پلوتونیومی بودند.
فلز اورانیوم دارای سه دگرشکلی (شیمی) است:[۲۸]
- α (دستگاه بلوری راستلوزی) پایدار تا ۶۶۸ درجه سلسیوس (۱٬۲۳۴ درجه فارنهایت). راستلوزی، گروه فضایی شماره ۶۳، Cmcm، ثابت شبکهها: a = ۲۸۵٫۴ pm, b = ۵۸۷ pm, c = ۴۹۵٫۵ pm.[۲۹]
- β (دستگاه بلوری چهارگوشه) پایدار در محدوده ۶۶۸ تا ۷۷۵ درجه سلسیوس (۱٬۲۳۴ تا ۱٬۴۲۷ درجه فارنهایت). چهارگوشه، گروه فضایی P42/mnm, P42nm یا P4n2، پارامترهای شبکه a = ۵۶۵٫۶ pm, b = c = ۱۰۷۵٫۹ pm.[۲۹]
- γ (دستگاه بلوری مکعبی) پایدار از ۷۷۵ درجه سلسیوس (۱٬۴۲۷ درجه فارنهایت) تا نقطه ذوب—این شکل بیشترین میزان چکشخواری و شکلپذیری را دارد. مکعبی مرکزدار، پارامتر شبکه a = ۳۵۲٫۴ pm.[۲۹]
پیدایش
[ویرایش]اورانیوم یک عنصر فراوانی طبیعی است که در مقادیر کم در تمام سنگها، خاک و آب یافت میشود. این عنصر بالاترین عدد اتمی را در میان عناصری دارد که بهطور طبیعی در مقادیر قابل توجه در زمین وجود دارند و تقریباً همیشه با سایر عناصر ترکیب شده است.[۲۱] اورانیوم از نظر فراوانی عنصرهای شیمیایی در پوسته زمین یکی از عناصر موجود در پوسته زمین است.[۳۰] فروپاشی اورانیوم، توریم و پتاسیم-۴۰ در گوشته سیارهای زمین، منبع اصلی گرمایی تلقی میشود[۳۱][۳۲] که باعث حفظ حالت مایع ساختار زمین و تحریک همرفت گوشته میشود که به نوبه خود زمینساخت صفحهای را به حرکت درمیآورد.
میزان فراوانی عنصرهای شیمیایی در پوسته زمین اورانیوم، بسته به منبع، بین ۲ تا ۴ قسمت در میلیون است،[۲۰][۳۳] یا حدود ۴۰ برابر فراوانتر از نقره است.[۲۶] برآورد میشود که پوسته زمین از سطح تا عمق ۲۵ کیلومتری (۱۵ مایلی) حاوی ۱۰۱۷ کیلوگرم (۲×۱۰۱۷ پوند) اورانیوم باشد، درحالیکه اقیانوسها ممکن است ۱۰۱۳ کیلوگرم (۲×۱۰۱۳ پوند) از این عنصر را در خود داشته باشند.[۲۰] غلظت اورانیوم در خاک بین ۰٫۷ تا ۱۱ قسمت در میلیون متغیر است (و در خاک زمینهای کشاورزی به دلیل استفاده از کودهای فسفاته تا ۱۵ قسمت در میلیون میرسد)،[۳۴] و غلظت آن در آب دریا ۳ قسمت در میلیارد است.[۳۳]
اورانیوم از آنتیموان، قلع، کادمیم، جیوه یا نقره فراوانتر است و تقریباً به اندازه آرسنیک یا مولیبدن یافت میشود.[۲۱][۳۳] اورانیوم در صدها کانی وجود دارد، از جمله اورانینیت (رایجترین کانسنگ اورانیوم)، کارنوتیت، اوتونیت، uranophane، توربرنیت و coffinite.[۲۱] مقادیر قابل توجهی از اورانیوم در برخی مواد مانند رسوبات سنگهای فسفاتی و کانیهایی مانند زغال قهوهای و ماسههای مونازیت در سنگهای معدنی غنی از اورانیوم یافت میشود[۲۱] (و بهطور تجاری از منابعی با حداقل ۰٫۱٪ اورانیوم استخراج میشود[۲۶]).
منشأ
[ویرایش]مانند همه عناصر با جرم اتمی نسبی بالاتر از آهن، اورانیوم نیز بهطور طبیعی تنها در اثر فرایند تند گیراندازی نوترون (r-process) در ابرنواخترها و ادغام ستارگان نوترونی شکل میگیرد.[۳۵] اورانیوم و توریم اولیه تنها در فرایند r تولید میشوند، زیرا فرایند کند گیراندازی نوترون (s-process) بسیار کند است و نمیتواند از ناپایداری عناصر پس از بیسموت عبور کند.[۳۶][۳۷]
افزون بر دو ایزوتوپ اولیهٔ موجود اورانیوم، یعنی 235U و 238U، فرایند r مقادیر قابلتوجهی اورانیوم-۲۳۶ نیز تولید کرده است، اما این ایزوتوپ به دلیل نیمهعمر کوتاهترش یک رادیونوکلئید منقرضشده است و مدتها پیش کاملاً به 232Th فروپاشیده است. همچنین، اورانیوم-۲۳۶ بیشتری از طریق واپاشی 244Pu شکل گرفته است، که توضیحدهندهٔ مقدار بیشتر از حد انتظار توریم و مقدار کمتر از حد انتظار اورانیوم در طبیعت است.[۳۸]
درحالیکه فراوانی طبیعی اورانیوم با واپاشی 242Pu (با نیمهعمر ۳۷۵٬۰۰۰ سال) و 247Cm (با نیمهعمر ۱۶ میلیون سال) تا حدودی افزایش یافته و منجر به تولید 238U و 235U شده است، این اثر بسیار ناچیز بوده است، زیرا نیمهعمر والدین این ایزوتوپها کوتاهتر و میزان تولید آنها کمتر از 236U و 244Pu بوده است، که والدین توریم محسوب میشوند. نسبت 247Cm/235U در زمان شکلگیری منظومهٔ شمسی برابر با (۷٫۰±۱٫۶)×۱۰−۵ بوده است.[۳۹]
زیستی و غیرزیستی
[ویرایش]

برخی از باکتریها، مانند Shewanella putrefaciens, Geobacter metallireducens و برخی سویههای Burkholderia fungorum، قادرند از اورانیوم برای رشد خود استفاده کرده و آن را از حالت U(VI) به U(IV) تبدیل کنند.[۴۰][۴۱]
تحقیقات اخیر نشان میدهد که این مسیر شامل کاهش U(VI) محلول از طریق یک حالت حدواسط پنجظرفیتی U(V) است.[۴۲][۴۳]
برخی موجودات دیگر، مانند گلسنگ Trapelia involuta یا میکروبهایی مانند باکتری سیتروباکتر، میتوانند اورانیوم را تا ۳۰۰ برابر غلظت محیط اطراف خود جذب کنند.[۴۴] گونههای Citrobacter هنگام دریافت گلیسرول فسفات (یا سایر ترکیبات فسفاتی آلی مشابه)، یونهای اورانیل را جذب میکنند. پس از یک روز، یک گرم از این باکتریها میتواند خود را با نه گرم کریستالهای اورانیل فسفات بپوشاند؛ این ویژگی میتواند به کاربرد این موجودات در زیستپالایی آبهای آلوده به اورانیوم در آلایش هستهای منجر شود.[۴۵][۴۶]
باکتری پروتئوباکتریوم Geobacter نیز توانایی زیستپالایی اورانیوم در آبهای زیرزمینی را دارد.[۴۷] همچنین، قارچ مایکوریزا Glomus intraradices میتواند میزان اورانیوم موجود در ریشههای گیاه همزیست خود را افزایش دهد.[۴۸]
در طبیعت، اورانیوم(VI) در pH قلیایی، کمپلکسهای کربناتهای بسیار محلول تشکیل میدهد. این امر موجب افزایش تحرک و در دسترس بودن اورانیوم در آبهای زیرزمینی و خاک، بهویژه در مناطق آلوده به ضایعات هستهای، میشود که خطرات بهداشتی در پی دارد. با این حال، رسوبدهی اورانیوم بهصورت فسفات در حضور کربنات اضافی در pH قلیایی دشوار است. یک گونه از باکتری Sphingomonas، موسوم به BSAR-1، آنزیم آلکالین فسفاتاز (PhoK) با فعالیت بالا را تولید میکند که برای رسوب زیستی اورانیوم بهصورت گونههای اورانیل فسفات از محلولهای قلیایی به کار گرفته شده است. توانایی این فرایند با بیان بیشازحد پروتئین PhoK در اشریشیا کلی افزایش یافته است.[۴۹]
گیاهان مقداری اورانیوم را از خاک جذب میکنند. غلظت وزنی خشک اورانیوم در گیاهان بین ۵ تا ۶۰ قسمت در میلیارد متغیر است، در حالی که خاکستر چوب سوخته میتواند تا ۴ قسمت در میلیون اورانیوم داشته باشد.[۴۵] مقدار اورانیوم در خوراک گیاهی معمولاً کمتر است، بهطوری که افراد روزانه تنها یک تا دو میکروگرم اورانیوم را از طریق غذا دریافت میکنند.[۴۵]
تولید و استخراج
[ویرایش]تولید جهانی اورانیوم در سال ۲۰۲۱ برابر با ۴۸٬۳۳۲ تن (یکا) بود که از این میزان، ۲۱٬۸۱۹ تن (۴۵٪) در قزاقستان استخراج شد. دیگر کشورهای مهم در استخراج اورانیوم عبارتاند از نامیبیا (۵٬۷۵۳ تن)، کانادا (۴٬۶۹۳ تن)، استرالیا (۴٬۱۹۲ تن)، ازبکستان (۳٬۵۰۰ تن) و روسیه (۲٬۶۳۵ تن).[۵۰]
سنگ معدن اورانیوم به چند روش استخراج میشود: استخراج روباز، استخراج زیرزمینی، استخراج درجا و استخراج چاهمحور.[۵۱] سنگ معدن اورانیوم کمعیار معمولاً حاوی ۰٫۰۱ تا ۰٫۲۵٪ اکسیدهای اورانیوم است و استخراج فلز از این سنگها نیازمند اقدامات گستردهای است.[۵۲] سنگهای پرعیاری که در نهشتههای حوضه آتاباسکا در ساسکاچوان، کانادا یافت میشوند، بهطور میانگین تا ۲۳٪ اکسیدهای اورانیوم دارند.[۵۳]
برای استخراج، سنگ معدن اورانیوم ابتدا خرد شده و به پودر ریز تبدیل میشود، سپس با استفاده از اسید یا قلیا شسته میشود. شیرآبه حاصل تحت فرآیندهایی نظیر رسوبگیری، استخراج با حلال و تبادل یونی قرار میگیرد. محصول نهایی که کیک زرد نام دارد، حداقل ۷۵٪ اکسیدهای اورانیوم (U3O۸) را دربردارد. کیک زرد سپس طی فرایند تکلیس برای حذف ناخالصیها پیش از پالایش و تبدیل پردازش میشود.[۵۴]
اورانیوم با درجه تجاری را میتوان از طریق اکسایش-کاهش هالیدهای اورانیوم با فلزهای قلیایی یا فلزهای قلیایی خاکی تولید کرد.[۲۱] همچنین، اورانیوم فلزی را میتوان از طریق برقکافت KUF
5 یا اورانیوم تترافلورید که در کلسیم کلرید (CaCl
2) و سدیم کلرید (سدیمCl) مذاب حل شده است، به دست آورد.[۲۱] اورانیوم بسیار خالص از طریق گرماکافت هالیدهای اورانیوم بر روی یک رشته داغ تولید میشود.[۲۱]
-
تولید جهانی اورانیوم (معادن) و میزان تقاضا[۵۰]
-
کیک زرد ترکیبی غلیظ از اکسیدهای اورانیوم است که برای استخراج اورانیوم خالص، بیشتر پالایش میشود.
-
تولید اورانیوم در سال ۲۰۱۵، بر حسب تن[۵۵]
منابع و ذخایر
[ویرایش]
برآورد شده است که ۶٫۱ میلیون تن اورانیوم در سنگهایی وجود دارد که استخراج اقتصادی آنها با قیمت ۱۳۰ دلار آمریکا به ازای هر کیلوگرم اورانیوم ممکن است،[۵۶] در حالی که ۳۵ میلیون تن به عنوان منابع معدنی طبقهبندی میشوند (با چشمانداز منطقی برای استخراج اقتصادی در آینده).[۵۷]
استرالیا دارای ۲۸٪ از ذخایر شناختهشده سنگ معدن اورانیوم در جهان است[۵۶] و بزرگترین ذخیرهٔ منفرد اورانیوم در معدن المپیک دم در استرالیای جنوبی واقع شده است.[۵۸] ذخایر قابل توجهی از اورانیوم نیز در باکوما، یکی از زیر استانهای امبومو در جمهوری آفریقای مرکزی وجود دارد.[۵۹]
بخشی از اورانیوم نیز از تسلیحات هستهای ازکارافتاده به دست میآید.[۶۰] به عنوان نمونه، در سالهای ۱۹۹۳ تا ۲۰۱۳، روسیه ۱۵٬۰۰۰ تن اورانیوم کمغنیشده را در چارچوب برنامهٔ از مگاتن تا مگاوات به ایالات متحده عرضه کرد.[۶۱]
علاوه بر این، تخمین زده میشود که ۴٫۶ میلیارد تن اورانیوم در آب دریا حل شده باشد. دانشمندان ژاپنی در دهه ۱۹۸۰ نشان دادند که استخراج اورانیوم از آب دریا با استفاده از تبادل یونی از نظر فنی امکانپذیر است.[۶۲][۶۳] آزمایشهایی برای استخراج اورانیوم از آب دریا انجام شدهاند،[۶۴] اما بازده این فرایند به دلیل وجود کربنات در آب پایین بوده است. در سال ۲۰۱۲، پژوهشگران آزمایشگاه ملی اوک ریج موفق به توسعهٔ مادهٔ جاذب جدیدی به نام HiCap شدند که با حفظ سطحی مولکولهای جامد، گاز یا یونها، بهطور مؤثری فلزات سمی را از آب حذف میکند. این نتایج توسط محققان آزمایشگاه ملی شمالغربی پاسیفیک تأیید شد.[۶۵][۶۶]
بازار
[ویرایش]
در سال ۲۰۰۵، ده کشور بیشتر تولیدات اکسییدهای اورانیوم متمرکز جهان را تأمین کردند: کانادا (۲۷٫۹٪)، استرالیا (۲۲٫۸٪)، قزاقستان (۱۰٫۵٪)، روسیه (۸٫۰٪)، نامیبیا (۷٫۵٪)، نیجر (۷٫۴٪)، ازبکستان (۵٫۵٪)، ایالات متحده آمریکا (۲٫۵٪)، آرژانتین (۲٫۱٪) و اوکراین (۱٫۹٪).[۶۸] در سال ۲۰۰۸، پیشبینی شده بود که قزاقستان تولید خود را افزایش داده و تا سال ۲۰۰۹ بزرگترین تأمینکننده اورانیوم جهان شود؛[۶۹][۷۰] قزاقستان از سال ۲۰۱۰ تاکنون بازار اورانیوم جهان را تسلط کرده است. در سال ۲۰۲۱، سهم این کشور ۴۵٫۱٪ بود، که پس از آن نامیبیا (۱۱٫۹٪)، کانادا (۹٫۷٪)، استرالیا (۸٫۷٪)، ازبکستان (۷٫۲٪)، نیجر (۴٫۷٪)، روسیه (۵٫۵٪)، چین (۳٫۹٪)، هند (۱٫۳٪)، اوکراین (۰٫۹٪) و آفریقای جنوبی (۰٫۸٪) قرار داشتند، با تولید کل ۴۸٬۳۳۲ تن در سطح جهانی.[۵۰] بیشتر اورانیوم نه از طریق استخراج معمولی زیرزمینی معادن (۲۹٪ تولید)، بلکه از طریق لیچینگ درجا (۶۶٪) تولید شده است.[۵۰][۷۱]
در اواخر دهه ۱۹۶۰، ژئولوژیستهای سازمان ملل ذخایر عمدهای از اورانیوم و سایر مواد معدنی نادر را در سومالی کشف کردند. این کشف بزرگترین از نوع خود بود و کارشناسان صنعتی تخمین میزدند که ذخایر آن بیش از ۲۵٪ از ذخایر شناختهشده اورانیوم جهان با ظرفیت ۸۰۰٬۰۰۰ تن در آن زمان باشد.[۷۲]
عرضه نهایی موجود بهطور کلی برای حداقل ۸۵ سال آینده کافی به نظر میرسد،[۵۷] گرچه برخی مطالعات نشان میدهند که کمبود سرمایهگذاری در اواخر قرن بیستم ممکن است در قرن بیستویکم مشکلاتی در عرضه ایجاد کند.[۷۳] ذخایر اورانیوم بهنظر میرسد که بهصورت توزیع لگاریتمی نرمال باشد. به ازای هر کاهش دهبرابری در درجه سنگ معدن، مقدار اورانیوم قابل استخراج ۳۰۰ برابر افزایش مییابد.[۷۴] به عبارت دیگر، معادن با درجه بالا کمیاب هستند و در مقابل معادن با درجه پایین به میزان قابل توجهی بیشتر در دسترس میباشند.
منابع و ذخایر
[ویرایش]در ابتدای کشف اورانیوم این باور رایج بود که این عنصر بسیار کمیاب است اما بعد از گذشت یک دهه، معادن بزرگی از اورانیوم در نقاط مختلف جهان پیدا شد. تخمین زده میشود که ۵٫۵ میلیون تن اورانیوم در ذخایر سنگ معدن وجود دارد که از نظر اقتصادی در ۵۹ دلار بر هر پوند اورانیوم قابلیت رشد و ترقی دارند،[۷۵] درحالیکه ۳۵ میلیون تن به عنوان منابع معدنی طبقهبندی میشوند (چشمانداز معقول برای استخراج اقتصادی احتمالی).[۵۷] قیمتها از حدود ۱۰ دلار در هر پوند در ماه مه ۲۰۰۳ به ۱۳۸ دلار در هر پوند در ژوئیه ۲۰۰۷ رسید. این امر باعث افزایش زیاد هزینه در زمینه کاوش شدهاست،[۷۵] با هزینه ۲۰۰ میلیون دلار در سال ۲۰۰۵ در سراسر جهان، ۵۴ درصد نسبت به سال قبل افزایش یافتهاست.[۵۷] این روند تا سال ۲۰۰۶ ادامه یافت، هنگامی که هزینههای اکتشاف به بیش از ۷۷۴ میلیون دلار رسید، یک افزایش بیش از ۲۵۰٪ نسبت به سال ۲۰۰۴ داشتهاست. سازمان همکاری و توسعه اقتصادی (OECD) گفت که ارقام اکتشاف سال ۲۰۰۷ احتمالاً با آمار سال ۲۰۰۶ مطابقت دارد.[۷۵]
استرالیا ۳۱٪ از ذخایر شناخته شده سنگ معدن اورانیوم جهان را در اختیار دارد.[۷۶] بزرگترین معدن اورانیوم جهان نیز معدن سد المپیک در استرالیای جنوبی است.[۷۷] یک ذخیره قابل توجه از اورانیوم در باکوما، منطقه ای در مابومو در جمهوری آفریقای مرکزی وجود دارد.[۷۸] یکی دیگر از منابع قابل توجه، اورانیوم حاصله از نابودسازی سلاحهای هسته ای است.[۷۹] مانند برنامه مگاتن به مگاوات. تخمین زده میشود که ۴٫۶ میلیارد تن اورانیوم محلول در آب دریا باشد (دانشمندان ژاپنی در دهه ۱۹۸۰ نشان دادند که استخراج اورانیوم از آب دریا با استفاده از تبادلهای یونی از نظر فنی امکانپذیر است).[۶۲][۶۳] بررسیهایی برای استخراج اورانیوم از آب دریا انجام شده اما به دلیل کربنات موجود در آب دریا بازدهی کم بودهاست. در سال ۲۰۲۰، محققان آزمایشگاه ملی اوک ریج (ORNL) توسعه موفقیتآمیز یک مادهٔ جاذب جدید موسوم به HiCaP را اعلام کردند که بازداری سطح مولکولها، اتمها یا یونهای جامد یا گاز را انجام میدهد و طبق نتایج تأیید شده توسط محققان در آزمایشگاه ملی شمال غربی اقیانوس آرام، بهطور مؤثر فلزات سمی را از آب خارج میکند.[۸۰][۸۱]
تولید
[ویرایش]
در سال ۲۰۰۵ هفده کشور اکسیدهای اورانیوم غلیظ تولید کردند: کانادا(۲۹٫۷٪ از تولید جهانی)، استرالیا(۲۲٪)، قزاقستان(۱۰٫۵٪)، روسیه(۸٫۰٪)، نامیبیا(۷٫۵٪)، نیجر(۷٫۴٪)، ازبکستان(۵٫۵٪)، ایالات متحده(۲٫۵٪)، آرژانتین(۲٫۱٪)، اوکراین(۱٫۹٪) و چین(۱٫۷٪).[۸۲] قزاقستان همچنان به افزایش تولید خود ادامه میدهد و احتمالاً با تولید پیشبینی شده ۱۲۸۲۶ تن در مقایسه با کانادا با ۱۱۱۰۰ تن و استرالیا با ۹۴۳۰ تن به بزرگترین تولیدکننده اورانیوم در جهان در سال ۲۰۰۹ تبدیل شدهاست.[۸۳][۸۴] در اواخر دهه ۱۹۶۰، زمین شناسان سازمان ملل هم چنین ذخایر مهم اورانیوم و سایر ذخایر معدنی کمیاب در سومالی را کشف کردند. این یافته در نوع خود بزرگترین بود، به طوری که کارشناسان صنعت بیش از ۲۵٪ ذخایر اورانیوم شناخته شده در جهان را ۸۰۰۰۰۰ تن تخمین زدهاند.[۷۲]
اعتقاد بر این است که عرضه نهایی موجود حداقل برای ۸۵ سال آینده کافی است،[۵۷] اگرچه برخی مطالعات حاکی از کمبود سرمایهگذاری در اواخر قرن بیستم است که ممکن است در قرن ۲۱ مشکلات عرضه را ایجاد کند.[۷۳] به نظر میرسد که ذخایر اورانیوم به صورت توزیع لگاریتمی طبیعی باشد. برای هر ده برابر کاهش در درجه سنگ معدن، ۳۰۰ برابر افزایش در مقدار اورانیوم قابل بازیافت وجود دارد.[۸۵] به عبارت دیگر، سنگ معدن در درجه بالا، به مقدار کمی وجود دارد و به تناسب مقدار بیشتری سنگ معدن با درجه بسیار کم تری در دسترس است.
ترکیبها
[ویرایش]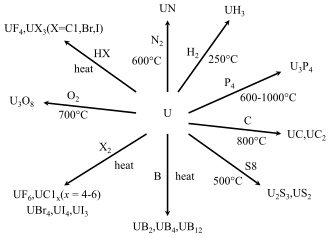
حالات اکسیداسیون و اکسیدها
[ویرایش]اکسیدها
[ویرایش]کیک زرد اورانیوم خشک شده، که در بسیاری از آسیابهای بزرگ تولید میشود، شامل توزیعی از گونههای اکسیداسیون اورانیوم در اشکال مختلف است که از اکسید شدهترین تا کماکسید شدهترین قرار میگیرند. ذراتی که زمان اقامت کوتاهی در کلسینر دارند معمولاً کمتر اکسید شدهاند نسبت به آنهایی که زمان اقامت طولانیتری دارند یا ذراتی که در اسکرابر کلاهک بازیابی میشوند. محتوای اورانیوم معمولاً به U
3O
8 اشاره دارد، که به دوران پروژه منهتن بازمیگردد زمانی که U
3O
8 بهعنوان استاندارد گزارشدهی شیمی تجزیهای استفاده میشد.[۸۶]
رابطههای فازی در سیستم اورانیوم-اکسیژن پیچیده است. مهمترین حالات اکسیداسیون اورانیوم، اورانیوم(IV) و اورانیوم(VI) هستند و دو اکسید متناظر آنها بهترتیب اورانیوم دیاکسید (UO
2) و تریاکسید اورانیم (UO
3) هستند.[۸۷] سایر اکسید اورانیومها مانند اورانیوم مونوکسید (UO)، دیاورانیوم پنتاکسید (U
2O
5)، و اورانیل پروکسید (UO
4·2H
۲O) نیز وجود دارند.
رایجترین اشکال اکسید اورانیوم، تریاورانیوم اکتوکسید (U
3O
8) و UO
2 هستند.[۸۸] هر دو نوع اکسید بهصورت جامد هستند و در آب حلشدنی کم دارند و در طیف وسیعی از شرایط محیطی پایدار هستند. تریاورانیوم اکتوکسید (بسته به شرایط) پایدارترین ترکیب اورانیوم است و فرم غالب آن در طبیعت میباشد. اورانیوم دیاکسید فرمی است که اورانیوم عمدتاً بهعنوان سوخت راکتور هستهای استفاده میشود.[۸۸] در دمای محیط، UO
2 بهتدریج به U
3O
8 تبدیل میشود. بهخاطر پایداریشان، اکسیدهای اورانیوم معمولاً بهعنوان فرم شیمیایی ترجیحی برای ذخیرهسازی یا دفع در نظر گرفته میشوند.[۸۸]
شیمی آبی
[ویرایش]
نمکهای بسیاری از عدد اکسایشهای اورانیوم در آب حلشدنی هستند و میتوان آنها را در محلول آبی مطالعه کرد. رایجترین اشکال یونی U3+
(قرمز مایل به قهوهای)، U4+
(سبز)، UO+
2 (ناپایدار) و اورانیل (زرد) برای U(III), U(IV), U(V) و U(VI) بهترتیب هستند.[۸۷] چندین ترکیب جامد و نیمهفلزی مانند UO و اورانیوم مونوسولفید برای حالت اکسیداسیون رسمی اورانیوم(II) وجود دارد، اما یونهای سادهای که در محلول برای این حالت وجود داشته باشند، شناخته نشدهاند. یونهای U3+
هیدروژن را از آب آزاد میکنند و بنابراین بهعنوان ترکیبهایی با پایداری پایین در نظر گرفته میشوند. یون UO2+
2 نمایانگر حالت اورانیوم(VI) است و شناختهشده است که ترکیبهایی مانند کربنات اورانیوم، اورانیل کلرید و اورانیل سولفات تشکیل میدهد. UO2+
2 همچنین با ترکیب آلیهای مختلف چنگالش کمپلکسهای شیمیایی تشکیل میدهد که رایجترین آنها اورانیل استات است.[۸۷]
برخلاف نمکهای اورانیل اورانیوم و فرمهای کاتیونی یون چنداتمی اورانیوم-اکسید، اوراناتها که نمکهایی حاوی آنیون اورانیوم-اکسید چنداتمی هستند، معمولاً در آب حل نمیشوند.
کربناتها
[ویرایش]تعاملات آنیونهای کربنات با اورانیوم(VI) باعث تغییرات عمدهای در نمودار پوربه میشود زمانی که محیط از آب به محلول حاوی کربنات تغییر میکند. در حالی که بیشتر کربناتها در آب نامحلول هستند (دانشآموزان اغلب آموزش میبینند که همه کربناتها بهجز آنهایی که از فلزات قلیایی هستند، در آب حل نمیشوند)، کربناتهای اورانیوم اغلب در آب حل میشوند. این به این دلیل است که کاتیون U(VI) قادر است دو اکسید انتهایی و سه یا بیشتر کربنات را بهطور همزمان برای تشکیل کمپلکسهای آنیونی متصل کند.
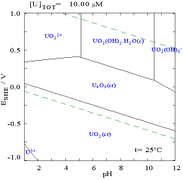 |
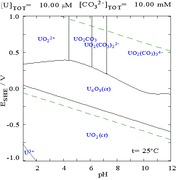 |
| اورانیوم در یک محیط آبی غیر کمپلکس (بهعنوان مثال پرکلریک اسید/هیدروکسید سدیم).[۸۹] |
اورانیوم در محلول کربنات |
 |
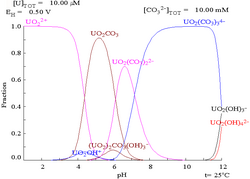 |
| مقادیر نسبی غلظتهای اشکال مختلف شیمیایی اورانیوم در یک محیط آبی غیر کمپلکس (بهعنوان مثال پرکلریک اسید/هیدروکسید سدیم).[۸۹] |
مقادیر نسبی غلظتهای اشکال مختلف شیمیایی اورانیوم در یک محلول آبی کربنات.[۸۹] |
اثرات pH
[ویرایش]نمودارهای کسری اورانیوم در حضور کربنات این موضوع را بیشتر توضیح میدهند: هنگامی که pH محلول اورانیوم(VI) افزایش مییابد، اورانیوم به هیدراته اورانیوم اکسید هیدروکسید تبدیل میشود و در pHهای بالا به یک کمپلکس هیدروکسید آنیونی تبدیل میشود.
زمانی که کربنات اضافه میشود، اورانیوم به مجموعهای از کمپلکسهای کربنات تبدیل میشود، اگر pH افزایش یابد. یکی از اثرات این واکنشها افزایش حلالیت اورانیوم در محدوده pH از ۶ تا ۸ است، که تأثیر مستقیمی بر پایداری بلندمدت سوختهای هستهای دیاکسید اورانیوم مصرفشده دارد.
هیدریدها، کربیدها و نیتریدها
[ویرایش]فلز اورانیوم هنگامی که به دمای ۲۵۰ تا ۳۰۰ درجه سلسیوس (۴۸۲ تا ۵۷۲ درجه فارنهایت) برسد با هیدروژن واکنش میدهد و هیدرید اورانیوم را تشکیل میدهد. دماهای بالاتر بهطور معکوس هیدروژن را از آن جدا میکنند. این ویژگی باعث میشود هیدریدهای اورانیوم مواد اولیه مناسبی برای تولید پودر واکنشپذیر اورانیوم همراه با ترکیبات مختلف اورانیوم کاربید، نیترید و هالید باشند.[۸۷] دو تغییر بلوری از هیدرید اورانیوم وجود دارد: یک فرم α که در دماهای پایین بهدست میآید و یک فرم β که در دماهای بالاتر از ۲۵۰°C ایجاد میشود.[۸۷]
کاربید اورانیومها و اورانیوم نیتریدها هر دو ترکیبهای شیمیایی ناپاسخ نسبتاً نیمه فلزی هستند که بهطور حداقلی در اسیدها حل میشوند، با آب واکنش میدهند و میتوانند در اتمسفر زمین مشتعل شوند و U
3O
8 تشکیل دهند.[۸۷] کاربیدهای اورانیوم شامل اورانیوم مونوکربید (Uکربن)، اورانیوم دیکربید (UC
2) و دیاورانیوم تریکربید (U
2C
3) هستند. هر دو UC و UC
2 با افزودن کربن به اورانیوم مذاب یا با قرار دادن فلز در معرض کربن منوکسید در دماهای بالا بهدست میآیند. U
2C
3 که پایدارتر از ۱۸۰۰°C است، با اعمال تنش مکانیکی به مخلوط گرمایششده UC و UC
2 تهیه میشود.[۸۷] نیتریدهای اورانیوم که با قرار دادن فلز در معرض نیتروژن بهدست میآیند، شامل اورانیوم مونو نیترید (UN)، اورانیوم دینیترید (UN
2) و دیاورانیوم ترینیترید (U
2N
3) هستند.[۸۷]
هالیدها
[ویرایش]
تمام فلورایدهای اورانیوم با استفاده از اورانیوم تترافلورید (UF
4) ساخته میشوند؛ UF
4 خود با هیدروفلورینه کردن اورانیوم دیاکسید تهیه میشود.[۸۷] کاهش UF
4 با هیدروژن در دمای ۱۰۰۰°C اورانیوم تریفلورید (UF
3) تولید میکند. تحت شرایط مناسب دما و فشار، واکنش UF
4 جامد با هگزافلوراید اورانیوم (UF
6) گازی میتواند فلورایدهای میانه مانند U
2F
9، U
4F
17 و اورانیوم پنتافلورید را تشکیل دهد.[۸۷]
در دمای اتاق، UF
6 فشار بخار بالایی دارد، که آن را برای فرایند انتشار گازی بهمنظور جداسازی اورانیوم-۲۳۵ نادر از ایزوتوپ رایج اورانیوم-۲۳۸ مفید میکند. این ترکیب میتواند از اورانیوم دیاکسید و هیدرید اورانیوم بهوسیله فرایند زیر تهیه شود:[۸۷]
- UO
2 + 4 HF → UF
4 + 2 H
2O (500°C، اندوترمیک) - UF
4 + F
2 → UF
6 (350°C، اندوترمیک)
در نتیجه UF
6 که یک جامد سفید است، بسیار واکنش شیمیایی (با فلورینه شدن)، بهراحتی تصعید میشود (انتشار بخاری که مانند یک گاز ایدهآل عمل میکند) و شناختهشدهترین ترکیب فرار اورانیوم است.[۸۷]
یکی از روشهای تهیه تتراکلرید اورانیوم (UCl
4) ترکیب مستقیم کلر با فلز اورانیوم یا هیدرید اورانیوم است. کاهش UCl
4 با هیدروژن کلرید اورانیوم (III) (UCl
3) تولید میکند، در حالی که هالیدهای بالاتر اورانیوم با واکنش با کلر اضافی تهیه میشوند.[۸۷] تمام هالیدهای اورانیوم با آب و هوا واکنش میدهند.
برومیدها و یدیدهای اورانیوم با واکنش مستقیم برم و ید با اورانیوم یا افزودن UH
3 به اسیدهای آن عناصر تشکیل میشوند.[۸۷] نمونههای شناختهشده شامل: UBr
3، اورانیوم تترابرمید، اورانیوم(III) یدید و UI
4 هستند. UI
5 هیچگاه تهیه نشده است. اکسیهالیدهای اورانیوم در آب حلشدنی هستند و شامل اورانیل فلورید، UOCl
2، اورانیل کلرید و UO
2Br
2 میشوند. پایداری اکسیهالیدها با افزایش جرم اتمی نسبی هالید مؤلفه کاهش مییابد.[۸۷]
ایزوتوپها
[ویرایش]
غلظتهای طبیعی
[ویرایش]اورانیوم طبیعی شامل سه ایزوتوپ اصلی است: اورانیوم-۲۳۸ (۹۹٫۲۸٪ فراوانی طبیعی)، اورانیوم-۲۳۵ (۰٫۷۱٪) و اورانیوم-۲۳۴ (۰٫۰۰۵۴٪). هر سه رادیواکتیو و نشر دهنده ذرات آلفا هستند، به استثنای این که هر سه این ایزوتوپها به احتمال کمی تحت شکافت خود به خود قرار میگیرند. افزون بر این، پنج ایزوتوپ کم مقدار دیگر وجود دارد: اورانیوم-۲۳۹، زمانی تشکیل میشود که اورانیوم ۲۳۸ تحت شکافت خود به خودی قرار گیرد، نوترونهای آزاد شده توسط اتم ۲۳۸ دیگری اسیر میشود؛ اورانیوم-۲۳۷، زمانی تشکیل میشود که اتم۲ ۲۳۸ یک نوترون را اسیر میکند اما دوتای دیگر را منتشر میکند، سپس به نپتونیوم-۲۳۷ واپاشی میشود؛ و در نهایت، اورانیوم-۲۳۳ که در زنجیرهٔ واپاشی نپتونیوم-۲۳۷ تشکیل شدهاست. همچنین پیشبینی میشود که توریوم-۲۳۲ باید قادر به فروپاشی دو بتا باشد، که اورانیوم-۲۳۲ تولید شود اما هنوز به صورت آزمایشگاهی مشاهده نشدهاست.[۹۰]
اورانیوم-۲۳۸ پایدارترین ایزوتوپ اورانیوم است با نیمهعمر تقریباً ۴٫۴۶۸×۱۰۹ سال، در حدود سن زمین است. اورانیوم-۲۳۵ نیمه عمر تقریباً ۷٫۱۳×۱۰۸ سال و اورانیوم-۲۳۴ نیمه عمر در حدود ۲٫۴۸×۱۰۵ دارند.[۹۱] برای اورانیوم طبیعی حدود ۴۹٪ از پرتوهای آلفای آن توسط اورانیوم-۲۳۸ و نیز ۴۹٪ توسط اورانیوم-۲۳۴ (چون دومی از اولی تشکیل شدهاست) و حدود ۲٫۰٪ از آنها توسط اورانیوم-۲۳۵ ساطع میشود. وقتیکه زمین جوان بود، احتمالاً حدود یک پنجم اورانیوم آن اورانیوم-۲۳۵ بوده، اما درصد اورانیوم-۲۳۴ احتمالاً بسیار کمتر از این بودهاست.
اورانیوم-۲۳۸ معمولاً یک نشر دهندهٔ آلفا است (گهگاه دچار شکافت خود به خودی میشود)، واپاشی از میان سریهای اورانیومی، که ۱۸ عضو دارد، درون سرب-۲۰۶ توسط انواع مختلف الگوهای واپاشی صورت میگیرد.[۲۶]
زنجیرههای واپاشی اورانیوم-۲۳۵ که سریهای آکتینیوم نامیده شدهاست، ۱۵عضو دارد و درنهایت به سرب-۲۰۷ واپاشی میشود.[۲۶] نرخهای ثابت واپاشی در این سریهای واپاشی قابل قیاس با نسبتهای عناصر والد به دختر در دادههای رادیومتریک میباشد.
اورانیوم-۲۳۴، که یکی از اعضا سریهای اورانیوم است (زنجیره واپاشی اورانیوم-۲۳۸) به سرب-۲۰۶ که ازیک سری ایزوتوپهای نسبتاً کوتاه عمر است، واپاشی میشود. اورانیوم-۲۳۳ از توریوم-۲۳۲ توسط بمباران نوترونی، معمولاً در رآکتورهای هسته ای، ساخته میشود و اورانیوم-۲۳۳ نیز شکاف پذیر است.[۲۱] زنجیرهٔ فروپاشی آن بخشی از سری نپتونیوم را تشکیل میدهد و با بیسموت-۲۰۹ و تالیوم-۲۰۵ خاتمه میابد.
اورانیوم-۲۳۵ برای راکتورها و جنگافزارهای هستهای اهمیت دارد، زیرا تنها ایزوتوپ اورانیوم است که در طبیعت روی زمین در مقادیر قابل توجهی که شکافپذیر است، وجود دارد. به این معنی که میتواند به دو یا سه قطعه (محصول شکافت) توسط نوترونهای حرارتی شکافته شود.[۲۶]
اورانیوم-۲۳۸ شکاف پذیر نیست اما یک ایزوتوپ پرثمر است زیرا پس از فعالسازی نوترونی میتواند به پلوتونیوم-۲۳۹ یکی دیگر از ایزوتوپهای شکاف پذیر تبدیل شود. درواقع هستههای اورانیوم-۲۳۸ میتوانند یک نوترون جذب کنند تا ایزوتوپ رادیواکتیو اورانیوم-۲۳۹ تولید شود. اورانیوم-۲۳۹ توسط نشر بتا به نپتونیوم-۲۳۹ فروپاشی میشود، هم چنین یک ساطع کنندهٔ بتا، که به نوبهٔ خود فروپاشی میشود در عرض چند روز به پلوتونیوم-۲۳۹ فروپاشی میکند. پلوتونیوم-۲۳۹ در اولین انفجار بمب اتمی در آزمایش ترینیتی در ۱۵ ژوئیه ۱۹۴۵ در نیومکزیکو به عنوان مادهٔ شکاف پذیر مورد استفاده قرار گرفت.[۹۲]
غنی سازی
[ویرایش]در طبیعت، اورانیوم به عنوان اورانیوم-۲۳۸ (۹۹٫۲۷۴۲٪) و اورانیوم-۲۳۵ (۰٫۷۲۰۴٪) یافت میشود. جداسازی ایزوتوپ، اورانیوم-۲۳۵ شکاف پذیر را برای سلاحهای هسته ای و اکثر نیروگاههای هسته ای غنی میسازد. اکثر نوترونهای آزاد شده توسط یک اتم شکافته شده اورانیوم-۲۳۵ باید بر سایر اتمهای اورانیوم-۲۳۵ تأثیر بگذارند تا واکنش زنجیرهای هستهای را حفظ کنند. غلظت و مقدار اورانیوم-۲۳۵ مورد نیاز برای دستیابی به این هدف جرم بحرانی نامیده میشود.
برای غنی سازی، سهم اورانیوم-۲۳۵ باید بین ۳ تا ۵ درصد باشد.[۹۳] این فرایند مقدار زیادی از اورانیوم تولید میکند که عاری از اورانیوم-۲۳۵ است و به همان نسبت سهم اورانیوم-۲۳۸ افزایش یافتهاست، اورانیوم تخلیه شده یا DU[g] نامیده میشود. برای تخلیه کردن، غلظت ایزوتوپ اورانیوم-۲۳۵ نباید بیشتر از ۰٫۳٪ باشد.[۹۴] قیمت اورانیوم ازسال ۲۰۰۱ افزایش یافتهاست، بنابراین غنی سازی پسماندهای حاوی بیش از۰٫۳۵٪ اورانیوم-۲۳۵ برای غنی سازی مجدد در نظر گرفته شدهاست، که سبب رسیدن قیمت اورانیوم هگزافلوراید تضعیف شده، از ۵ دلار در سال ۲۰۰۱ به بالای ۱۳۰ دلار بر هر کیلوگرم در ژوئیه ۲۰۰۷ شدهاست.[۹۴]
فرایند سانتریفیوژ گازی که در آن هگزافلوراید اورانیوم گازی (UF6) با اختلاف وزن مولکولی بین 235 UF6 و 238 UF6 با استفاده از سانتریفیوژ سرعت بالا ازهم جدا میشوند، ارزانترین و پیشرو فرایند غنی سازی است.[۱۳] فرایند انتشار گاز روشی پیشرو برای غنی سازی بوده و در پروژهٔ منهتن مورد استفاده قرار گرفتهاست. در این فرایند، اورانیوم هگزافلوراید مکرراً از میان یک غشا نقره - روی پراکنده شده و ایزوتوپهای مختلف اورانیوم بهوسیلهٔ سرعت نفوذ از هم جدا میشوند (از آنجا که اورانیوم-۲۳۸ سنگین تر است کمی آهستهتر از اورانیوم-۲۳۵ نفوذ میکند).[۱۳] روش جداسازی ایزوتوپ لیزر مولکولی از یک پرتو لیزری با انرژی معین برای قطع پیوند بین اورانیوم-۲۳۵ و فلوئور استفاده میکند. این جدایی، اورانیوم-۲۳۸ را به فلوئور پیوند میدهد و به فلز اورانیوم-۲۳۵ اجازه میدهد تا از محلول رسوب کند.[۶] یک روش غنی سازی جایگزین لیزر به عنوان جداسازی ایزوتوپ لیزر بخار اتمی (AVLIS) شناخته شدهاست و از لیزرهای قابل تنظیم مرئی مانند لیزرهای رنگی استفاده میکند.[۹۵] روش دیگری که استفاده میشود، انتشار حرارتی مایع است.[۲۰]
کاربردها
[ویرایش]
نظامی
[ویرایش]اصلیترین کاربرد اورانیوم در بخش نظامی در دستگاههای نفوذگر با چگالی بالاست. این اسلحه از اورانیوم بدون بار (DU) آلیاژ شده با یک تا دو درصد از عناصر دیگر، مثل تیتانیوم یا مولیبدن تشکیل شدهاست.[۹۶] در سرعت بالای ضربه، چگالی، سختی، و توانایی شعلهوری خود به خودی در معرض هوای پرتابه، امکان تخریب اهداف شدیداً زرهی را فراهم میکند. تانک زرهی و سایر وسایل نقلیه زرهی نیز میتوانند بهوسیلهٔ صفحات اورانیوم خنثی مستحکم شوند. استفاده از اورانیوم بدون بار پس از استفاده از چنین مهمات توسط ایالات متحده، انگلیس و سایر کشورها در جریان جنگها در خلیج فارس و بالکان، از نظر سیاسی و محیط زیست مورد بحث و جدال قرار گرفت و سوالاتی در رابطه با ترکیبات اورانیوم باقی مانده در خاک پیش آورد. (سندرم جنگ خلیج فارس را ببینید).[۲۷] اورانیوم خنثی همچنین به عنوان مادهٔ محافظ در بعضی از حاملهای استفاده شده در ذخیرهسازی و انتقال مواد رادیواکتیو، مورد استفاده قرار میگیرد. در حالی که این فلز خود رادیواکتیو است، چگالی بالای آن سبب میشود، نسبت به سرب در متوقف کردن اشعه از منابع قوی مثل رادیم، موثرتر باشد.[۲۰] سایر کاربردهای اورانیوم بدون بار شامل وزنههای متقابل برای سطوح کنترل کنندهٔ هواپیما، بالاست برای وسایل نقلیه ورود مجدد و به عنوان مادهٔ محافظ میباشد.[۲۱] به دلیل چگالی بالا، این ماده در سیستمهای هدایت اینرسی و در قطبنماهای ژیروسکوپی یافت میشود.[۲۱] اورانیوم تخلیه شده به دلیل توانایی ماشینکاری و ریختهگری و همچنین هزینه نسبتاً کم، نسبت به فلزات مشابه متراکم ترجیح داده میشود.[۹۷] ریسک اصلی قرار گرفتن در معرض اورانیوم خنثی مسمومیت شیمیایی بهوسیلهٔ اکسید اورانیوم است نه رادیواکتیویتهٔ آن. (اورانیوم تنها یک نشرکنندهٔ ضعیف آلفاست). در مراحل اخیر جنگ جهانی دوم، کل جنگ سرد و به مدت زمان کوتاهی پس از آن، از اورانیوم-۲۳۵ به عنوان ماده منفجره قابل شکافت، برای تولید سلاحهای هسته ای استفاده شدهاست. در ابتدا، دو نوع اصلی از بمبهای قابل شکافت ساخته شد:یک دستگاه نسبتاً ساده که از اورانیوم-۲۳۵ استفاده میکند و یک مکانیسم بسیار پیشرفته تر که از پلوتونیم-۲۳۹ مشتق شده از اورانیوم-۲۳۸ استفاده میکند. بعدها، یک بمب از نوع شکافتی/گداختی که بسیار پیچیدهتر و بسیار قویتر است (اسلحه وابسته به درجه حرارت هسته اتم) ساخته شد، که از دستگاهی براساس پلوتونیم استفاده میکند تا سبب شود مخلوطی از تریتیوم و دوتریوم تحت همجوشی هستهای قرار گیرند. چنین بمبهایی در دستهٔ موارد اورانیوم غیر شکافتی (غنی نشده) قرار میگیرند، و بیشتر نیروی خود را، از شکافت این ماده بهوسیلهٔ نوترونهای تسریع شده از فرایند گداخت هسته، منشأ میگیرند.[۹۸]
غیرنظامی
[ویرایش]اصلیترین کاربرد غیرنظامی اورانیوم در بخش غیرنظامی به عنوان سوخت نیروگاههای انرژی هستهای میباشد. یک کیلوگرم اورانیوم ۲۳۵ به لحاظ تئوری میتواند حدود ۲۰ تراژول انرژی (۱۳^۱۰×۲ ژول) تولید کند، با فرض شکافت کامل؛ انرژی آن برابر با انرژی یک و نیم میلیون کیلوگرم (۱۵۰۰ تن) زغال سنگ و ۳۳۳۳ بشکه نفت است.[۶] نیروگاههای تجاری انرژی هستهای از سوختی استفاده میکنند که معمولاً تا حدود ۳٪ اورانیوم-۲۳۵ غنی شدهاست.[۶] طراحی رآکتور کاندو[h] و مگناکس[i] تنها رآکتورهای تجاری توانمند در استفاده از سوخت اورانیوم غنی نشده هستند. سوخت استفاده شده در رآکتورهای نیروی دریایی ایالات متحده آمریکا بهطور معمول بسیار در از نظر اورانیوم-۲۳۵ غنی میباشد (مقادیر دقیق طبقهبندی شدهاند). در یک رآکتور زاینده، اورانیوم-۲۳۸ همچنین میتواند توسط واکنش زیر به پلوتونیم تبدیل شود.[۲۱]
- 238
92U + n → 239
92U + γ 239
93Np 239
94Pu
قبل (و گاهی، بعد) از کشف رادیواکتیویته، اورانیوم در ابتدا در مقادیر کم برای شیشه زرد و درخشش ظروف، مانند شیشه اورانیوم و در فیستاور[j] استفاده میشد.[۹۹]
کشف و ایزوله کردن رادیوم در سنگ معدن اورانیوم[k] توسط ماری کوری شروعی برای گسترش حفاری اورانیوم به منظور استخراج رادیوم بود، که برای ساخت رنگهای درخشنده در تاریکی در ساعتها و صفحهٔ عقربه دار هواپیما استفاده میشد.[۱۰۰] این امر سبب میشد مقدار زیادی از اورانیوم هدر برود، زیرا برای استخراج یک گرم رادیوم به سه تن اورانیوم احتیاج است. این پسماند به صنعت لعاب دادن منتقل شد، که باعث میشد لعاب اورانیوم بسیار ارزان و فراوان باشد. علاوه بر لعاب ظروف، لعاب سرامیک اورانیوم شامل سرامیکهای معمول آشپزخانه و حمام در حجم زیاد استفاده میشد که میتواند در رنگهای سبز، زرد، بنفش، سیاه، آبی، قرمز و سایر رنگها تولید شود.
اورانیوم همچنین در مواد شیمیایی عکاسی (به ویژه اورانیوم نیترات به عنوان تونر)،[۲۱] در رشتهٔ لامپ برای حباب چراغ صحنه،[۱۰۱] به منظور بهبود ظاهر دندانهای مصنوعی،[۱۰۲] و در صنایع چوب و چرم برای رنگ و لک، استفاده میشد. نمکهای اورانیوم مواد تثبیت کنندهٔ ابریشم و پشم هستند. اورانیل استات و اورانیل فرمات به عنوان استین های[l] چگال الکترون در میکروسکوپ الکترونی عبوری، به منظور افزایش کنتراست نمونههای زیستی در مقاطع بسیار نازک و در ویروسهای گرم منفی، ارگانلهای سلول تک و درشتمولکولها استفاده میشوند.
کشف رادیواکتیویتهٔ اورانیوم سبب ظهور موارد استفادهٔ علمی و عملی بیشتری از این عنصر شد. نیمهعمر طولانی ایزوتوپ اورانیوم-۲۳۸ (۵٫۵۱ × ۱۰۹ سال)، آن را برای استفاده در تخمین سن ابتداییترین سنگهای آذرین و سایر انواع زمانسنجی رادیومتری، من جمله تاریخنگاری اورانیوم-توریم، تاریخنگاری اورانیوم-سرب و تاریخنگاری اورانیوم-اورانیوم، مناسب میسازد. فلز اورانیوم به عنوان اهداف پرتو ایکس در تولید پرتو ایکس پر انرژی، استفاده میشود.[۲۱]
مواجهه انسانی
[ویرایش]افراد میتوانند در معرض اورانیوم (یا محصولات واپاشی آن، مانند رادون) قرار گیرند، که این مواجهه از طریق استنشاق گرد و غبار در هوا یا بلع آب و غذای آلوده اتفاق میافتد. میزان اورانیوم موجود در هوا معمولاً بسیار کم است؛ با این حال، افرادی که در کارخانههای پردازش کود فسفات کار میکنند، در نزدیکی تأسیسات دولتی که سلاحهای هستهای ساخته یا آزمایش کردهاند زندگی میکنند، در نزدیکی میدانهای نبرد مدرن که در آنها از سلاحهای اورانیوم ضعیف شده استفاده شده است، یا در نزدیکی نیروگاههای سوخت فسیلی، تأسیساتی که اورانیوم استخراج و پردازش میکنند، یا اورانیوم را برای سوخت رآکتور غنی میکنند، ممکن است در معرض اورانیوم بیشتری قرار بگیرند.[۱۰۳][۱۰۴] خانهها یا ساختمانهایی که بر روی ذخایر اورانیوم (چه طبیعی و چه رسوبات باقیمانده انسانساخت) قرار دارند، ممکن است در معرض گاز رادون قرار گیرند. اداره ایمنی و سلامت شغلی (OSHA) حد مجاز مواجهه با اورانیوم در محیط کار را ۰٫۲۵ میلیگرم بر مترمکعب در طول یک روز کاری ۸ ساعته تعیین کرده است. مؤسسه ملی ایمنی و سلامت شغلی (NIOSH) حد مواجهه توصیهشده (REL) را ۰٫۲ میلیگرم بر مترمکعب در طول یک روز کاری ۸ ساعته و حد کوتاهمدت آن را ۰٫۶ میلیگرم بر مترمکعب تعیین کرده است. در غلظت ۱۰ میلیگرم بر مترمکعب، اورانیوم بلافاصله برای زندگی و سلامت خطرناک است.[۱۰۵]
بیشتر اورانیوم بلعیده شده در فرایند گوارش دفع میشود. فقط ۰٫۵٪ آن زمانی که اشکال نامحلول اورانیوم، مانند اکسید آن، بلعیده میشود، جذب میشود، در حالی که جذب یونهای بیشتر حلشده اورانیل میتواند تا ۵٪ باشد.[۴۵] با این حال، ترکیبات محلول اورانیوم تمایل دارند به سرعت از بدن عبور کنند، در حالی که ترکیبات نامحلول اورانیوم، به ویژه زمانی که به شکل گرد و غبار استنشاق میشوند، خطر بیشتری برای مواجهه دارند. پس از وارد شدن به جریان خون، اورانیوم جذبشده تمایل دارد که در بافتهای استخوانی انباشته شود به دلیل تمایل اورانیوم به فسفاتها.[۴۵] اورانیوم وارد شده به بدن تبدیل به یونهای اورانیل میشود که در استخوانها، کبد، کلیه و بافتهای تولیدمثل انباشته میشوند.[۱۰۶]
سمیت رادیولوژیکی و شیمیایی اورانیوم با این واقعیت ترکیب میشود که عناصر با عدد اتمی بالا مانند اورانیوم از طریق جذب پرتوهای گاما و اشعه ایکس طبیعی و انتشار دوباره فوتوالکترونها، سمی رادیوگرافیک ثانویه یا خیالی از خود ساطع میکنند که در ترکیب با تمایل بالای اورانیوم به فسفاتهای DNA باعث افزایش شکستهای تکرشتهای و دوقسمتی DNA میشود.[۱۰۷]
اورانیوم از طریق پوست جذب نمیشود و ذرات آلفا که توسط اورانیوم منتشر میشوند، نمیتوانند از پوست عبور کنند.[۱۰۸]
اورانیوم میتواند از سطوح فولادی که آلوده به اورانیوم هستند، تمیز شود[۱۰۹] و از آبخوانها.[۱۱۰][۱۱۱]
تأثیرات و احتیاطها
[ویرایش]عملکرد طبیعی کلیه، مغز، کبد، قلب و سایر سیستمها میتواند تحت تأثیر قرار گیرد، زیرا اورانیوم علاوه بر این که ضعیف رادیواکتیو است، یک سمیت فلزی نیز میباشد.[۴۵][۱۱۲][۱۱۳] اورانیوم همچنین یک توکسیکانت تولیدمثل است.[۱۱۴][۱۱۵]
تأثیرات رادیولوژیکی معمولاً محلی هستند زیرا تابش آلفا، که شکل اصلی تجزیه اورانیوم ۲۳۸ است، برد بسیار کوتاهی دارد و قادر به نفوذ در پوست نیست. تابش آلفا ناشی از اورانیوم استنشاقشده نشان داده است که میتواند باعث سرطان ریه در کارگران هستهای در معرض آن شود.[۱۱۶] در حالی که CDC یک مطالعه منتشر کرده است که نشان میدهد هیچگونه سرطان انسانی بهدلیل مواجهه با اورانیوم طبیعی یا اورانیوم کمشده مشاهده نشده است،[۱۱۷] اما مواجهه با اورانیوم و محصولات تجزیه آن، بهویژه رادون، یک تهدید جدی برای سلامت است.[۱۱۸] مواجهه با استرانسیم ۹۰, ید-۱۳۱ و سایر محصولات شکافت به اورانیوم مربوط نمیشود، اما ممکن است از طریق روشهای پزشکی یا مواجهه با سوخت هستهای مصرفشده یا سقوط از سلاحهای هستهای به وجود آید.[۱۱۹]
اگرچه استنشاق تصادفی غلظت بالای هگزافلوراید اورانیوم منجر به مرگهای انسانی شده است، اما این مرگها بیشتر بهدلیل تولید اسید هیدروفلوئوریک بسیار سمی و اورانیل فلورید بوده و نه خود اورانیوم.[۱۲۰] فلز اورانیوم ریزدانه بهدلیل ویژگی پیروفوریک خود خطر آتشسوزی ایجاد میکند؛ ذرات کوچک آن میتوانند در دمای اتاق بهطور خود به خودی در هوا مشتعل شوند.[۲۱]
فلز اورانیوم معمولاً با دستکشها بهعنوان یک احتیاط کافی دستچرخیده میشود.[۱۲۱] تمرکز اورانیوم بهگونهای نگهداری و بستهبندی میشود که از استنشاق یا بلع آن توسط افراد جلوگیری شود.[۱۲۱]
توضیحات
[ویرایش]واژهنامه
[ویرایش]جستارهای وابسته
[ویرایش]- en:K-65 residues
- en:List of uranium projects
- en:Lists of nuclear disasters and radioactive incidents
- en:Nuclear and radiation accidents and incidents
- en:World Uranium Hearing
- چرخه سوخت توریوم
- چرخه سوخت هستهای
- فهرست کشورها بر پایه تولید اورانیم
- فهرست کشورها بر پایه ذخایر اورانیوم
- فیزیک هستهای
- مهندسی هستهای
منابع
[ویرایش]- ↑ Meija, J.; et al. (2016). "Atomic weights of the elements 2013 (IUPAC Technical Report)". شیمی محض و کاربردی(نشریه). 88 (3): 265–91. doi:10.1515/pac-2015-0305.
- ↑ Morss, L.R.; Edelstein, N.M.; Fuger, J., eds. (2006). The Chemistry of the Actinide and Transactinide Elements (3rd ed.). Netherlands: Springer. ISBN 978-9048131464.
- ↑ "Uranium". Encyclopaedia Britannica. Retrieved 22 April 2017.
- ↑ Weapons of Mass Destruction (WMD): Uranium Isotopes (به انگلیسی), Wikidata Q91488549
- ↑ "WWW Table of Radioactive Isotopes". Lawrence Berkeley National Laboratory, Berkeley, US. Archived from the original on 27 April 2007.
- ↑ ۶٫۰ ۶٫۱ ۶٫۲ ۶٫۳ (Emsley 2001، ص. 479).
- ↑ "U.S. to pump money into nuke stockpile, increase security," RIA Novosti 18 February 2010
- ↑ https://www.iaea.org/sites/default/files/19/11/pris.pdf
- ↑ ۹٫۰ ۹٫۱ ۹٫۲ (Emsley 2001، ص. 477).
- ↑ Klaproth, M. H. (1789). "Chemische Untersuchung des Uranits, einer neuentdeckten metallischen Substanz". Chemische Annalen. 2: 387–403.
- ↑ "Uranium". The American Heritage Dictionary of the English Language (4th ed.). Houghton Mifflin Company. Archived from the original on 27 July 2011. Retrieved 6 July 2020.
- ↑ Péligot, E. -M. (1842). "Recherches Sur L'Uranium". Annales de chimie et de physique. 5 (5): 5–47.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ (Emsley 2001، ص. 478).
- ↑ "The Electric Journal". Westinghouse Club. 10 April 1920 – via Google Books.
- ↑ Gillett, Horace Wadsworth; Mack, Edward Lawrence (10 April 1917). "Preparation of ferro-uranium". Govt. print. off. – via Google Books.
- ↑ Mines, United States Bureau of (10 April 1917). "Technical Paper - Bureau of Mines". The Bureau – via Google Books.
- ↑ «Chicago Pile One». large.stanford.edu. دریافتشده در ۲۰۲۰-۱۲-۱۱.
- ↑ Walsh, J. (1981-06-19). "A Manhattan project postscript". Science (New York, N.Y.). 212 (4501): 1369–1371. doi:10.1126/science.212.4501.1369. ISSN 0036-8075. PMID 17746246.
- ↑ Glaser, Alexander; von Hippel, Frank N. (2006-02). "Thwarting nuclear terrorism". Scientific American. 294 (2): 56–63. doi:10.1038/scientificamerican0206-56. ISSN 0036-8733. PMID 16478027.
{{cite journal}}: Check date values in:|date=(help) - ↑ ۲۰٫۰ ۲۰٫۱ ۲۰٫۲ ۲۰٫۳ ۲۰٫۴ ۲۰٫۵ "Uranium". The McGraw-Hill Science and Technology Encyclopedia (5th ed.). The McGraw-Hill Companies, Inc. 2005. ISBN 978-0-07-142957-3.
- ↑ ۲۱٫۰۰ ۲۱٫۰۱ ۲۱٫۰۲ ۲۱٫۰۳ ۲۱٫۰۴ ۲۱٫۰۵ ۲۱٫۰۶ ۲۱٫۰۷ ۲۱٫۰۸ ۲۱٫۰۹ ۲۱٫۱۰ ۲۱٫۱۱ ۲۱٫۱۲ ۲۱٫۱۳ ۲۱٫۱۴ ۲۱٫۱۵ Hammond, C. R. (2000). The Elements, in Handbook of Chemistry and Physics (PDF) (81st ed.). CRC press. ISBN 978-0-8493-0481-1.
- ↑ "Uranium". Royal Society of Chemistry.
- ↑ "Lead". Royal Society of Chemistry.
- ↑ "Tungsten". Royal Society of Chemistry.
- ↑ "Gold". Royal Society of Chemistry.
- ↑ ۲۶٫۰ ۲۶٫۱ ۲۶٫۲ ۲۶٫۳ ۲۶٫۴ ۲۶٫۵ "uranium". Columbia Electronic Encyclopedia (6th ed.). Columbia University Press. Archived from the original on 27 July 2011. Retrieved 27 September 2008.
- ↑ ۲۷٫۰ ۲۷٫۱ "uranium". Encyclopedia of Espionage, Intelligence, and Security. The Gale Group, Inc. Archived from the original on 27 July 2011. Retrieved 27 September 2008.
- ↑ Rollett, A. D. (2008). Applications of Texture Analysis. John Wiley and Sons. p. 108. ISBN 978-0-470-40835-3.
- ↑ ۲۹٫۰ ۲۹٫۱ ۲۹٫۲ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامGrentheوارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Emsley, John (2003). Nature's Building Blocks: An A-Z Guide to the Elements (به انگلیسی). Oxford University Press. ISBN 978-0-19-850340-8.
- ↑ Biever, Celeste (27 July 2005). "First measurements of Earth's core radioactivity". New Scientist. Retrieved July 7, 2022.
- ↑ "Potassium-40 heats up Earth's core". physicsworld.com. 7 May 2003. Retrieved 14 January 2007.
- ↑ ۳۳٫۰ ۳۳٫۱ ۳۳٫۲ Emsley 2001, p. 480.
- ↑ Schnug, E. , Sun, Y. , Zhang, L. , Windmann, H. , Lottermoser, B.G. , Ulrich, A. E. , Bol, R. , Makeawa, M. , and Haneklaus, S.H. (2023) "Elemental loads with phosphate fertilizers – a constraint for soil productivity?" In: Bolan, N.S. and Kirkham, M.B. (eds.) Managing Soil Constraints for Sustaining Productivity. CRC Press.
- ↑ "History/Origin of Chemicals". NASA. Retrieved 1 January 2013.
- ↑ Burbidge, E. M.; Burbidge, G. R.; Fowler, W. A.; Hoyle, F. (1957). "Synthesis of the Elements in Stars". Reviews of Modern Physics. 29 (4): 547. Bibcode:1957RvMP...29..547B. doi:10.1103/RevModPhys.29.547.
- ↑ Clayton, Donald D. (1968). Principles of Stellar Evolution and Nucleosynthesis. New York: Mc-Graw-Hill. pp. 577–91. ISBN 978-0-226-10953-4.
- ↑ Trenn, Thaddeus J. (1978). "Thoruranium (U-236) as the extinct natural parent of thorium: The premature falsification of an essentially correct theory". Annals of Science. 35 (6): 581–97. doi:10.1080/00033797800200441.
- ↑ Tissot, François L. H.; Dauphas, Nicolas; Grossmann, Lawrence (4 March 2016). "Origin of uranium isotope variations in early solar nebula condensates". Science Advances. 2 (3): e1501400. arXiv:1603.01780. Bibcode:2016SciA....2E1400T. doi:10.1126/sciadv.1501400. PMC 4783122. PMID 26973874.
- ↑ Min, M.; Xu, H.; Chen, J.; Fayek, M. (2005). "Evidence of uranium biomineralization in sandstone-hosted roll-front uranium deposits, northwestern China". Ore Geology Reviews. 26 (3–4): 198. Bibcode:2005OGRv...26..198M. doi:10.1016/j.oregeorev.2004.10.003.
- ↑ Koribanics, N. M.; Tuorto, S. J.; Lopez-Chiaffarelli, N.; McGuinness, L. R.; Häggblom, M. M.; Williams, K. H.; Long, P. E.; Kerkhof, L. J. (2015). "Spatial Distribution of an Uranium-Respiring Betaproteobacterium at the Rifle, CO Field Research Site". PLOS ONE. 10 (4): e0123378. Bibcode:2015PLoSO..1023378K. doi:10.1371/journal.pone.0123378. PMC 4395306. PMID 25874721.
- ↑ Renshaw, J. C.; Butchins, L. J. C.; Livens, F. R.; et al. (June 2005). "Bioreduction of uranium: environmental implications of a pentavalent intermediate". Environmental Science & Technology. 39 (15): 5657–5660. Bibcode:2005EnST...39.5657R. doi:10.1021/es048232b. PMID 16124300.
- ↑ Vitesse, GF; Morris, K; Natrajan, LS; Shaw, S (January 2020). "Multiple Lines of Evidence Identify U(V) as a Key Intermediate during U(VI) Reduction by Shewanella oneidensis MR1". Environmental Science & Technology. 54 (4): 2268–2276. Bibcode:2020EnST...54.2268V. doi:10.1021/acs.est.9b05285. PMID 31934763.
- ↑ Emsley 2001, pp. 476 and 482.
- ↑ ۴۵٫۰ ۴۵٫۱ ۴۵٫۲ ۴۵٫۳ ۴۵٫۴ ۴۵٫۵ Emsley 2001, p. 477.
- ↑ Macaskie, L. E.; Empson, R. M.; Cheetham, A. K.; Grey, C. P. & Skarnulis, A. J. (1992). "Uranium bioaccumulation by a Citrobacter sp. as a result of enzymically mediated growth of polycrystalline HUO
2PO
4". Science. 257 (5071): 782–784. Bibcode:1992Sci...257..782M. doi:10.1126/science.1496397. PMID 1496397. - ↑ Anderson, R. T.; Vrionis, H. A.; Ortiz-Bernad, I.; Resch, C. T.; Long, P. E.; Dayvault, R.; Karp, K.; Marutzky, S.; Metzler, D. R.; Peacock, A.; White, D. C.; Lowe, M.; Lovley, D. R. (2003). "Stimulating the in situ activity of Geobacter species to remove uranium from the groundwater of a uranium-contaminated aquifer". Applied and Environmental Microbiology. 69 (10): 5884–5891. Bibcode:2003ApEnM..69.5884A. doi:10.1128/AEM.69.10.5884-5891.2003. PMC 201226. PMID 14532040.
- ↑ Gadd, G. M. (March 2010). "Metals, minerals and microbes: geomicrobiology and bioremediation". Microbiology. 156 (Pt 3): 609–643. doi:10.1099/mic.0.037143-0. PMID 20019082.
- ↑ Nilgiriwala, K.S.; Alahari, A.; Rao, A. S. & Apte, S.K. (2008). "Cloning and Overexpression of Alkaline Phosphatase PhoK from Sphingomonas sp. Strain BSAR-1 for Bioprecipitation of Uranium from Alkaline Solutions". Applied and Environmental Microbiology. 74 (17): 5516–5523. Bibcode:2008ApEnM..74.5516N. doi:10.1128/AEM.00107-08. PMC 2546639. PMID 18641147.
- ↑ ۵۰٫۰ ۵۰٫۱ ۵۰٫۲ ۵۰٫۳ "World Uranium Mining". World Nuclear Association. Retrieved 31 January 2023.
- ↑ Emsley 2001, p. 479.
- ↑ Seaborg 1968, p. 774.
- ↑ "Athabasca Basin, Saskatchewan". Retrieved 4 September 2009.
- ↑ Gupta, C. K. & Mukherjee, T. K. (1990). Hydrometallurgy in extraction processes. Vol. 1. CRC Press. pp. 74–75. ISBN 978-0-8493-6804-2.
- ↑ "Uranium production". Our World in Data. Retrieved 6 March 2020.
- ↑ ۵۶٫۰ ۵۶٫۱ "Uranium Supplies: Supply of Uranium – World Nuclear Association". www.world-nuclear.org.
- ↑ ۵۷٫۰ ۵۷٫۱ ۵۷٫۲ ۵۷٫۳ ۵۷٫۴ "Global Uranium Resources to Meet Projected Demand". International Atomic Energy Agency. 2006. Retrieved 29 March 2007. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «IAEAResourcesDemand» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ "Uranium Mining and Processing in South Australia". South Australian Chamber of Mines and Energy. 2002. Archived from the original on 6 January 2012. Retrieved 14 January 2007.
{{cite web}}: نگهداری یادکرد:پیوند نامناسب (link) - ↑ Ngoupana, P. -M.; Felix, B. (2011). Barker, A. (ed.). "Areva suspends CAR uranium mine project". Central African Republic News. Retrieved 7 March 2020.
- ↑ "Military Warheads as a Source of Nuclear Fuel". World-nuclear.org. Retrieved 24 May 2010.
- ↑ "Megatons to Megawatts". U.S. Enrichment Corp. Archived from the original on July 16, 2008.
- ↑ ۶۲٫۰ ۶۲٫۱ "Uranium recovery from Seawater". Japan Atomic Energy Research Institute. 23 August 1999. Archived from the original on 17 October 2009. Retrieved 3 September 2008. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «UseaWater» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ ۶۳٫۰ ۶۳٫۱ "How long will nuclear energy last?". 12 February 1996. Archived from the original on 10 April 2007. Retrieved 29 March 2007. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «stanfordCohen» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Tsezos, M.; Noh, S. H. (1984). "Extraction of uranium from sea water using biological origin adsorbents". The Canadian Journal of Chemical Engineering. 62 (4): 559–561. doi:10.1002/cjce.5450620416.
- ↑ "ORNL technology moves scientists closer to extracting uranium from seawater". Oak Ridge National Laboratory, United States. 21 August 2012. Archived from the original on 25 August 2012. Retrieved 22 February 2013.
- ↑ "Fueling nuclear power with seawater". Pnnl.gov. 21 August 2012. Archived from the original on 25 August 2012. Retrieved 22 February 2013.
- ↑ ۶۷٫۰ ۶۷٫۱ "NUEXCO Exchange Value (Monthly Uranium Spot)". Archived from the original on 12 December 2007. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «uraniumingo» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ "World Uranium Production". UxC Consulting Company, LLC. Archived from the original on 27 February 2007. Retrieved 11 February 2007.
- ↑ Mithridates (24 July 2008). "Page F30: Kazakhstan to surpass Canada as the world's largest producer of uranium by last year (2009)". Mithridates.blogspot.com. Archived from the original on 4 March 2010. Retrieved 12 September 2008.
{{cite web}}: نگهداری یادکرد:پیوند نامناسب (link) - ↑ "Kazakistan uranyum üretimini artıracak". Zaman.com.tr (به ترکی استانبولی). Zaman Gazetesi. 28 July 2008. Archived from the original on 13 January 2009. Retrieved 12 September 2008.
- ↑ "In Situ Leach Mining (ISL) of Uranium – World Nuclear Association". www.world-nuclear.org. Retrieved 2021-05-06.
- ↑ ۷۲٫۰ ۷۲٫۱ "Big Uranium Find Announced in Somalia". The New York Times. 16 March 1968. Retrieved 16 May 2014. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «Bufais» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ ۷۳٫۰ ۷۳٫۱ "Lack of fuel may limit U.S. nuclear power expansion". Massachusetts Institute of Technology. 21 March 2007. Retrieved 29 March 2007. خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «MITfuelSupply» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Deffeyes, Kenneth S. & MacGregor, Ian D. (January 1980). "World Uranium Resources". Scientific American. 242 (1): 66. Bibcode:1980SciAm.242a..66D. doi:10.1038/scientificamerican0180-66. OSTI 6665051.
- ↑ ۷۵٫۰ ۷۵٫۱ ۷۵٫۲ "Exploration drives uranium resources up 17%". World-nuclear-news.org. Retrieved 12 September 2008.
- ↑ "Uranium Supplies: Supply of Uranium - World Nuclear Association". www.world-nuclear.org.
- ↑ "Uranium Mining and Processing in South Australia". South Australian Chamber of Mines and Energy. 2002. Archived from the original on 6 January 2012. Retrieved 14 January 2007.
- ↑ Ngoupana, P. -M.; Felix, B. (2011). Barker, A. (ed.). "Areva suspends CAR uranium mine project". Central African Republic News. Retrieved 7 March 2020.
- ↑ "Military Warheads as a Source of Nuclear Fuel". World-nuclear.org. Archived from the original on 24 February 2013. Retrieved 24 May 2010.
- ↑ "ORNL technology moves scientists closer to extracting uranium from seawater". Oak Ridge National Laboratory, United States. 21 اوت 2012. Archived from the original on 25 August 2012. Retrieved 22 February 2013.
- ↑ "Fueling nuclear power with seawater". Pnnl.gov. 21 August 2012. Archived from the original on 25 August 2012. Retrieved 22 February 2013.
- ↑ "World Uranium Production". UxC Consulting Company, LLC. Archived from the original on 27 February 2007. Retrieved 11 February 2007.
- ↑ Mithridates (24 July 2008). "Page F30: Kazakhstan to surpass Canada as the world's largest producer of uranium by last year (2009)". Mithridates.blogspot.com. Archived from the original on 4 June 2023. Retrieved 12 September 2008.
- ↑ "Kazakistan uranyum üretimini artıracak". Zaman.com.tr (به ترکی استانبولی). Zaman Gazetesi. 28 ژوئیه 2008. Archived from the original on 13 January 2009. Retrieved 12 September 2008.
- ↑ Deffeyes, Kenneth S. & MacGregor, Ian D. (January 1980). "World Uranium Resources". Scientific American. 242:1 (1): 66. Bibcode:1980SciAm.242a..66D. doi:10.1038/scientificamerican0180-66. OSTI 6665051.
- ↑ Kloprogge, J. Theo; Ponce, Concepcion P.; Loomis, Tom A. (2021). The periodic table: nature's building blocks: an introduction to the naturally occurring elements, their origins and their uses. Amsterdam: Elsevier. pp. 861–862. ISBN 978-0-12-821538-8. OCLC 1223058470.
- ↑ ۸۷٫۰۰ ۸۷٫۰۱ ۸۷٫۰۲ ۸۷٫۰۳ ۸۷٫۰۴ ۸۷٫۰۵ ۸۷٫۰۶ ۸۷٫۰۷ ۸۷٫۰۸ ۸۷٫۰۹ ۸۷٫۱۰ ۸۷٫۱۱ ۸۷٫۱۲ ۸۷٫۱۳ ۸۷٫۱۴ خطای یادکرد: برچسب
<ref>نامعتبر؛ نام «Seaborg1968» چندین بار با محتوای متفاوت تعریف شده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ ۸۸٫۰ ۸۸٫۱ ۸۸٫۲ "Chemical Forms of Uranium". Argonne National Laboratory. Archived from the original on 22 September 2006. Retrieved 18 February 2007.
- ↑ ۸۹٫۰ ۸۹٫۱ ۸۹٫۲ ۸۹٫۳ Puigdomenech, Ignasi (2004) Hydra/Medusa Chemical Equilibrium Database and Plotting Software. مؤسسه سلطنتی فناوری کیتیاچ
- ↑ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties", Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A, doi:10.1016/j.nuclphysa.2003.11.001
- ↑ (Seaborg 1968، ص. 777).
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامEncyChem773وارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ "Uranium Enrichment". Argonne National Laboratory. Archived from the original on 24 January 2007. Retrieved 11 February 2007.
- ↑ ۹۴٫۰ ۹۴٫۱ Diehl, Peter. "Depleted Uranium: a by-product of the Nuclear Chain". Laka Foundation. Archived from the original on 13 January 2013. Retrieved 31 July 2009.
- ↑ Duarte, F. J.; Hillman, L. W., eds. (1990). Dye Laser Principles. Academic. p. 413. ISBN 978-0-12-222700-4. Archived from the original on 17 September 2010.
- ↑ "Development of DU Munitions". Depleted Uranium in the Gulf (II). Gulflink, official website of Force Health Protection & Readiness. 2000.
- ↑ (Emsley 2001، ص. 480).
- ↑ "Nuclear Weapon Design". Federation of American Scientists. 1998. Archived from the original on 26 December 2008. Retrieved 19 February 2007.
- ↑ "Statement regarding the Good Morning America broadcast," The Homer Laughlin China Co. بایگانیشده در ۱ آوریل ۲۰۱۲ توسط Wayback Machine, 16 March 2011, accessed 25 March 2012.
- ↑ "Dial R for radioactive – 12 July 1997 – New Scientist". Newscientist.com. Retrieved 12 September 2008.
- ↑ "EPA Facts about Uranium" (PDF). U.S. Environmental Protection Agency. Retrieved 20 September 2014.
- ↑ "Uranium Containing Dentures (ca. 1960s, 1970s)". Health Physics Historical Instrumentation Museum Collection. Oak Ridge Associated Universities. 1999. Retrieved 10 October 2013.
- ↑ "Radionuclide Basics: Uranium". U.S. Environmental Protection Agency. 16 February 2023. Retrieved 19 April 2023.
- ↑ "ToxFAQ for Uranium". Agency for Toxic Substances and Disease Registry. 18 March 2014. Retrieved 19 April 2023.
- ↑ "CDC – NIOSH Pocket Guide to Chemical Hazards – Uranium (insoluble compounds, as U)". National Institute for Occupational Safety and Health. 30 October 2019. Retrieved 19 April 2023.
- ↑ Permyakov, Eugene (2009). Metalloproteomics. Hoboken: John Wiley & Sons. p. 564. ISBN 978-0-470-44774-1. OCLC 609844907.
- ↑ Busby, C. and Schnug, E. (2008). "Advanced biochemical and biophysical aspects of uranium contamination". In: De Kok, L.J. and Schnug, E. (Eds) Loads and Fate of Fertilizer Derived Uranium. Backhuys Publishers, Leiden, The Netherlands. شابک ۹۷۸−۹۰−۵۷۸۲−۱۹۳−۶
- ↑ خطای یادکرد: خطای یادکرد:برچسب
<ref> غیرمجاز؛ متنی برای یادکردهای با نامepaوارد نشده است. (صفحهٔ راهنما را مطالعه کنید.). - ↑ Francis, A. J.; Dodge, C. J.; McDonald, J. A.; Halada, G. P. (2005). "Decontamination of uranium-contaminated steel surfaces by hydroxycarboxylic acid with uranium recovery". Environmental Science & Technology. 39 (13): 5015–21. Bibcode:2005EnST...39.5015F. doi:10.1021/es048887c. PMID 16053105.
- ↑ Gandhi, T. Pushparaj; Sampath, Prasanna Venkatesh; Maliyekkal, Shihabudheen M. (2022-06-15). "A critical review of uranium contamination in groundwater: Treatment and sludge disposal". The Science of the Total Environment. 825: 153947. Bibcode:2022ScTEn.82553947G. doi:10.1016/j.scitotenv.2022.153947. ISSN 1879-1026. PMID 35189244. S2CID 246988421.
- ↑ Prusty, Sourav; Somu, Prathap; Sahoo, Jitendra Kumar; Panda, Debasish; Sahoo, Sunil Kumar; Sahoo, Shraban Kumar; Lee, Yong Rok; Jarin, T.; Sundar, L. Syam; Rao, Koppula Srinivas (December 2022). "Adsorptive sequestration of noxious uranium (VI) from water resources: A comprehensive review". Chemosphere. 308 (Pt 1): 136278. Bibcode:2022Chmsp.30836278P. doi:10.1016/j.chemosphere.2022.136278. ISSN 1879-1298. PMID 36057349. S2CID 251999162.
- ↑ Craft, E. S.; Abu-Qare, A. W.; Flaherty, M. M.; Garofolo, M. C.; Rincavage, H. L. & Abou-Donia, M. B. (2004). "Depleted and natural uranium: chemistry and toxicological effects" (PDF). Journal of Toxicology and Environmental Health Part B: Critical Reviews. 7 (4): 297–317. Bibcode:2004JTEHB...7..297C. CiteSeerX 10.1.1.535.5247. doi:10.1080/10937400490452714. PMID 15205046. S2CID 9357795.
- ↑ Agency for Toxic Substances and Disease Registry (ATSDR) (February 2013). "2. Relevance to Public Health" (PDF). Toxicological Profile for Uranium (Report). Atlanta, GA: U.S. Department of Health and Human Services, Public Health Service. pp. 11–38. CAS# 7440-61-1.
- ↑ Hindin, Rita; Brugge, D.; Panikkar, B. (2005). "Teratogenicity of depleted uranium aerosols: A review from an epidemiological perspective". Environ Health. 4 (1): 17. Bibcode:2005EnvHe...4...17H. doi:10.1186/1476-069X-4-17. PMC 1242351. PMID 16124873.
- ↑ Arfsten, D. P.; Still, K. R.; Ritchie, G. D. (2001). "A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development". Toxicology and Industrial Health. 17 (5–10): 180–91. Bibcode:2001ToxIH..17..180A. doi:10.1191/0748233701th111oa. PMID 12539863. S2CID 25310165.
- ↑ Grellier, James; Atkinson, Will; Bérard, Philippe; Bingham, Derek; Birchall, Alan; Blanchardon, Eric; Bull, Richard; Guseva Canu, Irina; Challeton-de Vathaire, Cécile; Cockerill, Rupert; Do, Minh T; Engels, Hilde; Figuerola, Jordi; Foster, Adrian; Holmstock, Luc; Hurtgen, Christian; Laurier, Dominique; Puncher, Matthew; Riddell, Tony; Samson, Eric; Thierry-Chef, Isabelle; Tirmarche, Margot; Vrijheid, Martine; Cardis, Elisabeth (2017). "Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides". Epidemiology. 28 (5): 675–684. doi:10.1097/EDE.0000000000000684. PMC 5540354. PMID 28520643.
- ↑ "Public Health Statement for Uranium" (PDF). CDC. Retrieved 5 May 2023.
- ↑ Radon Exposures to Workers at the Fernald Feed Materials Production Center. Page reviewed: April 8, 2020. U.S. National Institute for Occupational Safety and Health (NIOSH)
- ↑ Chart of the Nuclides, US Atomic Energy Commission 1968
- ↑ Dart, Richard C. (2004). Medical Toxicology. Lippincott Williams & Wilkins. p. 1468. ISBN 978-0-7817-2845-4.
- ↑ ۱۲۱٫۰ ۱۲۱٫۱ "Radiation Fact Sheets #27, Uranium (U)". Washington State Department of Health, Office of Radiation Protection. 2010. Archived from the original on 28 September 2011. Retrieved 23 August 2011.
خطای یادکرد: برچسپ <ref> که با نام «FOOTNOTESeaborg1968779» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
پیوند به بیرون
[ویرایش]- U.S. EPA: Radiation Information for Uranium
- "What is Uranium?" from World Nuclear Association
- Nuclear fuel data and analysis from the U.S. Energy Information Administration
- Current market price of uranium
- World Uranium deposit maps
- Annotated bibliography for uranium from the Alsos Digital Library
- NLM Hazardous Substances Databank—Uranium, Radioactive
- CDC - NIOSH Pocket Guide to Chemical Hazards
- Mining Uranium at Namibia's Langer Heinrich Mine
- World Nuclear News
- ATSDR Case Studies in Environmental Medicine: Uranium Toxicity U.S. Department of Health and Human Services
- Uranium at The Periodic Table of Videos (University of Nottingham)
| جدول تناوبی | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| H | He | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |||||||||||||||||||||||||||||||||||||||||||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||



![تولید جهانی اورانیوم (معادن) و میزان تقاضا[۵۰]](http://upload.wikimedia.org/wikipedia/commons/thumb/7/75/U_production-demand.png/431px-U_production-demand.png)

![تولید اورانیوم در سال ۲۰۱۵، بر حسب تن[۵۵]](http://upload.wikimedia.org/wikipedia/commons/thumb/9/9a/Uranium_production%2C_OWID.svg/425px-Uranium_production%2C_OWID.svg.png)


