آبکاری الکترولیتی

آبکاری به روش الکترولیتی فرایندی است با استفاده از جریان برق برای کاهش کاتیون های فلز محلول به طوری که پوششی منسجم و نازک بر روی الکترود شکل بگیرد. این اصطلاح برای اکسیداسیون الکتریکی آنیون ها به یک ماده ی جامد نیز استفاده می شود، مثل شکل گیری کلرید نقره روی سیم نقره ای برای تولید الکترود نقره / نقره کلرید .آبکاری در درجه اول برای تغییر خواص سطح یک شی (مانند مقاومت در برابر سایش ، حفاظت در برابر خوردگی و کیفیت زیبایی شناسی) استفاده می شود، همچنین می تواند برای ایجاد ضخامت در قسمت هایی با اندازه کوچک یا برای ساخت اشیا با استفاده از الکتروفرمینگ استفاده شود.
پروسه ای که در این نوع آبکاری استفاده می شود، الکتروانباشت نامیده می شود . این فرایند همانند یک سلول غلظتی است که به صورت معکوس عمل می کند . بخشی که باید آبکاری شود ، کاتد آن مدار است. در یک روش، آند از فلزی که روی آن قسمت قرار می گیرد ساخته شده است. هر دو جزء در یک محلول به نام الکترولیت غوطه ورند که حاوی یک یا چند نمک فلزی محلول و همچنین یون های دیگر که اجازه عبور جریان برق را می دهند می باشد. یک منبع تغذیه جریان مستقیمی را به آند وصل می کنند، اتم های فلزی را اکسید می کند و اجازه می دهد تا در محلول حل شوند. در کاتد، یونهای فلزی محلول در محلول الکترولیت در حکم رابط بین محلول و کاتد کاهش می یابند. نرخ حل شدن آند برابر با نرخ پوشیده شدن کاتد است و بنابراین یون ها در حمام الکترولیتی به طور مداوم توسط آند جریان می یابند. [۱]
سایر فرایندهای آبکاری ممکن است از یک آند غیر قابل مصرف مانند سرب یا کربن استفاده کنند. در این تکنیک ها، یون های فلزی که پوشیده می شوند، باید به صورت دوره ای در حمام دوباره پر شوند. [۲] رایج ترین شکل استفاده از آبکاری برای ایجاد سکه ها، از جمله پنی های آمریکا است که از روی پوشیده شده در یک لایه مس پوشیده می شوند. [۳]
الکتروپولیش ، فرایندی که از جریان الکتریسیته برای حذف کاتیون های فلز از سطح یک شیء فلزی استفاده می شود، ممکن است به عنوان مخالف آبکاری در نظر گرفته شود. [۴]
تاریخچه
[ویرایش]


الکتروشیمی جدید توسط لوئیجی والنتینو بروناتلی در سال ۱۸۰۵ اختراع شد. بروناتلی اولین بار از اختراع همکارش الساندرو ولتا ، پیل ولتایی ، که این اختراع را پنج سال پیش از آن زمان انجام داده بود ، به منظور تسهیل آبکاری استفاده کرد . اختراعات وی توسط آکادمی علوم فرانسه سرکوب شده و برای صنایع به طور کلی برای سی سال استفاده نشد. سپس تا سال ۱۸۳۹، دانشمندان بریتانیای کبیر و روسیه به طور مستقل فرایندهای رسوب دهی فلزات مشابه با بروگناتلی را برای آبکاری فلزات چاپی صفحات چاپی طراحی و استفاده می کردند .
موریتس فون یاکوبی در روسیه نه تنها گالواناپوپلاستیک را دوباره کشف کرد، بلکه ساختار الکتریکی و مجسمه سازی گالوانیزه را نیز توسعه داد . گالوانیزه به سرعت در روسیه رواج پیدا کرد، با چنین افرادی نظیر پیتر باگرائتون مخترع، دانشمند هانریچ لنز و نویسنده علمی تخیلی ولادیمیر همه در توسعه تکنولوژی شریک بودهاند . از جمله بزرگ ترین موارد استفاده از آبکاری در اواسط قرن نوزدهم ،مربوط به زمانی است که روسیه مجسمه های غول پیکر گالوانوپلاستی کلیسای سنت ایزاک در سن پترزبورگ و گنبد طلایی گالوانیزه کلیسای مسیح نجات دهنده در مسکو ، بلندترین کلیسای ارتدوکس را ساخت.


اندکی پس از آن، جان رایت از بیرمنگام انگلستان کشف کرد که پتاسیم سیانید یک الکترولیت مناسب برای آبکاری طلا و نقره است. همکاران رایت، جورج الکینگتون و هنری الکینگتون نخستین جایزه را برای اختراع آبکاری در سال ۱۸۴۰ دریافت کردند. بعد از آن این دو نفر صنعت آبکاری در بیرمنگام را از آن جا که در سراسر جهان پخش می شد، تاسیس کرد. ژنراتور الکتریکی وولریچ در سال ۱۸۴۴، اکنون در تینکتنک، موزه علم بیرمنگام، اولین تولید کننده برق است که در صنعت استفاده می شود. [۵]
روند
[ویرایش]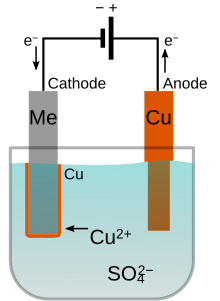
کاتیون ها با آنیون ها در محلول ارتباط دارند. این کاتیونها در کاتد کاهش می یابند تا در شکل فلزی، به حالت والانس صفر برسند . به عنوان مثال، برای مس در محلول اسید، مس با استفاده از دو الکترون در آند به Cu 2+ اکسیداسیون می شود. Cu 2+ با آنیون SO2−
4 در محلول برای تشکیل سولفات مس (II) واکنش می دهد . در کاتد ، Cu 2+ با گرفتن دو الکترون به فلز مس کاهش می یابد . در نتیجه ، مس از منبع آند به یک صفحه که کاتد را پوشش می دهد انتقال می یابد.
پوشش اغلب یک عنصر فلزی است ، نه یک آلیاژ . با این حال، برخی از آلیاژها به ویژه برنج می توانند به صورت الکترود باشند . آلیاژهای پوشیده شده آلیاژهای واقعی نیستند، یعنی محلول های جامدی هستند که بلورهای کوچک اندکی از فلزات پوشیده شده اند. در مورد لحیم کاری، گاهی اوقات لازم است که یک "آلیاژ واقعی" لازم باشد. آلیاژ واقعی مقاوم در برابر خوردگی بیشتر نسبت به آلیاژ گالوانیزه خواهد داشت.
رسوب الکتروشیمیایی
[ویرایش]رسوبات الکتروشیمیایی به طور کلی برای رشد فلزات و انجام اکسید فلزی به دلیل مزایای زیر استفاده می شود: ضخامت و مورفولوژی نانوساختار را می توان با تنظیم پارامترهای الکتروشیمیایی به طور دقیق کنترل کرد. تجهیزات این کار به دلیل عدم نیاز به یک خلاء بالا یا یک درجه حرارت بالا واکنشی ارزان قیمت است. [۶] [۷] [۸]
پالس آبکاری یا پالس الکترولیز (PED)
[ویرایش]یک اصلاح ساده در آبکاری الکترولیتی روش پالس است. این فرایند شامل پتانسیل یا جریان متناوب بین دو مقدار مختلف است که در نتیجه یک سری پالس هایی با دامنه و مدت زمان برابر به وحود می آید. با تغییر دامنه و عرض پالس، می توان ترکیب و ضخامت ماده پوشیده شده را تغییر داد. [۹]
پارامترهای آزمایش الکتریکی پالس معمولاً شامل پیک جریان ، چرخه کار، فرکانس و جریان موثر است. جریان حداکثر تنظی جریان یا پتانسیل آبکاری است. پالس الکترولیز می تواند به بهبود کیفیت الکتریکی کمک کند و باعث ایجاد تنش داخلی در هنگام رسوب سریع شود. ترکیبی از چرخه کار کوتاه و فرکانس بالا می تواند ترک های سطحی را کاهش دهد. با این حال، برای حفظ جریان فعلی یا پتانسیل ثابت، ممکن است یک منبع تغذیه با عملکرد بالا برای ارائه پیک جریان و تغییر سریع مورد نیاز باشد. یکی دیگر از مشکلات رایج پالس آبکاری این است که مواد آندها می توانند در طول آبکاری الکتریکی معکوس ، پوشیده شوند ، مخصوصا برای الکترود ها هزینه بالا بوده و برخی ، مانند پلاتین ممکن است آلوده شوند.
اثرات
[ویرایش]آبکاری الکترولیتی برخی خواص شیمیایی، فیزیکی و مکانیکی قطعه کار را تغییر می دهد. یک نمونه از تغییر شیمیایی زمانی است که پوشش نیکل مقاومت در برابر خوردگی را بهبود می بخشد . یک نمونه از تغییر فیزیکی تغییر در ظاهر بیرونی است. یک نمونه از تغییرات مکانیکی تغییر در مقاومت کششی یا سختی سطح است که ویژگی مورد نیاز در صنعت ابزار است.به عنوان مثال آبکاری اسید طلا در مدار های مس یا نیکل تحت پوشش، مقاومت و همچنین سختی سطح را کاهش می دهد.
آبکاری الکترولیتی می تواند به عنوان یک راه برای تبدیل یک بخش فلزی رادیواکتیو ، با استفاده از یک محلول آبی تهیه شده از کنسانتره نیکل فسفر که حاوی یون های هیپوفسفیت رادیواکتیو پتاسیم است استفاده شود.
جستار های وابسته
[ویرایش]منابع
[ویرایش]- ↑ Dufour, 2006 & IX-1.
- ↑ (Dufour، 2006 و IX-2)
- ↑ "US Mint Virtual Tour". US Mint. Archived from the original on 2012-11-02.
- ↑ https://www.electro-glo.com/faqs/
- ↑ Birmingham Museums trust catalogue, accession number: 1889S00044
- ↑ [۱], "Electrochemical synthesis of ceramic films and powders"
- ↑ Gal-Or, L.; Silberman, I.; Chaim, R. (1991). "Electrolytic ZrO2 Coatings: I. Electrochemical Aspects". Journal of the Electrochemical Society. 138 (7): 1939. doi:10.1149/1.2085904.
- ↑ Ju, Hyungkuk; Lee, Jae-Kwang; Lee, Jongmin; Lee, Jaeyoung (2012). "Fast and selective Cu2O nanorod growth into anodic alumina templates via electrodeposition". Current Applied Physics. 12: 60. doi:10.1016/j.cap.2011.04.042.
- ↑ Chandrasekar, M. S.; Pushpavanam, Malathy (2008). "Pulse and pulse reverse plating—Conceptual, advantages and applications". Electrochimica Acta. 53 (8): 3313–3322. doi:10.1016/j.electacta.2007.11.054.
کتابشناسی
[ویرایش]- Dufour, Jim (2006). An Introduction to Metallurgy (5th ed.). Cameron.[بدون شابک]
