تقویت طولانی مدت

در علوم اعصاب، تقویت طولانی مدت (LTP) (به انگلیسی: long-term potentiation) تقویت مداوم سیناپسها بر اساس الگوهای فعالیت اخیر است. اینها الگوهای فعالیت سیناپسی هستند که باعث افزایش طولانی مدت در انتقال سیگنال بین دو نورون میشوند. نقطه مقابل LTP رکود طولانی مدت (LTD) است که باعث کاهش طولانی مدت در قدرت سیناپسی میشود.[۲]
تقویت طولانی مدت یکی از چندین پدیده زیربنایی انعطافپذیری سیناپسی است، که توانایی سیناپسهای شیمیایی برای تغییر قدرت است. همانطور که تصور میشود حافظه و خاطرهها با اصلاح قدرت سیناپسی کدگذاری میشوند[۳] و LTP بهطور گسترده یکی از مکانیسمهای سلولی اصلی است که زمینه یادگیری و حافظه را فراهم میکند.[۲][۳]
LTP در هیپوکامپ خرگوش توسط Terje Lømo در سال ۱۹۶۶ کشف شد و از آن زمان به عنوان یک موضوع محبوب تحقیق باقی مانده است. بسیاری از مطالعههای LTP مدرن به دنبال درک بهتر زیستشناسی آن هستند، در حالی که برخی دیگر با هدف ترسیم یک ارتباط علّی بین LTP و یادگیری رفتاری هستند. با این حال، بعضی تلاش میکنند روشهایی دارویی یا روشهای دیگر، برای تقویت LTP برای بهبود یادگیری و حافظه ایجاد کنند. LTP همچنین موضوع تحقیقهای بالینی، در زمینه بیماری آلزایمر و اعتیاد است.
کشف
[ویرایش]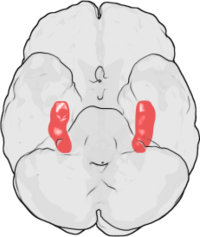
LTP اولین بار توسط Terje Lømo در سال ۱۹۶۶ در اسلو، نروژ، و در آزمایشگاه Per Andersen مشاهده شد. Lømo یک سری آزمایشهای عصبی فیزیولوژیکی را روی خرگوشهای بیهوش انجام داد تا نقش هیپوکامپ در حافظه کوتاه مدت را کشف کند.[۴][۵] آزمایشهای لومو بر روی اتصالها یا سیناپسها از مسیر پرفورانت تا dentate gyrus متمرکز بود. این آزمایشها با تحریک الیاف پیشسیناپسی مسیر پرفورانت و ثبت پاسخها از مجموعهای از سلولهای پس سیناپسی dentate gyrus انجام شد. همانطور که انتظار میرفت، یک تک پالس تحریک الکتریکی به الیاف مسیر پرفورانت باعث ایجاد پتانسیلهای پس سیناپسی تحریکی (EPSPs) در سلولهای dentate gyrus شد. چیزی که Lømo بهطور غیرمنتظره مشاهده کرد این بود که اگر او ابتدا یک رشته از محرکها با فرکانس بالا را به فیبرهای پیش سیناپسی تحویل دهد، پاسخ سلولهای پس سیناپسی به این محرکهای تک پالس میتواند برای مدت طولانی افزایش یابد. هنگامی که چنین رشتهای از محرکها اعمال شد، محرکهای تک پالسی بعدی EPSPهای قوی تر و طولانی تر را در جمعیت سلولی پس سیناپسی برانگیخت. این پدیده، که به موجب آن یک محرک با فرکانس بالا میتواند یک افزایش طولانی مدت در پاسخ سلولهای پس سیناپسی به محرکهای تک پالس بعدی ایجاد کند، «تقویت طولانیمدت» نامیده شد.[۶][۷]
مدلها و نظریه
[ویرایش]
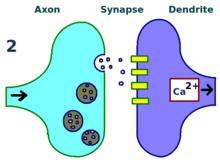

مکانیسم فیزیکی و بیولوژیکی LTP هنوز درک نشده است، اما برخی از مدلهای موفق توسعه یافتهاند.[۱] مطالعه بر روی خارهای دندریتی (dendritic spines)، ساختارهای بیرون زده روی دندریتهایی که بهطور فیزیکی در طی چند دقیقه یا چند ساعت رشد میکنند و جمع میشوند، رابطه ای بین مقاومت و رسانایی الکتریکی خارها و قدرت سیناپس مؤثر را نشان داده است، که این به دلیل ارتباط آنها با کلسیم داخل سلولی گذرا است. مدلهای ریاضی مانند تئوری BCM، که به کلسیم داخل سلولی در رابطه با مجرای یونی وابسته به ولتاژ گیرنده انامدیای (NMDA) نیز وابسته است، از دهه ۱۹۸۰ توسعه یافتهاند و مدل سنتی یادگیری بر اساس نظریه هبی را با توجیه بیولوژیکی و تجربی اصلاح میکنند.[۸]
اهمیت بالینی
[ویرایش]نقش LTP در بیماری کمتر از نقش آن در مکانیسمهای اساسی انعطافپذیری سیناپسی است. با این حال، تغییرها در LTP ممکن است به تعدادی از بیماریهای عصبی، از جمله افسردگی، بیماری پارکینسون، صرع و درد نوروپاتیک کمک کند. اختلال LTP همچنین ممکن است در بیماری آلزایمر و اعتیاد به مواد مخدر نقش داشته باشد.[۹]
بیماری آلزایمر
[ویرایش]
LTP در میان کسانی که بیماری آلزایمر (AD)، که یک بیماری تخریب کننده عصبی که باعث کاهش قابل توجه شناختی و زوال عقل میشود، را مطالعه میکنند، بسیار مورد توجه قرار گرفته است. بیشتر این زوال در ارتباط با تغییر دژنراتیو در هیپوکامپ و سایر ساختارهای لوب گیجگاهی رخ میدهد. به دلیل نقش ثابت هیپوکامپ در LTP، برخی پیشنهاد کردهاند که کاهش شناختی که در افراد مبتلا به AD مشاهده میشود ممکن است ناشی از اختلال LTP باشد.
در یک مطالعه مروری در سال ۲۰۰۳، Rowan و همکاران، یک مدل برای اینکه LTP چگونه ممکن است در AD تحت تأثیر قرار گیرد، پیشنهاد کرد. به نظر میرسد AD، حداقل تا حدی، ناشی از پردازش نادرست پروتئین پیش ساز آمیلوئید بتا (APP) باشد. نتیجه این پردازش غیرعادی، تجمع قطعههایی از این پروتئین به نام آمیلوئید بتا (Aβ) است. Aβ به دو شکل محلول و فیبریلار وجود دارد. پردازش نادرست APP منجر به تجمع Aβ محلول میشود که طبق فرضیه روآن، LTP هیپوکامپ را مختل میکند و ممکن است منجر به کاهش شناختی شود که در اوایل AD مشاهده میشود.[۱۰]
AD همچنین ممکن است LTP را از طریق مکانیسمهای متمایز از Aβ مختل کند. به عنوان مثال، یک مطالعه نشان داد که آنزیم PKMζ در پیچهای نوروفیبریلاری که یک نشانگر پاتولوژیک AD هستند، تجمع مییابد. PKMζ آنزیمی با اهمیت حیاتی در نگهداری LTP است.[۱۱]
اعتیاد به مواد مخدر
[ویرایش]تحقیق در زمینه پزشکی اعتیاد نیز اخیراً تمرکز خود را به LTP معطوف کرده است، با توجه به این فرضیه که اعتیاد به مواد مخدر نشان دهنده شکل قدرتمندی از یادگیری و حافظه است.[۱۲] اعتیاد یک پدیده عصبی-رفتاری پیچیده است که بخشهای مختلف مغز را درگیر میکند، مانند ناحیه تگمنتوم شکمی (VTA) و هسته آکومبنس (NAc). مطالعهها نشان دادهاند که سیناپسهای VTA و NAc میتوانند تحت LTP قرار گیرند[۱۲] و این LTP ممکن است مسئول رفتارهایی باشد که اعتیاد را مشخص میکند.[۱۳]
برای مطالعهٔ بیشتر
[ویرایش]- Bliss T, Collingridge G, Morris R (2004). Long-term potentiation: enhancing neuroscience for 30 years. Oxford: Oxford University Press. ISBN 978-0-19-853030-5.
- Andersen P, Morris R, Amaral D, Bliss T, O'Keefe J (2007). The hippocampus book. Oxford: Oxford University Press. pp. 350–474. ISBN 978-0-19-510027-3.
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ Paradiso, Michael A.; Bear, Mark F.; Connors, Barry W. (2007). Neuroscience: Exploring the Brain. Hagerstwon, MD: Lippincott Williams & Wilkins. p. 718. ISBN 978-0-7817-6003-4.
- ↑ ۲٫۰ ۲٫۱ Cooke SF, Bliss TV (July 2006). "Plasticity in the human central nervous system". Brain. 129 (Pt 7): 1659–73. doi:10.1093/brain/awl082. PMID 16672292.
- ↑ ۳٫۰ ۳٫۱ Bliss TV, Collingridge GL (January 1993). "A synaptic model of memory: long-term potentiation in the hippocampus". Nature. 361 (6407): 31–9. Bibcode:1993Natur.361...31B. doi:10.1038/361031a0. PMID 8421494. S2CID 4326182.
- ↑ Lømo T (April 2003). "The discovery of long-term potentiation". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 617–20. doi:10.1098/rstb.2002.1226. PMC 1693150. PMID 12740104.
- ↑ Lømo, Terje (1966). "Frequency potentiation of excitatory synaptic activity in the dentate area of the hippocampal formation". Acta Physiologica Scandinavica. 68 (Suppl 277): 128.
- ↑ Bliss TV, Lomo T (July 1973). "Long-lasting potentiation of synaptic transmission in the dentate area of the anaesthetized rabbit following stimulation of the perforant path". The Journal of Physiology. 232 (2): 331–56. doi:10.1113/jphysiol.1973.sp010273. PMC 1350458. PMID 4727084.
- ↑ Bliss TV, Gardner-Medwin AR (July 1973). "Long-lasting potentiation of synaptic transmission in the dentate area of the unanaestetized rabbit following stimulation of the perforant path". The Journal of Physiology. 232 (2): 357–74. doi:10.1113/jphysiol.1973.sp010274. PMC 1350459. PMID 4727085.
- ↑ McEachern JC, Shaw CA (June 1996). "An alternative to the LTP orthodoxy: a plasticity-pathology continuum model". Brain Research. Brain Research Reviews. 22 (1): 51–92. doi:10.1016/0165-0173(96)00006-9. PMID 8871785. S2CID 41680613. 8871785.
- ↑ Cooke SF, Bliss TV (July 2006). "Plasticity in the human central nervous system". Brain. 129 (Pt 7): 1659–73. doi:10.1093/brain/awl082. PMID 16672292.
- ↑ ۱۰٫۰ ۱۰٫۱ Rowan MJ, Klyubin I, Cullen WK, Anwyl R (April 2003). "Synaptic plasticity in animal models of early Alzheimer's disease". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 358 (1432): 821–8. doi:10.1098/rstb.2002.1240. PMC 1693153. PMID 12740129.
- ↑ Crary JF, Shao CY, Mirra SS, Hernandez AI, Sacktor TC (April 2006). "Atypical protein kinase C in neurodegenerative disease I: PKMzeta aggregates with limbic neurofibrillary tangles and AMPA receptors in Alzheimer disease". Journal of Neuropathology and Experimental Neurology. 65 (4): 319–26. doi:10.1097/01.jnen.0000218442.07664.04. PMID 16691113.
- ↑ ۱۲٫۰ ۱۲٫۱ Kauer JA, Malenka RC (November 2007). "Synaptic plasticity and addiction". Nature Reviews. Neuroscience. 8 (11): 844–58. doi:10.1038/nrn2234. PMID 17948030. S2CID 38811195.
- ↑ Wolf ME (August 2003). "LTP may trigger addiction". Molecular Interventions. 3 (5): 248–52. doi:10.1124/mi.3.5.248. PMID 14993438.

