هایپرپلازی خوشخیم پروستات
| هایپرپلازی خوشخیم پروستات | |
|---|---|
| نامهای دیگر | Benign enlargement of the prostate (BEP, BPE), adenofibromyomatous hyperplasia, benign prostatic hypertrophy, benign prostatic obstruction |
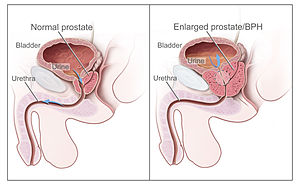 | |
| سمت راست نمایی از هایپرپلازی خوشخیم پروستات و سمت چپ تصویری از پروستات طبیعی | |
| تخصص | پزشکی مجاری ادراری |
| نشانهها | تکرر ادرار, مشکل در شروع ادرار, کاهش قطر ادرار, احتباس ادرار، بیاختیاری ادرار |
| عوارض | عفونت ادراری, سنگ مثانه, نارسایی کلیه |
| دورهٔ معمول آغاز | اغلب بالای ۴۰ سال |
| علت | نامشخص |
| عوامل خطر | سابقه خانوادگی, چاقی، دیابت نوع ۲, کمتحرکی, اختلال نعوظ |
| روش تشخیص | براساس شرح حال و معاینهبالینی و پس از رد سایر علل ایجادکننده علائم |
| تشخیص افتراقی | نارسایی قلب، دیابت، سرطان پروستات |
| درمان | تغییر سبک زندگی، درمان دارویی، جراحی |
| دارو | آلفابلوکر از قبیل ترازوسین و ۵-آلفا ردوکتاز مثل فیناستراید |
| فراوانی | ۱۰۵ میلیون درگیری سالیانه (۲۰۱۵) |
| طبقهبندی و منابع بیرونی | |
| پیشنت پلاس | هایپرپلازی خوشخیم پروستات |
هیپرپلازی خوشخیم پروستات (BPH), که بزرگی پروستات نیز نامیده میشود، افزایش غیر سرطانی اندازه غده پروستات است.[۱] علائم ممکن است شامل تکرر ادرار، مشکل در شروع ادرار کردن، جریان ضعیف ادرار، ناتوانی در ادرار کردن، یا بیاختیاری ادرار باشد.[۱] عوارض میتواند شامل عفونتهای مجاری ادراری، سنگ مثانه و مشکلات مزمن کلیه باشد.[۲]
علت بیماری نامشخص است[۱] عوامل خطر عبارتند از: سابقه خانوادگی، چاقی، دیابت نوع ۲، ورزش نکردن به اندازه کافی، و اختلال نعوظ.[۱] داروهایی مانند پسودوافدرین (pseudoephedrine)، آنتیکولینرژیکها (anticholinergics) و مسدودکنندههای کانال کلسیم (calcium channel blockers) ممکن است علائم را بدتر کنند.[۲] مکانیسم زمینهای این بیماری شامل به فشار آوردن پروستات روی میزراه، مجرای خروج ادرار، مربوط میشود و در نتیجه، خروج ادرار از مثانه را دشوار میسازد.[۱] تشخیص معمولاً بر اساس علائم و معاینه، پس از رد سایر علل احتمالی انجام میشود.[۲]
گزینه های درمانی برای BPH شامل تغییرات سبک زندگی، داروها، چندین پروسیجر، و جراحی است.[۱][۲] در افرادی با علائم خفیف، کاهش وزن، ورزش کردن و کاهش مصرف کافئین توصیه میشود، گرچه کیفیت شواهد برای تاثیر ورزش پایین است.[۲][۳] در کسانی که علائم قابل توجهتری دارند، ممکن است تجویز دارو شامل مسدودکنندههای آلفا (alpha blockers) مانند ترازوسین (terazosin) یا مهارکننده های 5α ردوکتاز (5α-reductase inhibitors) مانند فیناستراید (finasteride) انجام شود.[۱] در افرادی که با اقدامات دیگر بهبود نمییابند، ممکن است جراحی برای برداشتن بخشی از پروستات انجام شود.[۲] برخی از داروهای گیاهی که مورد مطالعه قرار گرفتهاند، مانند نخل ارهای، در این بیماری کمکی نشان ندادهاند.[۲] سایر داروهای گیاهی که تا حدودی در بهبود جریان ادرار مؤثر هستند، عبارتند از بتا-سیتوسترول [۴] از Hypoxis rooperi (علف ستارهای آفریقایی)، pygeum (استخراج شده از پوست Prunus africana)،[۵] دانه کدو تنبل (Cucurbita pepo)، و ریشه گزنه (Urtica dioica).[۶]
در سراسر جهان، حدود ۱۰۵ میلیون مرد تحت تاثیر BPH قرار دارند[۷] این بیماری معمولاً پس از ۴۰ سالگی شروع میشود.[۱] نیمی از مردان بالای ۵۰ سال به این بیماری مبتلا میشوند.[۲] پس از سن ۸۰ سالگی، تا حدود ۹۰ درصد از مردان تحت تاثیر قرار میگیرند.[۸][۹][۱] با اینکه سطح آنتیژن اختصاصی پروستات ممکن است در مردان مبتلا به BPH افزایش یابد، این وضعیت، خطر ابتلا به سرطان پروستات را افزایش نمیدهد.[۱۰]
علائم و نشانه ها[ویرایش]
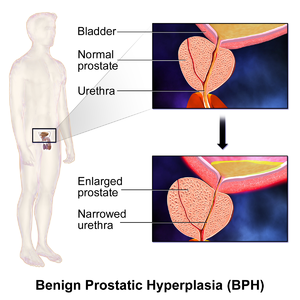
BPH شایعترین عامل ایجاد کننده علائم در دستگاه ادراری تحتانی است؛ این علائم به سه دسته تقسیم میشوند: علائم نگهداری، علائم دفع ادرار و علائمی که پس از ادرار کردن رخ میدهند.[۱۱] علائم نگهداری شامل نیاز به ادرار کردن مکرر، بیدار شدن در شب برای ادرار کردن، فوریت (نیاز شدید به دفع ادرار که نمیتوان آن را به تعویق انداخت)، ادرار اضطراری، از جمله ادرار اضطراری در شب، یا بیاختیاری ادرار ناشی از فوریت (نشت ادرار به دنبال نیاز ناگهانی شدید به ادرار کردن).[۱۲] علائم دفع ادرار شامل تزلزل ادراری (تاخیر بین شروع به ادرار کردن و شروع واقعی جریان ادرار)، جریان منقطع (نه مداوم)،[۱۳] قطع غیرارادی دفع ادرار، جریان ضعیف ادرار، زور زدن برای دفع ادرار، احساس تخلیه ناقص، و چکه کردن غیرقابل کنترل ادرار پس از پایان ادرار کردن.[۱۴][۱۵][۱۶] ممکن است این علائم با درد مثانه یا درد هنگام ادرار کردن، که به آن دیسوری (dysuria) گفته میشود، همراه باشد.[۱۷]
انسداد خروجی مثانه میتواند ناشی از BPH باشد.[۱۸] علائم آن عبارتند از: درد شکمی، احساس مداوم پری مثانه، تکرر ادرار، احتباس ادراری حاد (ناتوانی در دفع ادرار)، درد در طول ادرار کردن (دیسوری)، مشکلات در شروع ادرار (تزلزل ادرار)، جریان آهسته ادرار، شروع و توقف (ادرار منقطع) و شب ادراری.[۱۹]
BPH میتواند یک بیماری پیشرونده باشد، به خصوص اگر درمان نشود. تخلیه ناقص منجر به باقی ماندن ادرار یا استاز ادراری (urinary stasis) میشود که میتواند خطر عفونت مجاری ادراری را افزایش دهد[۲۰]
علل[ویرایش]
هورمون ها[ویرایش]
بسیاری از متخصصان بر این باورند که آندروژنها (تستوسترون و هورمون های مرتبط) نقش مهمی در ایجاد BPH دارند. این بدان معنی است که برای ایجاد BPH باید آندروژنها وجود داشته باشند، اما لزوما به طور مستقیم باعث ایجاد این بیماری نمیشوند. این موضوع با شواهدی تأیید میشود که نشان میدهد پسران اخته شده درسنین بالا دچار BPH نمیشوند. در یک مطالعه غیرمعمول روی ۲۶ خواجه از کاخ سلسله چینگ که در سال ۱۹۶۰ هنوز در پکن زندگی میکردند، در ۸۱ درصد از خواجه های مورد مطالعه، پروستات قابل لمس نبود.[۲۱] میانگین زمان سپری شده از موقع اخته شدن ۵۴ سال (بین ۴۱ تا ۶۵ سال) بود. از سوی دیگر، برخی مطالعات نشان میدهند که تجویز تستوسترون اگزوژن با افزایش قابل توجه خطر علائم BPH همراه نیست، بنابراین نقش تستوسترون در سرطان پروستات و BPH همچنان نامشخص است. برای تعیین کمیت هرگونه خطر ناشی از تجویز تستوسترون اگزوژن، انجام کارآزمایی های تصادفیسازی و کنترلشده بیشتری با تعداد شرکتکننده بیشتر مورد نیاز است.[۲۲]
دی هیدروتستوسترون ، متابولیت تستوسترون، یک واسطه کلیدی برای رشد پروستات است. DHT در پروستات از طریق عمل آنزیم 5α-ردوکتاز نوع ۲ بر روی تستوسترون جریان خون ساخته میشود. DHT میتواند به صورت اتوکرین روی سلولهای استرومایی یا به صورت پاراکرین با انتشار به سلولهای اپیتلیال مجاور، عمل کند. در هر دو نوع سلول هدف، DHT به گیرندههای آندروژن هستهای متصل میشود و رونویسی از فاکتورهای رشد را که برای سلولهای اپیتلیال و استرومایی میتوژنیک هستند، سیگنال میدهد. DHT ده برابر قویتر از تستوسترون است زیرا کندتر از گیرنده آندروژن جدا میشود. اهمیت DHT در ایجاد هیپرپلازی ندولار توسط مشاهدات بالینی که در آن مهار کننده 5α-ردوکتاز مانند فیناستراید به مردان مبتلا به این بیماری داده میشود، تایید میگردد. درمان با مهارکننده 5α-ردوکتاز به طور قابل توجهی میزان DHT پروستات را کاهش میدهد و در نتیجه، حجم پروستات و علائم BPH را کاهش میدهد[۲۳][۲۴]
تستوسترون باعث افزایش تکثیر سلولی پروستات میشود،[۲۵] اما در بیماران مبتلا به BPH سطح سرمی نسبتا پایینی از تستوسترون یافت میشود.[۲۶][۲۷] یک مطالعه کوچک نشان داده است که اختهسازی پزشکی، سطح هورمون در سرم و پروستات را به طور ناموزون کاهش میدهد و تأثیر کمتری بر سطح تستوسترون و DHT در پروستات دارد.[۲۸]
علاوه بر تستوسترون و DHT، سایر آندروژنها نیز نقش مهمی در ایجاد BPH دارند. Cاستروئیدهای ۲۱ کربنه ۱۱-اکسیژنه (پرگنان) که به عنوان پیشسازهای آندروژنهای ۱۱-اکسیژنه شناخته شدهاند، نیز آگونیستهای قوی برای گیرنده آندروژن هستند.[۲۹] به طور خاص، استروئیدهایی مانند 11β-هیدروکسی پروژسترون و ۱۱-کتوپروژسترون میتوانند به ۱۱-کتو دیهیدروتستوسترون، شکلی از DHT با ۱۱-اکسو و با همان قدرت، تبدیل شوند. این پیش سازها همچنین در نمونه های بیوپسی بافتی از بیماران مبتلا به BPH و همچنین در سطح سرم آنها شناسایی شدهاند[۳۰][۳۱][۳۲] علاوه بر آن، آندروژنهای بیوسنتز شده از طریق مسیر در پشتی میتوانند در ایجاد BPH نقش داشته باشند.[۳۰]
در حالی که شواهدی وجود دارد مبنی بر اینکه استروژن ممکن است در ایجاد BPH نقش داشته باشد، به نظر میرسد این اثر عمدتاً از طریق تبدیل موضعی آندروژنها به استروژن در بافت پروستات به جای اثر مستقیم خود استروژن ایجاد میشود[۳۳] در مطالعات درونتنی (in vivo) روی سگ، اخته سازی که منجر به کاهش قابل توجه سطح آندروژن اما بدون تغییر در سطح استروژن شد، آتروفی قابل توجهی در پروستات ایجاد کرد.[۳۴] مطالعاتی که به دنبال همبستگی میان هیپرپلازی پروستات و سطح استروژن سرم در انسان هستند، عموما هیچ ارتباطی را نشان ندادهاند.[۲۷][۳۵]
در سال ۲۰۰۸، گات و همکاران (.Gat et al)، شواهدی منتشر کردند مبنی بر اینکه BPH ناشی از نارسایی در سیستم درناژ وریدی اسپرماتیک است که منجر به افزایش فشار هیدرواستاتیک و افزایش سطح تستوسترون موضعی بیش از ۱۰۰ برابر بالاتر از سطح سرم میشود.[۳۶] در صورت تایید، این مکانیسم توضیح میدهد که چرا به نظر نمیرسد سطح آندروژن سرم با BPH ارتباط داشته باشد و چرا دادن تستوسترون اگزوژن تفاوت زیادی ایجاد نمیکند.
رژیم غذایی[ویرایش]
مطالعات نشان میدهند که الگوهای غذایی ممکن است بر پیشرفت BPH تأثیر بگذارد، اما تحقیقات بیشتری برای روشن شدن هر ارتباط مهمی مورد نیاز است.[۳۷] مطالعات انجام شده در چین نشان میدهند که مصرف بیشتر پروتئین ممکن است عاملی در ایجاد BPH باشد. مردان بالای ۶۰ سال در مناطق روستایی نرخ بسیار پایین BPH بالینی داشتند، در حالی که مردانی که در شهرها زندگی میکردند و پروتئین حیوانی بیشتری مصرف میکردند، بروز بالاتری داشتند.[۳۸][۳۹] از سوی دیگر، یک مطالعه روی مردان ژاپنی-آمریکایی در هاوایی، یک ارتباط منفی قوی با مصرف الکل، اما یک ارتباط مثبت ضعیف با مصرف گوشت گاو نشان داد.[۴۰] در یک مطالعه کوهورت آیندهنگر بزرگ در ایالات متحده (مطالعه پیگیری متخصصان سلامت)، محققان ارتباط متوسطی را بین BPH (مردانی با علائم شدید BPH یا BPH تایید شده با جراحی) و میزان دریافت کلی انرژی و پروتئین، اما نه با دریافت چربی، گزارش کردند.[۴۱] همچنین شواهد اپیدمیولوژیکی وجود دارد که BPH را با سندرم متابولیک (چاقی همزمان، اختلال در متابولیسم گلوکز و دیابت، سطوح بالای تری گلیسیرید، سطوح بالای کلسترول LDL و پرفشاری خون) مرتبط میکند.[۴۲]
پیری[ویرایش]
هیپرپلازی خوشخیم پروستات یک بیماری مرتبط وابسته به سن است. فرضیه پیری ناشی از تجمع سوء ترمیم (misrepair-accumulation aging theory) [۴۳] پیشنهاد میکند که ایجاد BPH نتیجه فیبروز و ضعیف شدن بافت عضلانی در پروستات است.[۴۴] بافت عضلانی در عملکرد پروستات مهم است و نیروی خروج مایع تولید شده توسط غدد پروستات را تامین میکند. با این حال، انقباضات و اتساعات مکرر تارهای عضلانی به طور اجتناب ناپذیری باعث آسیب و شکستگی آنها میشود. توانایی تارهای عضلانی برای بازسازی کم است؛ بنابراین، برای جایگزینی تارهای عضلانی شکسته شده، از فیبرهای کلاژن باید استفاده شود. چنین ترمیم های نادرستی، عملکرد بافت عضلانی را تضعیف میکند و مایع ترشح شده توسط غدد نمیتواند به طور کامل دفع شود. بدین ترتیب تجمع مایع در غدد، مقاومت بافت عضلانی را در طی انقباضات و اتساعات افزایش داده، و در نتیجه، تارهای عضلانی بیشتری شکسته و با فیبرهای کلاژن جایگزین خواهند شد.[۴۵]
پاتوفیزیولوژی[ویرایش]
با افزایش سن در مردان، فعالیت آنزیمهای آروماتاز و ۵-آلفا ردوکتاز افزایش مییابد. این آنزیمها به ترتیب مسئول تبدیل هورمون های آندروژن به استروژن و DHT هستند. متابولیزه شدن هورمون های آندروژن با این آنزیمها منجر به کاهش تستوسترون و در مقابل افزایش سطح DHT و استروژن میشود.
در BPH، هم سلولهای اپیتلیال غدهای و هم سلولهای استرومایی (شامل تارهای عضلانی) دچار هیپرپلازی میشوند.[۲] اکثر منابع بر این باورند که از بین این دو بافت، هیپرپلازی استرومایی غالب است، اما نسبت دقیق این دو نامشخص است.[۴۶]: 694
از نظر آناتومیکی، در این بیماری معمولا لوب های میانی و جانبی، به دلیل داشتن بافت غددی فراوان، بزرگ میشوند. لوب قدامی دارای بافت غددی کمی است و به ندرت بزرگ میشود. (سرطان کارسینوم پروستات به طور معمول در لوب خلفی رخ میدهد - از همین رو با معاینه رکتال میتوان بافت نامنظم آن را تشخیص داد). اولین علائم میکروسکوپی BPH معمولا بین سنین ۳۰ تا ۵۰ سالگی در ناحیه PUG، که در خلف مجرای ادراری پروگزیمال قرار دارد، شروع میشود.[۴۶]: 694 در BPH، اکثر رشد در ناحیه انتقال پروستات رخ میدهد.[۴۶]: 694 علاوه بر این دو ناحیه کلاسیک، ناحیه محیطی نیز به میزان کمتری درگیر میشود.[۴۶]: 695 سرطان پروستات به طور معمول در ناحیه PZ ایجاد میشود. با این حال، به منظور رد سرطان در ناحیه TZ، غالبا ندولهای BPH، معمولا از ناحیه TZ، تحت بیوپسی قرار میگیرند.[۴۶]: 695 BPH میتواند یک رشد پیشرونده داشته باشد که در موارد نادری منجر به بزرگ شدن غیرمعمول پروستات میشود.[۴۷] در برخی از مردان، بزرگی پروستات از ۲۰۰ تا ۵۰۰ گرم فراتر میرود.[۴۷] این وضعیت به عنوان هیپرپلازی غول پیکر تعریف شده است.[۴۷]
تشخیص[ویرایش]
تشخیص بالینی BPH بر اساس سابقه LUTS، معاینه انگشتی رکتوم، و رد سایر علل ایجاد کننده علائم و نشانه های مشابه انجام میشود. شدت LUTS لزوما با اندازه پروستات مطابقت ندارد. لمس غده پروستات بزرگ شده به صورت متقارن و صاف در معاینه رکتوم تشخیص BPH را تقویت میکند.[۲] با این حال، اگر غده پروستات در لمس نامتقارن، سفت یا ندولار باشد، شک به سرطان پروستات را مطرح میکند.[۲]
برای تشخیص BPH و تعیین شدت علائم، پرسشنامه های معتبری مانند شاخص علائم انجمن اورولوژی آمریکا (AUA-SI)،نمره بینالمللی علائم پروستات (I-PSS) و اخیراً نمره UWIN (فوریت، جریان ضعیف، تخلیه ناقص و شب ادراری) ابزارهای کمکی مفیدی هستند .[۲][۴۸][۴۹]
بررسی های آزمایشگاهی[ویرایش]
آزمایش ادرار به طور معمول در صورت وجود LUTS و مشکوک شدن به BPH انجام میشود تا علائم عفونت مجاری ادراری، وجود گلوکز در ادرار (نشاندهنده دیابت) یا پروتئین در ادرار (نشاندهنده بیماری کلیوی) را ارزیابی کند.[۲] اغلب آزمایش خون، شامل تستهای عملکرد کلیه و آنتیژن اختصاصی پروستات (PSA)، به ترتیب برای ارزیابی آسیب کلیه و سرطان پروستات، درخواست میشود.[۲]با این حال، بررسی سطح PSA خون برای غربالگری سرطان پروستات بحثبرانگیز است و لزوماً در هر ارزیابی برای BPH توصیه نمیشود.[۲] BPH و سرطان پروستات، هر دو میتوانند منجر به افزایش سطح PSA خون شوند و سطح بالای PSA به خوبی قادر به افتراق بین این دو بیماری نیست.[۲] در صورتی که سطح PSA بررسی شود و بالا باشد، نیاز به بررسی های بیشتر وجود دارد. اقداماتی از جمله اندازهگیری PSA توتال،PSA آزاد (free PSA)، معاینه رکتال و اولتراسونوگرافی ترانسرکتال ممکن است در تعیین اینکه آیا افزایش PSA ناشی از BPH یا سرطان پروستات است، مفید باشد.[۲]
تصویربرداری و دیگر بررسی ها[ویرایش]
اوروفلومتری (uroflowmetry) برای اندازهگیری سرعت جریان ادرار و حجم کل ادرار دفع شده در هنگام ادرار کردن فرد انجام میشود.[۵۰]
سونوگرافی شکمی از پروستات و کلیهها اغلب برای رد هیدرونفروز و اتساع حالب (hydroureter) انجام میشود. همچنین ممکن است کیست، تومور و سنگ به طور اتفاقی در سونوگرافی یافت شود. اگر حجم باقی مانده از ادرار در مثانه پس از ادرار کردن بیش از ۱۰۰ میلیلیتر باشد، میتواند نشان دهنده انسداد قابل توجه باشد.[۵۱] اندازه پروستات ۳۰ سیسی یا بیشتر نشان دهنده بزرگ شدن پروستات است.[۵۲]
کلسیفیکاسیون پروستات (رسوب کلسیم در غده پروستات) را میتوان از طریق سونوگرافی ترانس رکتال (TRUS) تشخیص داد. رسوب کلسیم ناشی از سفت شدن ترشحات پروستات یا اجسام آمیلاسه (توده های هیالین روی غده پروستات) کلسیفیه شده ایجاد میشود. کلسیفیکاسیون همچنین در بیماریهای مختلف دیگر مانند پروستاتیت، سندرم درد مزمن لگن و سرطان پروستات یافت میشود.[۵۳][۵۴] در کسانی که سطح PSA بالایی دارند، بیوپسی هدایت شده با TRUS برای نمونهبرداری از پروستات جهت بررسی انجام میشود.[۵۵] اگرچه MRI در تعیین حجم پروستات دقیقتر از TRUS است، اما TRUS کم هزینهتر است و تقریباً به اندازه MRI دقیق است. بنابراین، TRUS همچنان برای اندازهگیری حجم پروستات ترجیح داده میشود.[۵۶]
تشخیص افتراقی[ویرایش]
بیماریهای دیگر[ویرایش]
تشخیص افتراقی برای LUTS گسترده است و شامل وضعیت های پزشکی مختلف، اختلالات عصبی، و سایر بیماریهای مثانه، میزراه و پروستات مانند سرطان مثانه، عفونت مجاری ادراری، تنگی مجرای ادرار، سنگهای مجرای ادرار، پروستاتیت مزمن و سرطان پروستات است. [۲] مثانه نوروژنیک می تواند باعث احتباس ادرار شود و علائمی شبیه به علائم BPH ایجاد کند. این وضعیت ممکن است در نتیجه انقباض ناهماهنگ عضله مثانه یا اختلال در زمان بندی انقباض عضله مثانه و شل شدن اسفنکتر میزراه رخ دهد.[۲] علل قابل توجه مثانه نوروژنیک شامل اختلالات سیستم عصبی مرکزی مانند بیماری پارکینسون،مالتیپل اسکلروزیس، و آسیبهای نخاعی و همچنین اختلالات سیستم عصبی محیطی مانند دیابت، کمبود ویتامین B۱۲، و آسیب عصبی ناشی از الکل است .[۲] افراد مبتلا به نارسایی قلبی اغلب به دلیل توزیع مجدد مایع انباشته شده در پاهای متورم، شبها برای ادرار کردن از خواب بیدار میشوند.[۲]
داروها[ویرایش]
برخی از داروها میتوانند با افزایش مقاومت خروجی مثانه به دلیل افزایش تون عضلات صاف در پروستات یا گردن مثانه، مشکلات ادرار کردن را تشدید کنند و در ایجاد LUTS نقش داشته باشند.[۲] داروهای آگونیست آلفا-آدرنرژیک، مانند داروهای ضداحتقان با سودوافدرین می توانند مقاومت خروجی مثانه را افزایش دهند[۲] در مقابل، مسدودکنندههای کانال کلسیم و داروهای آنتیکولینرژیک میتوانند احتباس ادراری را از طریق شل کردن عضلات مثانه بدتر کنند.[۲] داروهای دیورتیک مانند دیورتیکهای لوپ (مانند فوروزماید) یا تیازیدها (مانند کلرتالیدون) میتوانند باعث تکرر ادرار و بیدار شدن شبانه برای ادرار کردن شوند یا آنها را بدتر کنند.[۲]
-
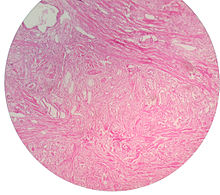
Micrograph showing nodular hyperplasia (left off center) of the prostate from a transurethral resection of the prostate (TURP). H&E stain.
-
Microscopic examination of different types of prostate tissues (stained with immunohistochemical techniques): A. Normal (non-neoplastic) prostatic tissue (NNT). B. Benign prostatic hyperplasia. C. High-grade prostatic intraepithelial neoplasia. D. Prostatic adenocarcinoma (PCA).
مدیریت[ویرایش]
در درمان و مدیریت BPH، هدف پیشگیری از عوارض مرتبط با بیماری و بهبود یا تسکین علائم است.[۵۷] رویکردهای مورد استفاده شامل اصلاح سبک زندگی، داروها، کاتتریزاسیون، و جراحی است.
سبک زندگی[ویرایش]
تغییرات سبک زندگی برای رفع علائم BPH شامل فعالیت بدنی[۵۸] کاهش مصرف مایعات قبل از خواب، تعدیل مصرف الکل و محصولات حاوی کافئین، و پیروی از یک برنامه زمانبندی شده دفع ادرار است.
بیماران همچنین میتوانند سعی کنند از محصولات و داروهایی با خواص آنتیکولینرژیک که ممکن است علائم احتباس ادراری BPH را تشدید کنند، از جمله آنتیهیستامینها، ضداحتقانها، مواد افیونی و ضدافسردگیهای سهحلقهای خودداری کنند. با این حال، تغییرات در داروها باید با نظر یک متخصص پزشکی انجام شود.[۵۹]
فعالیت بدنی[ویرایش]
فعالیت بدنی به عنوان درمانی برای علائم دستگاه ادراری توصیه شده است. مرور کاکرین در سال ۲۰۱۹ روی شش مطالعه با مجموع ۶۵۲ مرد، اثرات فعالیت بدنی به تنهایی، فعالیت بدنی به عنوان بخشی از یک برنامه خود مدیریتی و موارد دیگر را ارزیابی کرد. با این حال، کیفیت شواهد بسیار پایین بود و بنابراین همچنان نامشخص است که آیا فعالیت بدنی در مردانی که علائم ادراری ناشی از BPH را تجربه میکنند، مفید است یا خیر.[۶۰]
نحوه ادرار کردن[ویرایش]
نحوه ادرار کردن ممکن است بر پارامترهای اورودینامیک (سرعت جریان ادرار، مدت زمان دفع و حجم باقی مانده پس از دفع ادرار) تأثیر بگذارد.[۶۱] یک متاآنالیز هیچ تفاوتی را میان وضعیت ایستاده و نشسته ادرار کردن در مردان سالم پیدا نکرد، اما برای مردان مسن با LUTS، ادرار کردن در وضعیت نشسته-- [۶۲]
- حجم باقی مانده پس از دفع ادرار را کاهش داد؛
- حداکثر جریان ادرار را افزایش داد، قابل مقایسه با مداخله دارویی؛ و
- مدت زمان دفع ادرار را کاهش داد
این مشخصات اورودینامیک با خطر کمتر عوارض اورولوژیک مانند سیستیت و سنگ مثانه همراه است.
داروها[ویرایش]
دو دسته اصلی دارویی برای مدیریت BPH عبارتند از مسدود کنندههای آلفا و مهارکننده های ۵α-ردوکتاز.[۶۳]
مسدود کنندههای آلفا[ویرایش]
مسدود کنندههای انتخابی α۱ رایجترین گزینه برای درمان اولیه هستند[۶۴][۶۵][۶۶] آنها شامل آلفازوسین،[۶۷][۶۸] دوکسازوسین،[۶۹] سیلودوسین، تامسولوسین، ترازوسین، و نفتوپیدیل هستند.[۵۷] آنها در بهبود علائم مزیت کم تا متوسطی دارند.[۷۰][۵۷][۷۱] مسدودکنندههای انتخابی آلفا-۱ از نظر اثربخشی مشابه هستند اما عوارض جانبی کمی متفاوت دارند.[۷۰][۵۷][۷۱] مسدودکنندههای آلفا عضلات صاف پروستات و گردن مثانه را شل میکنند، و درنتیجه انسداد جریان ادرار را کاهش میدهند. عوارض جانبی رایج مسدودکنندههای آلفا عبارتند از: افت فشار خون ارتواستاتیک (احساس سبکی سر یا سرگیجه هنگام ایستادن یا کشش)، تغییرات انزال، اختلال نعوظ،[۷۲] سردرد، احتقان بینی، و ضعف. در مردان مبتلا به LUTS ناشی از بزرگی پروستات، ممکن است اثرات نفتوپیدیل، تامسولوسین و سیلودوسین بر علائم ادراری و کیفیت زندگی مشابه باشد.[۵۷] نفتوپیدیل و تامسولوسین ممکن است درجات مشابهی از عوارض جانبی ناخواسته جنسی داشته باشند اما عوارض جانبی ناخواسته کمتری نسبت به سیلودوسین دارند.[۵۷]
تامسولوسین و سیلودوسین مسدود کنندههای انتخابی گیرنده α۱ هستند که به طور انتخابی به جای اتصال به گیرنده α۱B در رگ های خونی، به گیرنده α۱A در پروستات متصل میشوند. مسدود کنندههای کمتر انتخابی گیرنده α۱ مانند ترازوسین و دوکسازوسین ممکن است فشار خون را کاهش دهند. پرازوسین، مسدود کننده قدیمیتر و کمتر انتخابی α۱-آدرنرژیک، گزینه خط اول درمان برای فشار خون بالا یا هیپرپلازی پروستات نیست؛ این دارو برای بیمارانی تجویز میشود که به طور همزمان به هر دو مشکل مبتلا هستند. داروهای قدیمیتر و غیرانتخابی مسدودکننده آلفا مانند فنوکسی بنزامین برای کنترل BPH توصیه نمیشوند.[۷۳] مسدودکنندههای آلفا غیرانتخابی مانند ترازوسین و دوکسازوسین نیز ممکن است نیاز به تنظیم تدریجی دوز داشته باشند، زیرا میتوانند فشار خون را پایین آورده و اگر پاسخ به دارو خیلی قوی باشد باعث سنکوپ (غش) شوند.
مهارکننده های 5α-ردوکتاز[ویرایش]
مهارکننده های ۵α-ردوکتاز شامل فیناستراید و دوتاستراید نیز ممکن است در افراد مبتلا به BPH استفاده شوند.[۷۴] این داروها آنزیم ۵α-ردوکتاز را مهار میکنند، که درنتیجه تولید DHT، هورمونی که مسئول بزرگ شدن پروستات است، را مهار میکنند. اثرات این داروها نسبت به مسدودکنندههای آلفا دیرتر ظاهر میشود، اما اثر آنها سالها تداوم دارد.[۷۵] در صورت استفاده همزمان با مسدود کنندههای آلفا، کارآزمایی های کوتاه مدت هیچ مزیتی را گزارش نکردند، اما در یک مطالعه طولانیمدتتر (۳ تا ۴ سال)، کاهش بیشتری در پیشرفت BPH به سمت احتباس ادراری حاد و نیاز به جراحی در مقایسه با مصرف هر یک از داروها به تنهایی، مشاهده شد، به ویژه در افرادی که علائم شدیدتر و پروستات بزرگتر داشتند.[۷۶][۷۷][۷۸] کارآزمایی های دیگر کاهش علائم را تایید کردهاند، به طوری که در یک کارآزمایی این اثر طی ۶ ماه حاصل شد و این اثر پس از قطع مصرف مسدودکننده آلفا همچنان حفظ شد.[۷۷][۷۹] عوارض جانبی شامل کاهش میل جنسی و اختلال انزال یا نعوظ است.[۸۰][۸۱] مهارکننده های ۵α-ردوکتاز در زنان باردار به دلیل تراتوژن بودن آنها به دلیل تداخل با متابولیسم تستوسترون جنین منع مصرف دارند، و به عنوان یک اقدام احتیاطی، زنان باردار نباید قرص های خرد شده یا شکسته این داروها را لمس کنند.[۸۲]
مهارکننده های فسفودیاستراز (PDE)[ویرایش]
مرور کاکرین در سال ۲۰۱۸ بر روی مطالعات انجام شده روی مردان بالای ۶۰ سال با LUTS متوسط تا شدید، تأثیر مهارکننده های فسفودیاستراز را در مقایسه با سایر داروها مورد بررسی قرار داد.[۸۳] این داروها ممکن است علائم ادراری را اندکی بهبود بخشند و ناراحتی ادراری را کاهش دهند، اما همچنین در مقایسه با دارونما (placebo) ممکن است عوارض جانبی بیشتری ایجاد کنند. شواهد موجود در این مرور نشان داد که احتمالاً هیچ تفاوتی بین PDE و مسدودکنندههای آلفا وجود ندارد، با این حال هنگامی که به صورت ترکیبی استفاده میشوند ممکن است بهبود بیشتری در علائم (با عوارض جانبی بیشتر) ایجاد کنند. همچنین به احتمال زیاد PDE در صورت استفاده ترکیبی با مهارکنندههای ۵α-ردوکتاز، علائم را بهبود میبخشد.
چندین مهارکننده فسفودی استراز-۵ نیز مؤثر هستند، اما ممکن است برای حفظ جریان کافی ادرار به استفاده از چندین دوز در روز نیاز باشد.[۸۴][۸۵] تادالافیل، یک مهارکننده فسفودیاستراز ۵، توسط NICE در بریتانیا برای درمان علائم مرتبط با BPH در نظر گرفته شد و سپس رد شد.[۸۶] در سال ۲۰۱۱، سازمان غذا و داروی ایالات متحده، تادالافیل را برای درمان علائم و نشانه های BPH، و برای درمان BPH و اختلال نعوظ، زمانی که این شرایط به طور همزمان رخ دهد، تایید کرد.[۸۷]
سایر داروها[ویرایش]
از عوامل آنتیموسکارینی مانند تولترودین نیز ممکن است استفاده شود، به ویژه در ترکیب با مسدود کنندههای آلفا.[۸۸] آنها با کاهش اثرات استیلکولین بر روی عضله صاف مثانه عمل میکنند، بنابراین به کنترل علائم مثانه بیش فعال کمک میکنند.[۸۹]
خود سوندگذاری[ویرایش]
سوندگذاری متناوب ادراری برای تخلیه مثانه در افراد مبتلا به احتباس ادرار استفاده میشود. زمانی که تخلیه کامل مثانه دشوار یا غیرممکن است، خود سوندگذاری یک گزینه در درمان BPH است.[۹۰] عفونت مجاری ادراری شایعترین عارضه سوندگذاری متناوب است.[۹۱] چندین روش و انواع سوند ها در دسترس است، از جمله سوند های استریل (یک بار مصرف) و تمیز (چند بار مصرف)، اما بر اساس اطلاعات فعلی، هیچ کدام در کاهش بروز عفونت دستگاه ادراری نسبت به سایرین برتری ندارد.[۹۲]
جراحی[ویرایش]
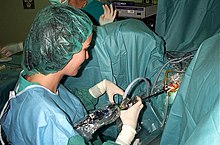
در صورتی که درمان دارویی مؤثر نباشد، ممکن است جراحی انجام شود. تکنیکهای جراحی مورد استفاده شامل موارد زیر است:
- رزکسیون پروستات از طریق مجرای ادرار: به عنوان استاندارد طلایی شناخته میشود.[۹۳] تصور میشود که TURP مؤثرترین روش برای بهبود علائم ادراری و جریان ادرار است، با این حال، این روش جراحی ممکن است با عوارضی در ۲۰ درصد از مردان همراه باشد.[۹۳] جراحی خطرات ایجاد عوارضی مانند انزال پسرونده (شایعترین)، اختلال نعوظ، بیاختیاری ادرار، تنگی مجرای ادرار را به همراه دارد.[۹۴]
- برش پروستات از طریق مجرای ادرار: این روش به ندرت انجام میشود؛ تکنیک آن مشابه TURP است اما تاثیرگذاری کمتری دارد.
- پروستاتکتومی باز: با وجود نتایج بسیار خوب، امروزه به دلیل عوارض بالای آن معمولا انجام نمیشود.
سایر روشهای جراحی کمتر تهاجمی (که نیاز به بیحسی نخاعی دارند) عبارتند از:
- ابلیشن پروستات با لیزر هولمیوم
- انوکلاسیون پروستات با لیزر هولمیوم
- تبخیر پروستات از طریق مجرای ادرار با لیزر تولیوم
- تبخیر فتوسلکتیو پروستات
- آکوابلیشنتراپی: نوعی جراحی با استفاده از فشار آب (water jet) برای برداشتن بافت پروستات.
روشهای کمتهاجمی[ویرایش]
برخی روشهای کمتهاجمی با توجه به ترجیحات بیماران و بیماریهای همراه در دسترس هستند. این اقدامات به صورت سرپایی با بیحسی موضعی انجام میگیرند.
- آمبولیزاسیون شریان پروستات: یک پروسیجر درون عروقی در رادیولوژی مداخلهای.[۹۵] از طریق کاتترها، عوامل آمبولیک در شاخه های اصلی شریان پروستات آزاد میشوند تا باعث کاهش اندازه غده پروستات و در نتیجه کاهش علائم ادراری شوند.[۹۶]
- درمان حرارتی با بخار آب (با نام تجاری Rezum): این روش یک پروسیجر جدیدتر در مطب برای برداشتن بافت پروستات با استفاده از بخار آب با هدف حفظ عملکرد جنسی است.
- لیفت مجرای ادراری پروستات (با نام تجاری UroLift): این مداخله شامل مجموعهای از یک دستگاه و یک ایمپلنت است که برای دور کردن لوب پروستات از مجرای ادرار طراحی شده است.[۹۷]
- گرمادرمانی مایکروویو ترانساورترال یک روش سرپایی است که در مقایسه با جراحی کمتر تهاجمی است و شامل استفاده از امواج مایکروویو (گرما) برای کوچک کردن بافت بزرگ شده پروستات است.[۹۳]
- دستگاه قابل کاشت موقت نیتینول: وسیلهای است که در مجرای ادرار قرار داده میشود و پس از آزاد شدن، منبسط شده و شکل مجرای ادرار و گردن مثانه را تغییر میدهد.[۹۸]
طب جایگزین[ویرایش]
در حالی که داروهای گیاهی به طور رایج برای BPH استفاده میشوند، یک مرور در سال ۲۰۱۶ نشان داد که گیاهان مورد مطالعه بهتر از دارونماها نیستند[۹۹] به ویژه، چندین مرور نشان داد که عصاره نخل ارهای، که از پرمصرفترین داروهای گیاهی در این مورد است، در کاهش علائم و کوچک کردن پروستات، تفاوتی با دارونما ندارد.[۱۰۰][۱۰۱][۱۰۲]
اپیدمیولوژی[ویرایش]

در سطح جهان، BPH تا سال ۲۰۱۰ حدود ۲۱۰ میلیون مرد (۶ درصد از جمعیت) را تحت تاثیر قرار داده است. (۶% of the population).[۱۰۴]
پروستات در اکثر مردان با افزایش سن بزرگتر میشود. برای یک مرد ۴۶ ساله بدون علائم، خطر ابتلا به BPH در ۳۰ سال آینده ۴۵ درصد است. نرخ بروز از ۳ مورد در هر ۱۰۰۰ نفر-سال در سنین ۴۵ تا ۴۹ سالگی به ۳۸ مورد در هر ۱۰۰۰ نفر-سال تا سنین ۷۵ تا ۷۹ سالگی افزایش مییابد. در حالی که نرخ شیوع برای مردان ۴۵ تا ۴۹ ساله ۲.۷ درصد است، در سن ۸۰ سالگی به ۲۴ درصد افزایش مییابد. [۱۰۵]
منابع[ویرایش]
- ↑ ۱٫۰ ۱٫۱ ۱٫۲ ۱٫۳ ۱٫۴ ۱٫۵ ۱٫۶ ۱٫۷ ۱٫۸ "Prostate Enlargement (Benign Prostatic Hyperplasia)". NIDDK. September 2014. Archived from the original on 4 October 2017. Retrieved 19 October 2017.
- ↑ ۲٫۰۰ ۲٫۰۱ ۲٫۰۲ ۲٫۰۳ ۲٫۰۴ ۲٫۰۵ ۲٫۰۶ ۲٫۰۷ ۲٫۰۸ ۲٫۰۹ ۲٫۱۰ ۲٫۱۱ ۲٫۱۲ ۲٫۱۳ ۲٫۱۴ ۲٫۱۵ ۲٫۱۶ ۲٫۱۷ ۲٫۱۸ ۲٫۱۹ ۲٫۲۰ ۲٫۲۱ ۲٫۲۲ ۲٫۲۳ ۲٫۲۴ Kim EH, Larson JA, Andriole GL (2016). "Management of Benign Prostatic Hyperplasia". Annual Review of Medicine (Review). 67: 137–51. doi:10.1146/annurev-med-063014-123902. PMID 26331999.
- ↑ Silva V, Grande AJ, Peccin MS (April 2019). "Physical activity for lower urinary tract symptoms secondary to benign prostatic obstruction". The Cochrane Database of Systematic Reviews. 2019 (4): CD012044. doi:10.1002/14651858.CD012044.pub2. PMC 6450803. PMID 30953341.
- ↑ Wilt T, Ishani A, MacDonald R, Stark G, Mulrow C, Lau J (1999). Wilt TJ (ed.). "Beta-sitosterols for benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 2011 (2): CD001043. doi:10.1002/14651858.CD001043. PMC 8407049. PMID 10796740.
- ↑ Wilt T, Ishani A, Mac Donald R, Rutks I, Stark G (1998). Wilt TJ (ed.). "Pygeum africanum for benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 1998 (1): CD001044. doi:10.1002/14651858.CD001044. PMC 7032619. PMID 11869585.
- ↑ Wilt TJ, Ishani A, Rutks I, MacDonald R (December 2000). "Phytotherapy for benign prostatic hyperplasia". Public Health Nutrition. 3 (4A): 459–72. doi:10.1017/S1368980000000549. PMID 11276294.
- ↑ Vos T, Allen C, Arora M, Barber RM, Bhutta ZA, Brown A, et al. (GBD 2015 Disease and Injury Incidence and Prevalence Collaborators) (October 2016). "Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990-2015: a systematic analysis for the Global Burden of Disease Study 2015". Lancet. 388 (10053): 1545–1602. doi:10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ Tavoosian A, Reis LO, Aluru P, Khajavi A, Aghamir SM (August 2022). "Comparison of Tamsulosin and Tadalafil effects in LUTS treatment considering patients' atherosclerosis risk level". Annals of Medicine and Surgery. 80: 104137. doi:10.1016/j.amsu.2022.104137. PMC 9283796. PMID 35846856.
- ↑ Chughtai B, Forde JC, Thomas DD, Laor L, Hossack T, Woo HH, et al. (May 2016). "Benign prostatic hyperplasia". Nature Reviews. Disease Primers. 2 (1): 16031. doi:10.1038/nrdp.2016.31. PMID 27147135. S2CID 3982305.
- ↑ Chang RT, Kirby R, Challacombe BJ (April 2012). "Is there a link between BPH and prostate cancer?". The Practitioner. 256 (1750): 13–6, 2. PMID 22792684.
- ↑ Lower urinary tract symptoms in men: management, NICE (National Institute for Health and Care Excellence)
- ↑ "Urge incontinence". MedlinePlus. US National Library of Medicine. Archived from the original on 6 October 2015. Retrieved 26 October 2015.
- ↑ White JR, O'Brien III DP, Walker HK, Hall WD, Hurst JW (1990). "Incontinence and Stream Abnormalities". Clinical Methods: The History, Physical, and Laboratory Examinations (3rd ed.). Boston: Butterworths. ISBN 9780409900774. PMID 21250138.
- ↑ Robinson J (11 February 2008). "Post-micturition dribble in men: causes and treatment". Nursing Standard. 22 (30): 43–6. doi:10.7748/ns2008.04.22.30.43.c6440. PMID 18459613.
- ↑ Sarma AV, Wei JT (July 2012). "Clinical practice. Benign prostatic hyperplasia and lower urinary tract symptoms". The New England Journal of Medicine. 367 (3): 248–57. doi:10.1056/nejmcp1106637. PMID 22808960.
- ↑ "Urination – difficulty with flow". MedlinePlus. US National Library of Medicine. Archived from the original on 6 October 2015. Retrieved 26 October 2015.
- ↑ "Urination – painful". MedlinePlus. US National Library of Medicine. Archived from the original on 6 October 2015. Retrieved 26 October 2015.
- ↑ "Bladder outlet obstruction". MedlinePlus. US National Library of Medicine. Archived from the original on 6 October 2015. Retrieved 26 October 2015.
- ↑ "Benign Prostatic Hyperplasia". The Lecturio Medical Concept Library. Retrieved 5 July 2021.
- ↑ Truzzi JC, Almeida FM, Nunes EC, Sadi MV (July 2008). "Residual urinary volume and urinary tract infection--when are they linked?". The Journal of Urology. 180 (1): 182–5. doi:10.1016/j.juro.2008.03.044. PMID 18499191.
- ↑ Wu CP, Gu FL (1991). "The prostate in eunuchs". Progress in Clinical and Biological Research. 370: 249–55. PMID 1924456.
- ↑ "Testosterone and Aging: Clinical Research Directions". NCBI Bookshelf. Archived from the original on 5 November 2017. Retrieved 2 February 2015.
- ↑ "Proscar (finisteride) Prescribing Information" (PDF). FDA – Drug Documents. Merck and Company. Archived (PDF) from the original on 3 March 2016. Retrieved 2 March 2015.
- ↑ Bartsch G, Rittmaster RS, Klocker H (April 2002). "Dihydrotestosterone and the concept of 5alpha-reductase inhibition in human benign prostatic hyperplasia". World Journal of Urology. 19 (6): 413–25. doi:10.1007/s00345-002-0248-5. PMID 12022710. S2CID 3257666.
- ↑ Feldman BJ, Feldman D (October 2001). "The development of androgen-independent prostate cancer". Nature Reviews. Cancer. 1 (1): 34–45. doi:10.1038/35094009. PMID 11900250. S2CID 205020623.
- ↑ Lagiou P, Mantzoros CS, Tzonou A, Signorello LB, Lipworth L, Trichopoulos D (1997). "Serum steroids in relation to benign prostatic hyperplasia". Oncology. 54 (6): 497–501. doi:10.1159/000227609. PMID 9394847.
- ↑ ۲۷٫۰ ۲۷٫۱ Roberts RO, Jacobson DJ, Rhodes T, Klee GG, Leiber MM, Jacobsen SJ (October 2004). "Serum sex hormones and measures of benign prostatic hyperplasia". The Prostate. 61 (2): 124–31. doi:10.1002/pros.20080. PMID 15305335. S2CID 24288565.
- ↑ Page ST, Lin DW, Mostaghel EA, Hess DL, True LD, Amory JK, et al. (October 2006). "Persistent intraprostatic androgen concentrations after medical castration in healthy men". The Journal of Clinical Endocrinology and Metabolism. 91 (10): 3850–6. doi:10.1210/jc.2006-0968. PMID 16882745.
- ↑ Dimitrakov J, Joffe HV, Soldin SJ, Bolus R, Buffington CA, Nickel JC (2008). "Adrenocortical hormone abnormalities in men with chronic prostatitis/chronic pelvic pain syndrome". Urology. 71 (2): 261–6. doi:10.1016/j.urology.2007.09.025. PMC 2390769. PMID 18308097.
- ↑ ۳۰٫۰ ۳۰٫۱ du Toit T, Swart AC (2020). "The 11β-hydroxyandrostenedione pathway and C11-oxy C21 backdoor pathway are active in benign prostatic hyperplasia yielding 11keto-testosterone and 11keto-progesterone". The Journal of Steroid Biochemistry and Molecular Biology. 196: 105497. doi:10.1016/j.jsbmb.2019.105497. PMID 31626910. S2CID 204734045.
- ↑ Masiutin MG, Yadav MK (2022). "Letter to the editor regarding the article "Adrenocortical hormone abnormalities in men with chronic prostatitis/chronic pelvic pain syndrome"". Urology (به انگلیسی). 169: 273. doi:10.1016/j.urology.2022.07.051. ISSN 0090-4295. PMID 35987379. S2CID 251657694.
- ↑ Dimitrakoff J, Nickel JC (2022). "Author reply". Urology (به انگلیسی). 169: 273–274. doi:10.1016/j.urology.2022.07.049. ISSN 0090-4295. PMID 35985522. S2CID 251658492.
- ↑ Ho CK, Nanda J, Chapman KE, Habib FK (June 2008). "Oestrogen and benign prostatic hyperplasia: effects on stromal cell proliferation and local formation from androgen". The Journal of Endocrinology. 197 (3): 483–91. doi:10.1677/JOE-07-0470. PMID 18492814.
- ↑ Niu YJ, Ma TX, Zhang J, Xu Y, Han RF, Sun G (March 2003). "Androgen and prostatic stroma". Asian Journal of Andrology. 5 (1): 19–26. PMID 12646998.
- ↑ Ansari MA, Begum D, Islam F (2008). "Serum sex steroids, gonadotrophins and sex hormone-binding globulin in prostatic hyperplasia". Annals of Saudi Medicine. 28 (3): 174–8. doi:10.4103/0256-4947.51727. PMC 6074428. PMID 18500180.
- ↑ Gat Y, Gornish M, Heiblum M, Joshua S (October 2008). "Reversal of benign prostate hyperplasia by selective occlusion of impaired venous drainage in the male reproductive system: novel mechanism, new treatment". Andrologia. 40 (5): 273–81. doi:10.1111/j.1439-0272.2008.00883.x. PMID 18811916. S2CID 205442245.
- ↑ Heber D (April 2002). "Prostate enlargement: the canary in the coal mine?". The American Journal of Clinical Nutrition. 75 (4): 605–6. doi:10.1093/ajcn/75.4.605. PMID 11916745.
- ↑ Zhang SX, Yu B, Guo SL, Wang YW, Yin CK (February 2003). "[Comparison of incidence of BPH and related factors between urban and rural inhabitants in district of Wannan]". Zhonghua Nan Ke Xue = National Journal of Andrology. 9 (1): 45–7. PMID 12680332.
- ↑ Gu F (March 1997). "Changes in the prevalence of benign prostatic hyperplasia in China". Chinese Medical Journal. 110 (3): 163–6. PMID 9594331.
- ↑ Chyou PH, Nomura AM, Stemmermann GN, Hankin JH (1993). "A prospective study of alcohol, diet, and other lifestyle factors in relation to obstructive uropathy". The Prostate. 22 (3): 253–64. doi:10.1002/pros.2990220308. PMID 7683816. S2CID 32639108.
- ↑ Suzuki S, Platz EA, Kawachi I, Willett WC, Giovannucci E (April 2002). "Intakes of energy and macronutrients and the risk of benign prostatic hyperplasia" (PDF). The American Journal of Clinical Nutrition. 75 (4): 689–97. doi:10.1093/ajcn/75.4.689. PMID 11916755.
- ↑ Gacci M, Corona G, Vignozzi L, Salvi M, Serni S, De Nunzio C, et al. (January 2015). "Metabolic syndrome and benign prostatic enlargement: a systematic review and meta-analysis". BJU International. 115 (1): 24–31. doi:10.1111/bju.12728. hdl:2158/953282. PMID 24602293. S2CID 22937831.
- ↑ Wang J, Michelitsch T, Wunderlin A, Mahadeva R (March 2009). "Aging as a consequence of misrepair--A novel theory of aging". Nature Precedings. arXiv:0904.0575. doi:10.1038/npre.2009.2988.1.
- ↑ Wang-Michelitsch J, Michelitsch T (2015). "Tissue fibrosis: a principal evidence for the central role of Misrepairs in aging". arXiv:1503.01376 [cs.DM].
- ↑ Roehrborn, Claus G (2005). "Benign Prostatic Hyperplasia: An Overview". Rev Urol. 7 (Suppl 9): S3–S14. PMC 1477638. PMID 16985902.
- ↑ ۴۶٫۰ ۴۶٫۱ ۴۶٫۲ ۴۶٫۳ ۴۶٫۴ Wasserman NF (September 2006). "Benign prostatic hyperplasia: a review and ultrasound classification". Radiologic Clinics of North America. 44 (5): 689–710, viii. doi:10.1016/j.rcl.2006.07.005. PMID 17030221.
- ↑ ۴۷٫۰ ۴۷٫۱ ۴۷٫۲ Ojewola RW, Tijani KH, Fatuga AL, Onyeze CI, Okeke CJ (2020). "Management of a giant prostatic enlargement: Case report and review of the literature". The Nigerian Postgraduate Medical Journal. Medknow. 27 (3): 242–247. doi:10.4103/npmj.npmj_69_20. PMID 32687126. S2CID 220652018.
- ↑ Parsons JK (December 2010). "Benign Prostatic Hyperplasia and Male Lower Urinary Tract Symptoms: Epidemiology and Risk Factors". Current Bladder Dysfunction Reports. 5 (4): 212–218. doi:10.1007/s11884-010-0067-2. PMC 3061630. PMID 21475707.
- ↑ Eid K, Krughoff K, Stoimenova D, Smith D, Phillips J, O'Donnell C, Barqawi A (January 2014). "Validation of the Urgency, Weak stream, Incomplete emptying, and Nocturia (UWIN) score compared with the American Urological Association Symptoms Score in assessing lower urinary tract symptoms in the clinical setting". Urology. 83 (1): 181–5. doi:10.1016/j.urology.2013.08.039. PMID 24139351.
- ↑ Gammie A, Drake MJ (August 2018). "The fundamentals of uroflowmetry practice, based on International Continence Society good urodynamic practices recommendations". Neurourology and Urodynamics. 37 (S6): S44–S49. doi:10.1002/nau.23777. PMID 30614059. S2CID 58586667.
- ↑ Foo KT (June 2013). "The Role of Transabdominal Ultrasound in Office Urology". Proceedings of Singapore Healthcare (به انگلیسی). 22 (2): 125–130. doi:10.1177/201010581302200208. ISSN 2010-1058. S2CID 74205747.
- ↑ Aprikian S, Luz M, Brimo F, Scarlata E, Hamel L, Cury FL, et al. (July 2019). "Improving ultrasound-based prostate volume estimation". BMC Urology. 19 (1): 68. doi:10.1186/s12894-019-0492-2. PMC 6657110. PMID 31340802.
- ↑ Kitzing YX, Prando A, Varol C, Karczmar GS, Maclean F, Oto A (January 2016). "Benign Conditions That Mimic Prostate Carcinoma: MR Imaging Features with Histopathologic Correlation". Radiographics. 36 (1): 162–175. doi:10.1148/rg.2016150030. PMC 5496681. PMID 26587887.
- ↑ Singh S, Martin E, Tregidgo HF, Treeby B, Bandula S (October 2021). "Prostatic calcifications: Quantifying occurrence, radiodensity, and spatial distribution in prostate cancer patients". Urologic Oncology. 39 (10): 728.e1–728.e6. doi:10.1016/j.urolonc.2020.12.028. PMC 8492071. PMID 33485763.
- ↑ Mitterberger M, Horninger W, Aigner F, Pinggera GM, Steppan I, Rehder P, Frauscher F (March 2010). "Ultrasound of the prostate". Cancer Imaging. 10 (1): 40–48. doi:10.1102/1470-7330.2010.0004. PMC 2842183. PMID 20199941.
- ↑ Lee JS, Chung BH (2007). "Transrectal ultrasound versus magnetic resonance imaging in the estimation of prostate volume as compared with radical prostatectomy specimens". Urologia Internationalis. 78 (4): 323–327. doi:10.1159/000100836. PMID 17495490. S2CID 10731245.
- ↑ ۵۷٫۰ ۵۷٫۱ ۵۷٫۲ ۵۷٫۳ ۵۷٫۴ ۵۷٫۵ Hwang EC, Gandhi S, Jung JH, Imamura M, Kim MH, Pang R, Dahm P (October 2018). "Naftopidil for the treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 2018 (10): CD007360. doi:10.1002/14651858.CD007360.pub3. PMC 6516835. PMID 30306544.
- ↑ Silva V, Grande AJ, Peccin MS (April 2019). "Physical activity for lower urinary tract symptoms secondary to benign prostatic obstruction". The Cochrane Database of Systematic Reviews. 2019 (4): CD012044. doi:10.1002/14651858.CD012044.pub2. PMC 6450803. PMID 30953341.
- ↑ "Benign prostatic hyperplasia". University of Maryland Medical Center. Archived from the original on 25 April 2017.
- ↑ Silva V, Grande AJ, Peccin MS, et al. (Cochrane Urology Group) (April 2019). "Physical activity for lower urinary tract symptoms secondary to benign prostatic obstruction". The Cochrane Database of Systematic Reviews. 2019 (4): CD012044. doi:10.1002/14651858.CD012044.pub2. PMC 6450803. PMID 30953341.
- ↑ De Jong Y, Pinckaers JH, Ten Brinck RM, Lycklama à Nijeholt AA. "Influence of voiding posture on urodynamic parameters in men: a literature review" (PDF). Nederlands Tijdschrift voor urologie. Archived (PDF) from the original on 14 July 2014. Retrieved 2 July 2014.
- ↑ de Jong Y, Pinckaers JH, ten Brinck RM, Lycklama à Nijeholt AA, Dekkers OM (2014). "Urinating standing versus sitting: position is of influence in men with prostate enlargement. A systematic review and meta-analysis". PLOS ONE. 9 (7): e101320. Bibcode:2014PLoSO...9j1320D. doi:10.1371/journal.pone.0101320. PMC 4106761. PMID 25051345.
- ↑ Silva J, Silva CM, Cruz F (January 2014). "Current medical treatment of lower urinary tract symptoms/BPH: do we have a standard?". Current Opinion in Urology. 24 (1): 21–8. doi:10.1097/mou.0000000000000007. PMID 24231531. S2CID 40954757.
- ↑ Roehrborn CG, Nuckolls JG, Wei JT, Steers W, et al. (BPH Registry and Patient Survey Steering Committee) (October 2007). "The benign prostatic hyperplasia registry and patient survey: study design, methods and patient baseline characteristics". BJU International. 100 (4): 813–9. doi:10.1111/j.1464-410X.2007.07061.x. hdl:2027.42/73286. PMID 17822462. S2CID 21001077.
- ↑ Black L, Naslund MJ, Gilbert TD, Davis EA, Ollendorf DA (March 2006). "An examination of treatment patterns and costs of care among patients with benign prostatic hyperplasia". The American Journal of Managed Care. 12 (4 Suppl): S99–S110. PMID 16551208.
- ↑ Hutchison A, Farmer R, Verhamme K, Berges R, Navarrete RV (January 2007). "The efficacy of drugs for the treatment of LUTS/BPH, a study in 6 European countries". European Urology. 51 (1): 207–15, discussion 215–6. doi:10.1016/j.eururo.2006.06.012. PMID 16846678.
- ↑ MacDonald R, Wilt TJ (October 2005). "Alfuzosin for treatment of lower urinary tract symptoms compatible with benign prostatic hyperplasia: a systematic review of efficacy and adverse effects". Urology. 66 (4): 780–8. doi:10.1016/j.urology.2005.05.001. PMID 16230138.
- ↑ Roehrborn CG (December 2001). "Efficacy and safety of once-daily alfuzosin in the treatment of lower urinary tract symptoms and clinical benign prostatic hyperplasia: a randomized, placebo-controlled trial". Urology. 58 (6): 953–9. doi:10.1016/S0090-4295(01)01448-0. PMID 11744466.
- ↑ MacDonald R, Wilt TJ, Howe RW (December 2004). "Doxazosin for treating lower urinary tract symptoms compatible with benign prostatic obstruction: a systematic review of efficacy and adverse effects". BJU International. 94 (9): 1263–70. doi:10.1111/j.1464-410X.2004.05154.x. PMID 15610102. S2CID 6640867.
- ↑ ۷۰٫۰ ۷۰٫۱ Wilt TJ, Mac Donald R, Rutks I (2003). Wilt T (ed.). "Tamsulosin for benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews (1): CD002081. doi:10.1002/14651858.CD002081. PMID 12535426.
- ↑ ۷۱٫۰ ۷۱٫۱ Djavan B, Marberger M (1999). "A meta-analysis on the efficacy and tolerability of alpha1-adrenoceptor antagonists in patients with lower urinary tract symptoms suggestive of benign prostatic obstruction". European Urology. 36 (1): 1–13. doi:10.1159/000019919. PMID 10364649. S2CID 73366414.
- ↑ Santillo VM, Lowe FC (2006). "Treatment of benign prostatic hyperplasia in patients with cardiovascular disease". Drugs & Aging. 23 (10): 795–805. doi:10.2165/00002512-200623100-00003. PMID 17067183. S2CID 24428368.
- ↑ AUA Practice Guidelines Committee (August 2003). "AUA guideline on management of benign prostatic hyperplasia (2003). Chapter 1: Diagnosis and treatment recommendations". The Journal of Urology. 170 (2 Pt 1): 530–47. doi:10.1097/01.ju.0000078083.38675.79. PMID 12853821.
- ↑ Blankstein U, Van Asseldonk B, Elterman DS (February 2016). "BPH update: medical versus interventional management" (PDF). The Canadian Journal of Urology. 23 (Suppl 1): 10–5. PMID 26924590. Archived (PDF) from the original on 7 August 2016.
- ↑ Roehrborn CG, Bruskewitz R, Nickel JC, McConnell JD, Saltzman B, Gittelman MC, et al. (Proscar Long-Term Efficacy Safety Study Group) (March 2004). "Sustained decrease in incidence of acute urinary retention and surgery with finasteride for 6 years in men with benign prostatic hyperplasia". The Journal of Urology. 171 (3): 1194–8. doi:10.1097/01.ju.0000112918.74410.94. PMID 14767299.
- ↑ Roehrborn CG, Barkin J, Tubaro A, Emberton M, Wilson TH, Brotherton BJ, Castro R (April 2014). "Influence of baseline variables on changes in International Prostate Symptom Score after combined therapy with dutasteride plus tamsulosin or either monotherapy in patients with benign prostatic hyperplasia and lower urinary tract symptoms: 4-year results of the CombAT study". BJU International. 113 (4): 623–35. doi:10.1111/bju.12500. PMID 24127818. S2CID 38243275.
- ↑ ۷۷٫۰ ۷۷٫۱ Greco KA, McVary KT (December 2008). "The role of combination medical therapy in benign prostatic hyperplasia". International Journal of Impotence Research. 20 (Suppl 3): S33-43. doi:10.1038/ijir.2008.51. PMID 19002123.
- ↑ Kaplan SA, McConnell JD, Roehrborn CG, Meehan AG, Lee MW, Noble WR, et al. (Medical Therapy of Prostatic Symptoms (MTOPS) Research Group) (January 2006). "Combination therapy with doxazosin and finasteride for benign prostatic hyperplasia in patients with lower urinary tract symptoms and a baseline total prostate volume of 25 ml or greater". The Journal of Urology. 175 (1): 217–20, discussion 220–1. doi:10.1016/S0022-5347(05)00041-8. PMID 16406915.
- ↑ Barkin J, Guimarães M, Jacobi G, Pushkar D, Taylor S, van Vierssen Trip OB (October 2003). "Alpha-blocker therapy can be withdrawn in the majority of men following initial combination therapy with the dual 5alpha-reductase inhibitor dutasteride". European Urology. 44 (4): 461–6. doi:10.1016/s0302-2838(03)00367-1. PMID 14499682.
- ↑ Gormley GJ, Stoner E, Bruskewitz RC, Imperato-McGinley J, Walsh PC, McConnell JD, et al. (October 1992). "The effect of finasteride in men with benign prostatic hyperplasia. The Finasteride Study Group". The New England Journal of Medicine. 327 (17): 1185–91. doi:10.1056/NEJM199210223271701. PMID 1383816.
- ↑ Gacci M, Ficarra V, Sebastianelli A, Corona G, Serni S, Shariat SF, et al. (June 2014). "Impact of medical treatments for male lower urinary tract symptoms due to benign prostatic hyperplasia on ejaculatory function: a systematic review and meta-analysis". The Journal of Sexual Medicine. 11 (6): 1554–66. doi:10.1111/jsm.12525. PMID 24708055.
- ↑ Deters L. "Benign Prostatic Hypertrophy Treatment & Management". Medscape. Archived from the original on 30 October 2015. Retrieved 14 November 2015.
- ↑ Pattanaik S, Mavuduru RS, Panda A, Mathew JL, Agarwal MM, Hwang EC, et al. (Cochrane Urology Group) (November 2018). "Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 2018 (11): CD010060. doi:10.1002/14651858.CD010060.pub2. PMC 6517182. PMID 30480763.
- ↑ Wang Y, Bao Y, Liu J, Duan L, Cui Y (January 2018). "Tadalafil 5 mg Once Daily Improves Lower Urinary Tract Symptoms and Erectile Dysfunction: A Systematic Review and Meta-analysis". Lower Urinary Tract Symptoms. 10 (1): 84–92. doi:10.1111/luts.12144. PMID 29341503. S2CID 23929021.
- ↑ Pattanaik S, Mavuduru RS, Panda A, Mathew JL, Agarwal MM, Hwang EC, et al. (November 2018). "Phosphodiesterase inhibitors for lower urinary tract symptoms consistent with benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 2018 (11): CD010060. doi:10.1002/14651858.CD010060.pub2. PMC 6517182. PMID 30480763.
- ↑ "Hyperplasia (benign prostatic) – tadalafil (terminated appraisal) (TA273)". National Institute for Health and Clinical Excellence (NICE). 23 January 2013. Archived from the original on 24 February 2013. Retrieved 27 January 2013.
- ↑ "FDA approves Cialis to treat benign prostatic hyperplasia". U.S. Food and Drug Administration (FDA). Archived from the original on 11 May 2013. Retrieved 7 May 2013.
- ↑ Kaplan SA, Roehrborn CG, Rovner ES, Carlsson M, Bavendam T, Guan Z (November 2006). "Tolterodine and tamsulosin for treatment of men with lower urinary tract symptoms and overactive bladder: a randomized controlled trial". JAMA. 296 (19): 2319–28. doi:10.1001/jama.296.19.2319. PMID 17105794.
- ↑ Abrams P, Andersson KE (November 2007). "Muscarinic receptor antagonists for overactive bladder". BJU International. 100 (5): 987–1006. doi:10.1111/j.1464-410x.2007.07205.x. PMID 17922784. S2CID 30983780.
- ↑ "Prostate enlargement (benign prostatic hyperplasia)". Harvard Health Content. Harvard Health Publications. Archived from the original on 3 April 2015. Retrieved 2 February 2015.
- ↑ Wyndaele JJ (October 2002). "Complications of intermittent catheterization: their prevention and treatment". Spinal Cord. 40 (10): 536–541. doi:10.1038/sj.sc.3101348. PMID 12235537.
- ↑ Prieto JA, Murphy CL, Stewart F, Fader M (October 2021). "Intermittent catheter techniques, strategies and designs for managing long-term bladder conditions". The Cochrane Database of Systematic Reviews. 10 (10): CD006008. doi:10.1002/14651858.CD006008.pub5. PMC 8547544. PMID 34699062.
- ↑ ۹۳٫۰ ۹۳٫۱ ۹۳٫۲ Franco JV, Garegnani L, Escobar Liquitay CM, Borofsky M, Dahm P (June 2021). "Transurethral microwave thermotherapy for the treatment of lower urinary tract symptoms in men with benign prostatic hyperplasia". The Cochrane Database of Systematic Reviews. 2021 (6): CD004135. doi:10.1002/14651858.CD004135.pub4. PMC 8236484. PMID 34180047.
- ↑ "Transurethral resection of the prostate (TURP) - Risks". nhs.uk (به انگلیسی). 2017-10-24. Retrieved 2020-03-08.
- ↑ Kuang M, Vu A, Athreya S (May 2017). "A Systematic Review of Prostatic Artery Embolization in the Treatment of Symptomatic Benign Prostatic Hyperplasia". CardioVascular and Interventional Radiology. 40 (5): 655–663. doi:10.1007/s00270-016-1539-3. PMID 28032133. S2CID 12154537.
- ↑ Pisco J, Bilhim T, Pinheiro LC, Fernandes L, Pereira J, Costa NV, et al. (May 2016). "Prostate Embolization as an Alternative to Open Surgery in Patients with Large Prostate and Moderate to Severe Lower Urinary Tract Symptoms". Journal of Vascular and Interventional Radiology. 27 (5): 700–8. doi:10.1016/j.jvir.2016.01.138. PMID 27019980.
- ↑ McNicholas TA (May 2016). "Benign prostatic hyperplasia and new treatment options - a critical appraisal of the UroLift system". Medical Devices: Evidence and Research. 9: 115–23. doi:10.2147/MDER.S60780. PMC 4876946. PMID 27274321.
- ↑ Porpiglia F, Fiori C, Bertolo R, Garrou D, Cattaneo G, Amparore D (August 2015). "Temporary implantable nitinol device (TIND): a novel, minimally invasive treatment for relief of lower urinary tract symptoms (LUTS) related to benign prostatic hyperplasia (BPH): feasibility, safety and functional results at 1 year of follow-up". BJU International. 116 (2): 278–87. doi:10.1111/bju.12982. hdl:2318/1623503. PMID 25382816. S2CID 5712711.
- ↑ Keehn A, Taylor J, Lowe FC (July 2016). "Phytotherapy for Benign Prostatic Hyperplasia". Current Urology Reports. 17 (7): 53. doi:10.1007/s11934-016-0609-z. PMID 27180172. S2CID 25609876.
- ↑ Bent S, Kane C, Shinohara K, Neuhaus J, Hudes ES, Goldberg H, Avins AL (February 2006). "Saw palmetto for benign prostatic hyperplasia" (PDF). The New England Journal of Medicine. 354 (6): 557–566. doi:10.1056/NEJMoa053085. PMID 16467543. S2CID 13815057.
- ↑ Dedhia RC, McVary KT (June 2008). "Phytotherapy for lower urinary tract symptoms secondary to benign prostatic hyperplasia". The Journal of Urology. 179 (6): 2119–2125. doi:10.1016/j.juro.2008.01.094. PMID 18423748.
- ↑ Franco JV, Trivisonno L, Sgarbossa NJ, Alvez GA, Fieiras C, Escobar Liquitay CM, Jung JH (June 2023). "Serenoa repens for the treatment of lower urinary tract symptoms due to benign prostatic enlargement". The Cochrane Database of Systematic Reviews. 2023 (6): CD001423. doi:10.1002/14651858.CD001423.pub4. PMC 10286776. PMID 37345871.
- ↑ "WHO Disease and injury country estimates". World Health Organization. 2009. Archived from the original on 11 November 2009. Retrieved 11 November 2009.
- ↑ Vos T, Flaxman AD, Naghavi M, Lozano R, Michaud C, Ezzati M, et al. (December 2012). "Years lived with disability (YLDs) for 1160 sequelae of 289 diseases and injuries 1990-2010: a systematic analysis for the Global Burden of Disease Study 2010". Lancet. 380 (9859): 2163–96. doi:10.1016/S0140-6736(12)61729-2. PMC 6350784. PMID 23245607.
- ↑ Verhamme KM, Dieleman JP, Bleumink GS, van der Lei J, Sturkenboom MC, Artibani W, et al. (Triumph Pan European Expert Panel) (October 2002). "Incidence and prevalence of lower urinary tract symptoms suggestive of benign prostatic hyperplasia in primary care--the Triumph project". European Urology. 42 (4): 323–8. doi:10.1016/S0302-2838(02)00354-8. PMID 12361895.


