پلی فسفات
پلی فسفاتها نمک یا استرهای پلیمر اکسی آنیونها تشکیل شده از چهار ضلعی PO ۴ (فسفات) هستند که واحد ساختاری آنها با به اشتراک گذاشتن اتم اکسیژن مرتبط است. پلی فسفاتها میتوانند ساختارهای حلقه ای خطی یا حلقوی را اتخاذ کنند. در زیستشناسی، استرهای پلی فسفات ADP و ATP در ذخیره انرژی نقش دارند. انواع پلی فسفاتها در جداسازی مواد معدنی در آبهای شهری کاربرد دارند که معمولاً به اندازه ۱تا۵ ppm وجود دارند.[۱] GTP، CTP و UTP نیز نوکلئوتیدهایی هستند که به ترتیب در سنتز پروتئین، سنتز لیپیدها و متابولیسم کربوهیدراتها مهم هستند. پلی فسفاتها نیز به عنوان افزودنیهای غذایی با علامت E452 استفاده میشوند.
ساختار
[ویرایش]-
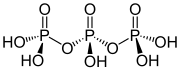
ساختار اسید تری فسفریک
-
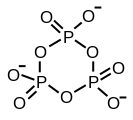
تری متافسفات حلقوی
-
آدنوزین دی فسفات (ADP)
ساختار اسید تری پلی فسفریک اصولی را نشان میدهد که ساختار پلی فسفاتها را تعریف میکند. این شامل سه واحد PO4 چهار وجهی است که با مراکز اکسیژن مشترک به یکدیگر متصل شدهاند. برای زنجیرههای خطی، گروههای فسفر انتهایی یک اکسید و بقیه مراکز فسفر دارای دو مرکز اکسید مشترک هستند. فسفاتهای مربوطه با از دست دادن پروتونهای اسیدی، به اسیدها مربوط میشوند. در شرایط تریمر حلقوی، هر چهار وجهی دارای دو راس با چهار وجهی مجاور است.
اشتراک سه گوشه امکانپذیر است. این موضوع نشان دهنده اتصال عرضی پلیمر خطی است. پلی فسفاتهای متقاطع ساختار ورقه ای Phyllosilicates را اتخاذ میکنند، اما چنین ساختارهایی تنها تحت شرایط شدید رخ میدهد.
تشکیل و سنتز
[ویرایش]پلی فسفاتها از پلیمریزاسیون مشتقات اسید فسفریک به وجود میآیند. این فرایند با ترکیب دو واحد فسفات در یک واکنش تراکم آغاز میشود.
- ۲ H(PO ۴) ۲ −
 (P ۲ O ۷) ۴ − + H ۲ O
(P ۲ O ۷) ۴ − + H ۲ O
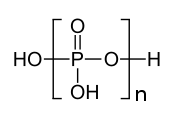
تراکم به عنوان یک تعادل نشان داده میشود زیرا واکنش معکوس، هیدرولیز، نیز امکانپذیر است. فرایند ممکن است در مراحل ادامه یابد. در هر مرحله واحد دیگری (PO ۳) − به زنجیره اضافه میشود، همانطور که با قسمت داخل براکتها در تصویر اسید پلی فسفریک نشان داده شدهاست. P ۴ O ۱۰ را میتوان به عنوان محصول نهایی واکنشهای تراکم مشاهده کرد که در آن هر چهار وجهی سه گوشه را با سایرین به اشتراک میگذارد. برعکس، هنگامی که مقدار کمی آب به پنتوکسید فسفر اضافه میشود، مخلوط پیچیدهای از پلیمرها تولید میشود.
خواص اسید-باز و کمپلکس
[ویرایش]پلی فسفاتها بازهای ضعیفی هستند. یک جفت الکترون تنها روی یک اتم اکسیژن را میتوان به یک یون هیدروژن (پروتون) یا یک یون فلز در یک برهمکنش معمولی اسید لوئیس-باز لوئیس اهدا کرد. این در زیستشناسی اهمیت عمیقی دارد. به عنوان مثال، آدنوزین تری فسفات حدود ۲۵٪ در محلول آبی در۷PH پروتونه میشود.[۲]
- ATP ۴- + H +
 ATPH ۳-، p K a ۶٫۶
ATPH ۳-، p K a ۶٫۶
پروتوناسیون بیشتر در مقادیر pH پایینتر اتفاق میافتد.
پیوند فسفات «انرژی بالا».
[ویرایش]ATP با ترکیب یونهای فلزی با کلات تشکیل میشود. ثابت پایداری برای تعادل
- ATP ۴- + Mg ۲ +
 MgATP ۲-، log β ۴
MgATP ۲-، log β ۴
به خصوص بزرگ است.[۳] تشکیل کمپلکس منیزیم، یک فرایند بحرانی در فرایند هیدرولیز ATP است، زیرا پیوند بین گروه فسفات پایانی و بقیه مولکول را ضعیف میکند.[۲][۴]
انرژی آزاد شده در هیدرولیز ATP,
- ATP ۴- + H ۲ O → ADP ۳- + P i -
ΔG -۳۶٫۸ kJ mol -۱ بر اساس استانداردهای بیولوژیکی بزرگ است. P i مخفف فسفات معدنی است که در pH بیولوژیکی پروتونه میشود. با این حال، از نظر استانداردهای معدنی بزرگ نیست. اصطلاح «انرژی بالا» به این واقعیت اشاره دارد که نسبت به مقدار انرژی آزاد شده در واکنشهای شیمیایی آلی که میتواند در سیستمهای زنده رخ دهد، زیاد است.
پلی فسفاتهای معدنی با پلیمر بالا
[ویرایش]پلی فسفاتهای با وزن مولکولی بالا به خوبی شناخته شدهاند.[۵] یکی از مشتقات نمک گراهام شیشه ای (یعنی بیشکل) است. پلی فسفاتهای کریستالی با وزن مولکولی بالا شامل نمک کورول و نمک مادرل هستند. این گونه هافرمولNaPO۳)n(NaPO۳(OH))۲)را دارند که n میتواند به بزرگی ۲۰۰۰ باشد. از نظر ساختار آنها، این پلیمرها از PO ۳ - «مونومر» تشکیل شدهاند که زنجیرهها توسط فسفاتهای پروتونه خاتمه مییابند.[۶]
در طبیعت
[ویرایش]پلی فسفاتهای معدنی با پلیمر بالا در موجودات زنده توسط L. Liberman در سال ۱۸۹۰ یافت شد. این ترکیبات پلیمرهای خطی حاوی کمی تا چند صد باقیمانده از ارتوفسفات هستند که توسط پیوندهای فسفو آن هیدرید غنی از انرژی به هم متصل شدهاند.
پیش از این، آن را یا به عنوان «فسیل مولکولی» یا تنها به عنوان یک منبع فسفر و انرژی برای بقای میکروارگانیسمها در شرایط شدید در نظر میگرفتند. این ترکیبات در حال حاضر به عنوان نقشهای تنظیمی نیز شناخته شدهاند و در انواع تمام گونههای موجودات زنده وجود دارند که در تصحیح و کنترل متابولیک در هر دو سطح ژنتیکی و آنزیمی شرکت میکنند. پلی فسفات بهطور مستقیم در تغییر برنامه ژنتیکی مشخصه مرحله رشد نمایی باکتریها تا فرایند بقای سلول در شرایط ثابت، «زندگی در مسیر کند» نقش دارد. آنها در بسیاری از مکانیسمهای تنظیمی که در باکتریها رخ میدهد شرکت میکنند:
- آنها در القای rpoS، یک زیر واحد RNA-پلیمراز است که مسئول توضیح گروه بزرگی از ژنهای دخیل در تنظیم فاز رشد ثابت و بسیاری از عوامل استرسزا است، شرکت میکنند.
- آنها برای تحرک سلولی، تشکیل بیوفیلم و حدت بسیار مهم هستند.[نیازمند شفافسازی]
- پلی فسفاتها و اگزوپلی فسفاتازها در تنظیم سطوح عامل واکنش دقیق، گوانوزین-۵' دی فسفات-۳'- دی فسفات (ppGpp)و پیام رسان دوم در سلولهای باکتریایی شرکت میکنند.
- پلی فسفاتها در تشکیل کانالها در سراسر غشای سلولهای زنده شرکت میکنند. کانالهای فوق که توسط پلی فسفات و پلی-b-هیدروکسی بوتیرات با Ca2+ تشکیل شدهاند در فرآیندهای انتقال در موجودات مختلف نقش دارند.
- عملکرد مهم پلی فسفات در میکروارگانیسمها — پروکاریوتها و یوکاریوتهای پایینتر — کنترل شرایط متغیر محیطی با تأمین ذخایر فسفات و انرژی است. پلی فسفاتها در سلولهای حیوانی وجود دارند و دادههای زیادی در مورد مشارکت آن در فرآیندهای تنظیمی در طول رشد و تکثیر و تمایز سلولی — به ویژه در بافتهای استخوانی و مغز - وجود دارد.
در انسان پلی فسفاتها نقش کلیدی در انعقاد خون دارند که توسط پلاکتها[۷] تولید و آزاد شده و آنها فاکتور انعقاد خون XII را فعال میکنند که برای تشکیل لخته خون ضروری است. فاکتور XII که فاکتور Hageman نیز نامیده میشود، شروع کننده تشکیل فیبرین و تولید یک واسطه پیش التهابی به نام برادی کینین است که به نشت از رگهای خونی و ترومبوز کمک میکند.[۸][۹] پلی فسفاتهای ایجاد شده از باکتری، پاسخ ایمنی میزبان را در طول عفونت مختل میکنند و در معرض قرار گرفتن پلی فسفاتها با اگزوپلی فسفاتاز نوترکیب، باعث ایجاد سپسیس در موشها میشود.[۱۰] پلی فسفاتهای معدنی نقش مهمی در تحمل سلولهای مخمر به کاتیونهای فلزات سنگین سمی دارند.[۱۱]
به عنوان افزودنیهای غذایی مصرف کردن
[ویرایش]پلی فسفات سدیم (E452(i))، پلی فسفات پتاسیم (E452(ii))، سدیم پلی فسفات کلسیم (E452(iii)) و پلی فسفات کلسیم (E452(iv)) به عنوان افزودنیهای غذایی استفاده میشوند. دلیل بر اینکه که آنها هیچ خطر بالقوه ای برای سلامتی به جز مواردی که بهطور کلی به سایر منابع فسفات نسبت داده میشوند (از جمله آنهایی که بهطور طبیعی در غذا وجود دارند) وجود ندارد. در حالی که نگرانیهایی در مورد اثرات مضر بر استخوانها و بیماریهای قلبی عروقی و همچنین هیپرفسفاتمی مطرح شدهاست. به نظر میرسد که این موارد فقط برای مصرف افراطی منابع فسفات مرتبط باشد. در کل مصرف معقول تا (۴۰)میلیگرم فسفات به ازای هر کیلوگرم وزن بدن در روز) هیچ خطری برای سلامتی ندارد.[۱۲][۱۳]
جستارهای وابسته
[ویرایش]- اسیدهای فسفریک
- تری متافسفات سدیم
- هگزامتافسفات سدیم
منابع
[ویرایش]- ↑ "The Phosphate Method For Producing Quality Drinking Water" (PDF). Carus Chemical Company. 2001. Archived from the original (PDF) on 2011-04-19. Retrieved 2011-04-20.
- ↑ ۲٫۰ ۲٫۱ Storer A, Cornish-Bowden A (1976). "Concentration of MgATP2- and other ions in solution. Calculation of the true concentrations of species present in mixtures of associating ions". Biochem J. 159 (1): 1–5. doi:10.1042/bj1590001. PMC 1164030. PMID 11772.
- ↑ Wilson J, Chin A (1991). "Chelation of divalent cations by ATP, studied by titration calorimetry". Anal Biochem. 193 (1): 16–9. doi:10.1016/0003-2697(91)90036-S. PMID 1645933.
- ↑ Garfinkel L, Altschuld R, Garfinkel D (1986). "Magnesium in cardiac energy metabolism". J Mol Cell Cardiol. 18 (10): 1003–13. doi:10.1016/S0022-2828(86)80289-9. PMID 3537318.
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Oxford: Butterworth-Heinemann. ISBN 0080379419.
{{cite book}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Klaus Schrödter, Gerhard Bettermann, Thomas Staffel, Friedrich Wahl, Thomas Klein, Thomas Hofmann "Phosphoric Acid and Phosphates" in Ullmann’s Encyclopedia of Industrial Chemistry 2008, Wiley-VCH, Weinheim. doi:10.1002/14356007.a19_465.pub3
- ↑ Ruiz FA, Lea CR, Oldfield E, Docampo R (Oct 2004). "Human platelet dense granules contain polyphosphate and are similar to acidocalcisomes of bacteria and unicellular eukaryotes". J Biol Chem. 279 (43): 44250–7. doi:10.1074/jbc.M406261200. PMID 15308650.
- ↑ Müller F, Mutch NJ, Schenk WA, Smith SA, Esterl L, Spronk HM, Schmidbauer S, Gahl WA, Morrissey JH, Renné T (Dec 2009). "Platelet polyphosphates are proinflammatory and procoagulant mediators in vivo". Cell. 139 (6): 1143–56. doi:10.1016/j.cell.2009.11.001. PMC 2796262. PMID 20005807.
- ↑ "Newly discovered mechanism by which blood clots form". physorg.com. December 10, 2009. Retrieved 13 December 2009.
- ↑ Roewe J, Stavrides G, Strueve M, Sharma A, Marini F, Mann A, Smith SA, Kaya Z, Strobl B, Mueller M, Reinhardt C, Morrissey JH, Bosmann M (August 2020). "Bacterial polyphosphates interfere with the innate host defense to infection". Nature Communications. 11 (1): 4035. Bibcode:2020NatCo..11.4035R. doi:10.1038/s41467-020-17639-x. PMC 7423913. PMID 32788578.
- ↑ Andreeva N, Ryazanova L, Dmitriev V, Kulakovskaya T, Kulaev I (Aug 2013). "Adaptation of Saccharomyces cerevisiae to toxic manganese concentration triggers changes in inorganic polyphosphates". FEMS Yeast Res. 13 (5): 463–470. doi:10.1111/1567-1364.12049. PMID 23663411.
- ↑ «EFSA Panel on Food Additives and Flavourings (FAF), Younes, M., Aquilina, G., Castle, L., Engel, K. H., Fowler, P., ... & Mennes, W. (2019). Re‐evaluation of phosphoric acid–phosphates–di‐, tri‐and polyphosphates (E 338–341, E 343, E 450–452) as food additives and the safety of proposed extension of use. EFSA Journal, 17(6), e05674». بایگانیشده از اصلی در ۷ ژانویه ۲۰۲۲. دریافتشده در ۷ ژانویه ۲۰۲۲.
- ↑ Ritz, E. , Hahn, K. , Ketteler, M. , Kuhlmann, M. K. , & Mann, J. (2012). Phosphate additives in food—a health risk. Deutsches Ärzteblatt International, 109(4), 49.
پیوند به بیرون
[ویرایش]- Pavlov E, Grimbly C, Diao CT, French RJ (September 2005). "A high-conductance mode of a poly-3-hydroxybutyrate/calcium/polyphosphate channel isolated from competent Escherichia coli cells". FEBS Lett. 579 (23): 5187–92. doi:10.1016/j.febslet.2005.08.032. PMID 16150446.
- Kulaev I, Vagabov V, Kulakovskaya T (1999). "New aspects of inorganic polyphosphate metabolism and function". J. Biosci. Bioeng. 88 (2): 111–29. doi:10.1016/S1389-1723(99)80189-3. PMID 16232585.
- Kulaev I, Kulakovskaya T (2000). "Polyphosphate and phosphate pump". Annu. Rev. Microbiol. 54: 709–34. doi:10.1146/annurev.micro.54.1.709. PMID 11018142.