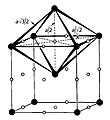
دستگاه بلوری مکعبی

در کریستالوگرافی، دستگاه بلوری مکعبی (به انگلیسی: Cubic crystal system) به یکی از ۷ دستگاه شبکههای بلوری گفته میشود که ۳ گونه مکعبی شکل از ۱۴ شبکه براوه را دربر میگیرد؛ این دستگاه از رایجترین و ساده ترین اشکالی است که در بلورها و مواد معدنی یافت میشود.
دستگاه بلوری مکعبی در سه شکل اصلی زیر یافت میشود:
- شبکه مکعبی ساده (simple cubic) که آن را به اختصار SC یا CP مینامند. شبه فلز پولونیم تنها عنصری است که دارای این گونه مکعبی است.[۱][۲][۳]
- شبکه مکعبی مرکزپر (body-centered cubic) که آن را به اختصار BCC یا CL مینامند. فلزات کروم، آهن (آلفا)، مولیبدن و تانتالم از جمله فلزاتی اند که دارای شبکه مکعبی BCC هستند.[۴]
- شبکه مکعبی وجهپر (face-centered cubic) که آن را به اختصار FCC یا CF مینامند. فلزات آلومینیوم، مس، طلا، سرب، نیکل، پلاتین و نقره از جمله فلزاتی اند که دارای شبکه مکعبی FCC هستند.[۴]

-
مکعبی ساده SC
-
مرکزپر BCC
-
وجهپر FCC
شبکه براوه
[ویرایش]شبکه بلوری مکعبی ساده (CP)
[ویرایش]شبکه بلوری مکعبی ساده (CP) دارای هشت نقطه شبکه در هشت گوشه سلول واحد است[۴]، اتمهایی که در گوشه سلول واحد قرار دارند بهطوری مساوی بین هشت سلول واحد مجاور تقسیم میشوند بنابراین در هر سلول واحد مکعبی ساده یک (۱/۸*۸) اتم وجود دارد. هر اتم موجود در این شبکه بلوری دارای عدد همسایگی (به انگلیسی: Coordination Number) شش است.

شبکه بلوری مکعبی مرکزپر (CL) یا (BCC)
[ویرایش]شبکه بلوری مکعبی مرکزپر (CL) دارای یک نقطه شبکه در مرکز و هشت نقطه شبکه در هشت گوشه سلول واحد است[۴]، اتمی که در مرکز سلول واحد قرار دارد بهطور کامل متعلق به یک سلول واحد است بنابراین در هر سلول واحد مکعبی مرکز پر دو (۱/۸*۸+۱) اتم وجود دارد. هر اتم در این شبکه بلوری دارای عدد همسایگی هشت است.

شبکه بلوری مکعبی وجهپر (CF) یا (FCC)
[ویرایش]شبکه بلوری مکعبی وجهپر (CF) دارای شش نقطه شبکه در شش وجه و هشت نقطه شبکه در هشت گوشه سلول واحد است، اتمی که در وجه سلول واحد قرار گیرد بهطور مساوی بین دو سلول واحد مجاور تقسیم میشود بنابراین در هر سلول واحد مکعبی وجهپر چهار (۱/۸*۸+۱/۲*۶) اتم وجود دارد. هر اتم در این شبکه بلوری دارای عدد همسایگی دوازده است. شبکه بلوری مکعبی وجهپر (CF) به سیستم ششوجهی فشرده (HCP) بسیار نزدیک است، بهگونهای که این دو سیستم فقط در جایگیری نسبی لایههای ششوجهی متفاوت هستند. صفحه [۱۱۱] در شبکه بلوری مکعبی مرکزپر، یک شبکه ششوجهی را تشکیل میدهد.[۴]

فاکتور تراکم اتمی (APF) نسبت حجم اشغالی توسط اتمها به کل حجم شبکه بلور است. شبکه بلوری مکعبی ساده (CP) دارای APF حدود ۰.۵۲۴ است، شبکه بلوری مکعبی مرکزپر (CL) دارای APF حدود ۰.۶۸۰ است، و شبکه بلوری مکعبی وجهپر (CF) دارای APF حدود ۰.۷۴۰ است.
سلول واحد برای ساختار بلوری مکعبی مرکزپر (BCC) شامل چندین بخش از نه اتم است (اگر ذرات موجود در بلور، اتمها باشند): یکی در هر گوشه مکعب و یک اتم در مرکز. از آنجایی که حجم هر یک از هشت اتم گوشهای بین هشت سلول مجاور به اشتراک گذاشته میشود، هر سلول BCC معادل حجم دو اتم (یکی در مرکز و مجموعاً یکی در گوشهها) را شامل میشود.
هر اتم در گوشه با اتم مرکزی در تماس است. خطی که از یک گوشه مکعب از طریق مرکز به گوشه دیگر کشیده میشود، از ۴r عبور میکند که اینجا r شعاع یک اتم است. بر اساس هندسه، طول قطر مکعب برابر با است. بنابراین، طول هر ضلع ساختار BCC میتواند به شعاع اتم مرتبط باشد.. برای مثال نجوهی محاسبهی فاکتور تراکم اتمی در ساختار مکعبی مرکزپر بدین صورت خواهد بود:[۴]


ساختارهای تکعنصری
[ویرایش]بهطور کلی، از آنجا که اتمها در یک جامد به یکدیگر جذب میشوند، چیدمانهای فشردهتر اتمها معمولاً رایجتر هستند. (چیدمانهای کمتراکم نیز وجود دارند، مثلاً اگر هیبریداسیون اوربیتالها زوایای خاصی را نیاز داشته باشد). بنابراین، ساختار مکعبی اولیه (CP)، با فاکتور تراکم اتمی بسیار پایین، در طبیعت نادر است اما در عنصر پولونیوم یافت میشود. باقی ساختارهای مکعبی، در عناصر بیشتری یافت میشوند و وجود آنها از ساختار مکعبی اولیه (CP) بسیار رایجتر است.
دیگر ساختار کریستالی مکعبی مهم، ساختار مکعب الماس است که میتواند در کربن، سیلیسیم، ژرمانیم و قلع وجود داشته باشد. بر خلاف ساختارهای FCC و BCC، این ساختار یک شبکه نیست، زیرا حاوی چندین اتم در سلول اولیه خود است. سایر ساختارهای عنصر مکعبی شامل ساختار A۱۵ که در تنگستن یافت میشود و همچنین ساختار بسیار پیچیده منگنز است.
ساختارهای چندعنصری
[ویرایش]ترکیباتی که از بیش از یک عنصر تشکیل شدهاند (برای مثال ترکیبات دوتایی) اغلب ساختارهای بلوری خود را بر اساس سیستم بلوری مکعبی ایجاد میکنند. برخی از رایجترین این ساختارها در زیر آورده شدهاند. این ساختارها میتوانند بهصورت دو یا چند زیرشبکهای که هر زیرشبکه در محلهای بینفضایی دیگر قرار دارد، فرض شوند.
ساختار سزیم کلرید
[ویرایش]یک ساختار که بهطور رایج مشاهده میشود، ساختار "مکعبی بدوی متقابل" است که به آن ساختار "سزیم کلرید" یا ساختار B2 نیز گفته میشود. این ساختار اغلب با ساختار مکعبی مرکزپر (BCC) اشتباه گرفته میشود زیرا چیدمان اتمهایشان مشابه است. اما ساختار سزیم کلرید از دو نوع اتم متفاوت تشکیل شده است. در ساختار مکعبی مرکزپر، تقارن انتقالی در امتداد جهت [۱۱۱] وجود دارد. اما در ساختار کلرید سزیم، انتقال در امتداد این جهت منجر به تغییر نوع اتمها میشود. این ساختار همچنین می تواند به عنوان دو ساختار مکعبی ساده مجزا در نظر گرفته شود، یعنی یکی از هر کدام از گونهها، درون یکدیگر قرار گرفته اند. گوشه مکعب کلرید مرکز مکعب سزیم است و بالعکس.[۵]

در واحد سلول ساختار CsCl، هر یون در مرکز یک مکعب از یونهای مخالف نوع خود قرار دارد، بنابراین عدد هماهنگی هشت است. کاتیون مرکزی با هشت آنیون در گوشههای یک مکعب هماهنگ شده است و به همین ترتیب، آنیون مرکزی نیز با هشت کاتیون در گوشههای یک مکعب هماهنگ است. بهطور متناوب، میتوان این شبکه را بهعنوان یک ساختار مکعب ساده تصور کرد که یک اتم ثانویه در فضای مکعبی آن قرار دارد.
علاوه بر خود سزیم کلرید، این ساختار همچنین در برخی از هالیدهای قلیایی دیگر که در دماهای پایین یا فشارهای بالا تهیه شدهاند، مشاهده میشود.[۶] معمولاً این ساختار بیشتر از دو عنصری که اندازهی یونهای آنها تقریباً مشابه است، به وجود میآید (بهعنوان مثال، شعاع یونی Cs+ = ۱۶۷pm و Cl- = ۱۸۱pm).
تقریباً یکصد ترکیب بینفلزی از عناصر نادر وجود دارد که در ساختار CsCl کریستالیزه میشوند، از جمله بسیاری از ترکیبات دوتایی عناصر نادر با منیزیم، و همچنین با عناصر گروههای ۱۱، ۱۲ و ۱۳. سایر ترکیباتی که ساختاری مشابه سزیم کلرید دارند عبارتند از: RbCl, CsI, CsBr با دمای بالا، AlCo، AgZn، BeCu، MgCe، RuAl و SrTl.
ساختار سنگنمک
[ویرایش]
در ساختار سنگنمک، هر یک از دو نوع اتم یک شبکهی FCC مجزا تشکیل میدهند که این دو شبکه بهطور همزمان در هم تداخل دارند و به این ترتیب یک الگوی شطرنجی سهبعدی را تشکیل میدهند. ساختار سنگنمک دارای هماهنگی اکتاهدرال است. یعنی نزدیکترین همسایههای هر اتم شامل شش اتم از نوع مخالف هستند که در موقعیتهای شش رأس یک اکتاهدرال قرار دارند. در ترکیب سدیم کلرید، این ساختار دارای نسبت ۱:۱ از اتمهای سدیم و کلر است. این ساختار همچنین میتواند بهصورت یک شبکهی FCC از اتمهای سدیم تصور شود که اتمهای کلر درهر فضای خالی اکتاهدرال آن قرار دارند، یا برعکس.[۵] نمونههای دیگر این ساختار شامل تقریباً تمامی هالیدهای فلزات قلیایی و بسیاری از اکسیدها، سولفیدها، سلنیدها و تلوریدهای فلزات دوظرفیتی هستند.[۶]
طبق قانون نسبت شعاعی، این ساختار اغلب زمانی تشکیل میشود که کاتیون کمی کوچکتر از آنیون باشد (نسبت شعاع کاتیون به آنیون در حدود ۰.۴۱۴ تا ۰.۷۳۲ باشد).
ساختار فلوریت
[ویرایش]ساختار فلوریت (AB2) مشابه ساختار سنگنمک است، با این تفاوت که نسبت یونها در این ساختار ۱:۲ است. ساختار ضدفلوریت تقریباً مشابه ساختار فلوریت است، اما موقعیتهای آنیونها و کاتیونها جابهجا شدهاند. در ساختار فلوریت، یونها در موقعیتهای Wyckoff و 8c قرار دارند، در حالی که در ساختار سنگنمک، این موقعیتها 4a و 4b هستند.[۷]

ساختار هویسلر
[ویرایش]ساختار هویسلر، که بر پایهی ساختار Cu2MnAl است، یک ساختار رایج برای ترکیبات سهگانهای است که شامل فلزات واسطه هستند. گروه فضایی این ساختار Fm3m است (شماره 225) و کد Strukturbericht آن L21 میباشد. با ترکیبات مشابه مانند ساختار نیمه هویسلر و ساختار معکوس هویسلر، صدها نمونه از این ساختار وجود دارد.
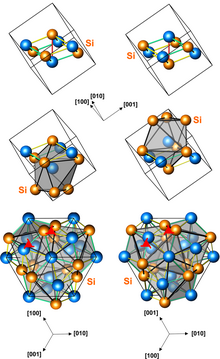
ساختار مونوسیلیسید آهن
[ویرایش]گروه فضایی ساختار مونوسیلیسید آهن P213 است (شماره ۱۹۸) و کد Strukturbericht آن B20 است. این یک ساختار دستسان است که گاهی با خواص مغناطیسی مارپیچی همراه است. در این ساختار چهار اتم از هر عنصر وجود دارد و در مجموع هشت اتم در یک سلول واحد قرار دارند.
این ساختار معمولاً در سیلیسیدها و ژرمانیدهای فلزات واسطه و همچنین در چند ترکیب دیگر مانند گالیوم پالادیوم دیده میشود.
سیلیسیدها و ژرمانیدهای فلزات واسطه با ساختار FeSi:
[ویرایش]| سیلیسیدها | ژرمانیدها | |
|---|---|---|
| منگنز | منگنز مونوسیلیسید | منگنز ژرمانید |
| آهن | آهن مونوسیلیسید | آهن ژرمانید |
| کبالت | کبالت مونوسیلیسید | کبالت ژرمانید |
| کروم | کروم(IV)سیلیسید | کروم(IV)ژرمانید |
ساختار وییر–فلان
[ویرایش]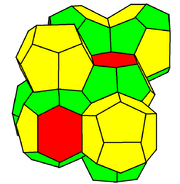
ساختار وییر–فلان تقارن Pm3n دارد (شماره ۲۲۳). این ساختار از سه جهت مختلف از تتراکاهدرونها و سلولهای پیرتوهدرال در شکافها تشکیل شده است. در شیمی، معمولاً این ساختار بهعنوان 'ساختار کلاتریت نوع ۱' شناخته میشود. کریستالهای گاز هیدراتها که توسط متان، پروپان و دیاکسید کربن در دماهای پایین تشکیل میشوند، ساختاری مشابه ساختار وییر–فلان دارند که در آن مولکولهای آب در گرههای این ساختار قرار گرفته و بهصورت پیوند هیدروژنی به یکدیگر متصل هستند، در حالی که مولکولهای گاز بزرگتر در قفسهای چندوجهی گیر میافتند.
حفرههای کریستالی
[ویرایش]حفرات در شبکه مکعبی ساده
سلول واحد مکعبی ساده دارای یک حفره (به انگلیسی: Void) مکعبی است.[۸]
حفرات در شبکه مکعبی مرکز پر
سلول واحد مکعبی مرکزپر دارای شش حفره هشت وجهی است.[۸] شش حفره هشتوجهی که هر یک در مرکز یکی سطح سلول واحد قرار دارند بهطور مساوی بین دو سلول واحد تقسیم میشوند و همچنین دوازده هشتوجهی که هر یک در مرکز هر یال سلول واحد قرار گرفتهاند بهطور مساوی بین چهار سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد شش (۶*۱/۲+۱۲*۱/۴) حفره هشتوجهی در سلول واحد مکعبی مرکزپر وجود دارد. همچنین سلول واحد مکعبی مرکزپر دارای دوازده حفره چهار وجهی است.[۸] چهار حفره چهار وجهی بر مرکز سطح سلول واحد قرار دارد که بهطور مساوی میان دو سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد دوازده (۶*۴*۱/۲) حفره چهار وجهی در سلول واحد مکعبی مرکز پر قرار دارد. لازم است ذکر شود که حفرات هشتوجهی و چهار وجهی ذکر شده دارای حالت عادی نیستند (یعنی طول همه یال های این حفرات با یکدیگر برابر نیست).
-
حفره کریستالی اکتاهدرال در شبکه بلوری مکعبی مرکزپر
-
حفره کریستالی تتراهدرال در شبکه بلوری مکعبی مرکزپر
حفرات در شبکه مکعبی وجهپر
سلول واحد مکعبی وجهپر دارای چهار حفره هشتوجهی است.[۸] یک حفره هشتوجهی به صورت کامل در مرکز سلول واحد قرار دارد، دوازده حفره هشتوجهی نیز در مرکز هر یال سلول واحد قرار دارد که بهطور مساوی میان چهار سلول واحد تقسیم میشوند بنابراین همانطور که گفته شد چهار (۱+۱۲*۱/۴) حفره هشت وجهی در سلول واحد مکعبی وجهپر وجود دارد.همچنین سلول واحد مکعبی وجهپر دارای هشت حفره چهار وجهی است. حفرات هشت وجهی در این ساختار کریستالی میان هر راس و مرکز سلول قرار دارند.[۸]
-
حفره کریستالی اکتاهدرال در شبکه بلوری مکعبی وجهپر
-
حفره کریستالی تتراهدرال در شبکه بلوری مکعبی وجهپر
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ The original discovery was in J. Chem. Phys. 14, 569 (1946).
- ↑ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth-Heinemann. ISBN 978-0-08-037941-8.
- ↑ «Simple Cubic Crystal Structure | MATSE 81: Materials In Today's World». www.e-education.psu.edu. دریافتشده در ۲۰۲۴-۱۱-۱۸.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ ۴٫۴ ۴٫۵ 1. William D. Callister, David G. Rethwisch; 2018, Materials Science And Engineering, 10th ed. pp. 50–54.
- ↑ ۵٫۰ ۵٫۱ "Cubic Lattices and Close Packing". 3 October 2013. Archived from the original on 2020-11-01.
- ↑ ۶٫۰ ۶٫۱ Seitz, Modern Theory of Solids (1940), p.49.
- ↑ «fluorite».
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ ۸٫۳ ۸٫۴ Christopher Hammond; 2009, The Basics of Crystallography and Diffraction, 3rd ed. pp. 11–15.






![{\displaystyle {\displaystyle {\begin{aligned}\mathrm {APF} &={\frac {N_{\mathrm {atoms} }V_{\mathrm {atom} }}{V_{\text{unit cell}}}}={\frac {2\cdot {\frac {4}{3}}\pi r^{3}}{\left({\frac {4r}{\sqrt {3}}}\right)^{3}}}\\[10pt]&={\frac {\pi {\sqrt {3}}}{8}}\approx 0.680\,174\,762\,.\end{aligned}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a56374a71495a4e71df744a6514c20462c4e5bf7)