سولفید سزیم
ظاهر
| سولفید سزیم | |
|---|---|
| |
Caesium sulfide | |
| شناساگرها | |
| شماره ثبت سیایاس | 12214-16-3 |
| پابکم | 14496896 |
| کماسپایدر | 22499401 |
| جیمول-تصاویر سه بعدی | Image 1 |
| |
| |
| خصوصیات | |
| فرمول مولکولی | Cs2S |
| جرم مولی | 297.876 |
| شکل ظاهری | white crystal |
| چگالی | 4.19 g·cm-3[۱] |
| دمای ذوب | 480 °C[۲] |
| انحلالپذیری در آب | hydrolyses to form caesium bisulfide[۳] |
| انحلالپذیری در ethanol and glycerol | soluble |
| ساختار | |
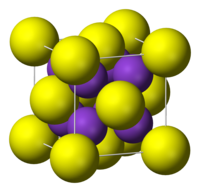
| ساختار بلوری | cubic anti-fluorite |
| خطرات | |
| GHS pictograms |  
|
| سیستم هماهنگ جهانی طبقهبندی و برچسبگذاری مواد شیمیایی | Danger |
| GHS hazard statements | H314, H400 |
| GHS precautionary statements | P260, P264, P273, P280, P301+330+331, P303+361+353, P304+340, P305+351+338, P310, P321, P363, <span class="abbr" style="color: blue; border-bottom: 1px dotted blue" title="Error in hazard statements">P391, P405, P501 |
| خطرات اصلی | toxic |
| ترکیبات مرتبط | |
| دیگر آنیونها | Caesium oxide Caesium selenide Caesium telluride Caesium polonide |
| دیگر کاتیونها | Lithium sulfide Sodium sulfide Potassium sulfide Rubidium sulfide Francium sulfide |
| به استثنای جایی که اشاره شدهاست در غیر این صورت، دادهها برای مواد به وضعیت استانداردشان داده شدهاند (در 25 °C (۷۷ °F)، ۱۰۰ kPa) | |
| Infobox references | |
|
| |
سولفید سزیم، یک نمک معدنی با فرمول شیمیایی Cs2S است. که یک قلیای قوی محلول در آب است. این ماده هنگام تماس با هوا، سولفید هیدروژن با بویی همانند بوی تخم مرغ فاسد انتشار می دهد.
تولید
[ویرایش]مانند سولفید سدیم، سولفید سزیم بدون حضور آب میتواند به دست آید؛ این فرآیند ناشی از واکنش سزیم و گوگرد در محلول THF می باشد. برای انجام این واکنش، نیاز به آمونیاک یا نفتالین است.[۴]
- 2Cs + S → Cs 2 S
با حل کردن سولفید هیدروژن در محلول هیدروکسید سزیم، بی سولفید سزیم تولید می شود، سپس سولفید سزیم نیز تولید می شود.[۵][۶]
- CsOH + H 2 S → CsHS + H 2 O
- CsHS + CsOH → Cs 2 S + H 2 O
منابع
[ویرایش]- ↑ Sommer, Helmut; Hoppe, Rudolf. The crystal structure of cesium sulfide and a remark about cesium selenide, cesium telluride, rubidium selenide, and rubidium telluride (به آلمانی). Zeitschrift für Anorganische und Allgemeine Chemie, 1977. 429: 118-30. ISSN 0044-2313
- ↑ Dale L. Perry, Sidney L. Phillips: Handbook of inorganic compounds. CRC Press, 1995, شابک ۹۷۸−۰−۸۴۹۳−۸۶۷۱−۸, S. 336 ([۱], p. 336, در گوگل بوکس).
- ↑ Jean D'Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, شابک ۹۷۸−۳−۵۴۰۶−۰۰۳۵−۰, S. 692 ([۲], p. 692, در گوگل بوکس).
- ↑ J.-H. So and P. Boudjouk (1992). "Hexamethyldisilathiane". Inorganic Syntheses: 30–32. doi:10.1002/9780470132609.ch11. ISBN 9780470132609.
- ↑ Wilhelm Blitz, Ernst Wilke-Dörfurt: "Über Sulfide des Rubidiums und Cäsiums" in Zeitschr. f. anorg.
- ↑ R. Abegg, F. Auerbach: 'Handbuch der anorganischen Chemie'.
