باتری جریان
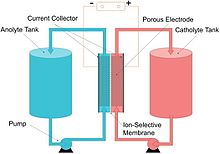
باتری جریان یا باتری جریان ردوکس (پس از کاهش-اکسیداسیون )، نوعی سلول الکتروشیمیایی است که در آن انرژی شیمیایی توسط دو جزء شیمیایی حل شده در مایعاتی که از طریق سیستم در طرفهای جداگانه یک غشاء پمپ میشوند، تامین میشود. [۲] [۳] انتقال یون در داخل سلول (همراه با جریان الکتریکی از طریق یک مدار خارجی) از طریق غشاء رخ می دهد در حالی که هر دو مایع در فضای مربوط به خود گردش می کنند. ولتاژ سلول از نظر شیمیایی توسط معادله نرنست تعیین می شود و در کاربردهای عملی از 1.0 تا 2.43 ولت متغیر است. ظرفیت انرژی تابعی از حجم الکترولیت و توان تابعی از سطح الکترودها است.
باتری جریان ممکن است مانند پیل سوختی (جایی که سوخت مصرفشده استخراج میشود و سوخت جدید به سیستم اضافه میشود) یا مانند باتری قابل شارژ (که در آن منبع انرژی الکتریکی باعث احیای سوخت میشود) استفاده شود. در حالی که باتریهای جریان دارای مزایای فنی خاصی نسبت به باتریهای قابل شارژ معمولی با مواد جامد الکتریکی هستند، مانند مقیاس مطلق قدرت (تعیین شده توسط اندازه پشته) و انرژی (تعیین شده توسط اندازه مخازن)، چرخه طولانی و عمر سالانه، هزینه کل مالکیت بالقوه کمتر است، همه باتریهای جریان از بازده انرژی چرخه پایینتری (50 تا 80 درصد) در مقایسه با باتریهای لیتیوم یون سوخته میشود. این بازده انرژی پایین ناشی از نیاز به کارکردن باتریهای جریان با چگالی جریان بالا (>= 100 میلی آمپر بر سانتیمتر مربع) برای کاهش اثر متقاطع داخلی (از طریق غشاء/جداکننده داخل هر سلول) و کاهش هزینههای برق است. (اندازه پشته ها).
تاریخچه
[ویرایش]در سال 2022، دالیان ، چین ، کارکرد باتری 400 مگاوات ساعتی و 100 مگاواتی جریان وانادیوم را آغاز کرد که در آن زمان بزرگترین باتری در نوع خود بود. [۴]

اصل ساخت و ساز
[ویرایش]باتری جریان یک پیل سوختی قابل شارژ است که در آن یک الکترولیت حاوی یک یا چند عنصر الکترواکتیو محلول از طریق یک سلول الکتروشیمیایی جریان مییابد که به طور برگشتپذیر انرژی شیمیایی را مستقیماً به الکتریسیته تبدیل میکند. عناصر الکترواکتیو «عناصری در محلول هستند که میتوانند در واکنش الکترود شرکت کنند یا روی الکترود جذب شوند». الکترولیت اضافی در خارج و معمولا در مخازن ذخیره می شود،و معمولاً از طریق سلول (یا سلول) راکتور پمپ می شود، اگرچه سیستم های تغذیه گرانشی نیز شناخته شده هستند. باتری های جریان را می توان با جایگزینی مایع الکترولیت (به روشی مشابه با پر کردن مخازن سوخت برای موتورهای احتراق داخلی ) به سرعت "شارژ" کرد و همزمان مواد مصرف شده را برای شارژ مجدد بازیابی کرد. بسیاری از باتریهای جریان از الکترودهای نمدی کربنی به دلیل هزینه کم و رسانایی الکتریکی کافی استفاده میکنند، اگرچه این الکترودها به دلیل فعالیت ذاتی کم خود نسبت به بسیاری از زوجهای ردوکس، چگالی توان را تا حدودی محدود میکنند. [۵] [۶]
به عبارت دیگر، باتری جریان یک سلول الکتروشیمیایی است ، با این خاصیت که محلول یونی ( الکترولیت ) در خارج از سلول ذخیره [۷] شود (به جای سلول اطراف الکترودها) و می تواند به ترتیب وارد سلول شود. برای تولید برق ، مقدار کل برق قابل تولید به حجم الکترولیت در مخازن بستگی دارد.
باتری های جریان بر اساس اصول طراحی که توسط مهندسی الکتروشیمی ایجاد شده است، کنترل می شوند. [۸]
انواع
[ویرایش]انواع مختلفی از سلولهای جریان (باتری) از جمله باتریهای جریان معدنی و باتریهای جریان آلی ساخته شدهاند. [۹] در هر دسته، طراحی باتری جریان را می توان به باتری های جریان کامل، باتری های نیمه جریان و باتری های جریان بدون غشاء طبقه بندی کرد. تفاوت اساسی بین باتری های معمولی و سلول های جریان در این است که انرژی در مواد الکترود در باتری های معمولی ذخیره می شود، در حالی که در سلول های جریان در الکترولیت ذخیره می شود. طبقه بندی ثبت اختراع برای باتری های جریان تا سال 2021 به طور کامل توسعه نیافته است. طبقهبندی اختراع تعاونی ، RFBها را بهعنوان زیرردهای از پیل سوختی احیاکننده (H01M8/18) در نظر میگیرد، در نظر گرفتن سلولهای سوختی به عنوان زیر مجموعه باتریهای جریان مناسبتر است.
غیرآلی
[ویرایش]غیر آلی جریان کامل
[ویرایش]سلول ردوکس (کاهش-اکسیداسیون) یک سلول برگشت پذیر است که در آن گونه های فعال ردوکس در محیط (مایع یا گاز) قرار دارند. باتری های جریان ردوکس سلول های قابل شارژ ( ثانویه ) هستند. از آنجایی که آنها از انتقال الکترون ناهمگن به جای انتشار حالت جامد یا درون یابی استفاده می کنند، بیشتر شبیه سلول های سوختی هستند تا باتری های معمولی (مانند اسید سرب یا یون لیتیوم ). دلیل اصلی اینکه سلول های سوختی به عنوان باتری در نظر گرفته نمی شوند، این است که در ابتدا (در دهه 1800) پیل های سوختی به عنوان وسیله ای برای تولید برق مستقیم از سوخت (و هوا) از طریق یک فرآیند الکتروشیمیایی غیر احتراق ظاهر شدند. بعدها، به ویژه در دهه های 1960 و 1990، سلول های سوختی قابل شارژ (به عنوان مثال H
2</br> H
2 / O
2</br> O
2 ، مانند سلول های سوختی احیا کننده واحد در نمونه اولیه هلیوس ناسا ) توسعه یافتند.
نمونه هایی از باتری های جریان ردوکس عبارتند از: باتری جریان ردوکس وانادیوم، باتری پلی سولفید بروماید (Regenesys)، باتری جریان اکسیداسیون و کاهش آهن (IRFB) و باتری جریان اکسیداسیون و کاهش اورانیوم. اگرچه دستگاه های زیادی مطرح شده اند اما سلول های سوختی ردوکس از نظر تجاری کمتر رایج هستند.
باتریهای جریان ردوکس وانادیوم به دلیل مزایایی که نسبت به سایر مواد شیمیایی دارند، علیرغم چگالی انرژی و توان محدود، پرفروشترین باتریهای جریان هستند. از آنجایی که آنها از وانادیوم در هر دو الکترود استفاده می کنند، دچار آلودگی متقاطع نمی شوند. با این حال، حلالیت محدود نمک های وانادیوم، این مزیت را در عمل خنثی می کند. مهمتر از آن برای موفقیت تجاری VRFBها در واقع تطابق تقریباً کامل روزنه ولتاژ رابط کربن/اسید آبی با محدوده ولتاژ کاری زوجهای ردوکس وانادیوم است. این امر دوام الکترودهای کربنی کمهزینه و تأثیر کم واکنشهای جانبی، مانند تحولات H2 و O2 را تضمین میکند، که منجر به عمر طولانی (سالهای متمادی) و چرخه (15000-20000 چرخه) میشود که به نوبه خود نتیجه میدهد. در هزینه کم سابقه انرژی (LCOE، یعنی هزینه سیستم تقسیم بر انرژی قابل استفاده، عمر چرخه، و بازده رفت و برگشت). عمر طولانی باتری های جریانی امکان استهلاک هزینه سرمایه نسبتاً بالای آنها (به دلیل وانادیوم، نمدهای کربنی، صفحات دوقطبی، غشاها) را فراهم می کند. هزینه یکسان سازی شده انرژی برای VRFB ها به ترتیب چند ده دلار سنت یا سنت یورو در هر کیلووات ساعت است که بسیار کمتر از باتری های حالت جامد است و با اهداف 0.05 دلار و 0.05 یورو که توسط ایالات متحده و اتحادیه اروپا اعلام شده است فاصله زیادی ندارد. سازمان های دولتی. [۱۰] چالش های اصلی برای اجرای گسترده عبارتند از: فراوانی کم و هزینه های بالای V 2 O 5 (> 30 دلار / کیلوگرم)، مواد خام برای VRFB. واکنش های پارازیت از جمله تکامل هیدروژن و اکسیژن. و رسوب V 2 O 5 در طول دوچرخه سواری. این نیروی محرکه اصلی برای توسعه فناوری باتری های جریان جایگزین است.
باتریهای جریان شیمیایی مرسوم ، هم انرژی ویژه پایینی دارند (که آنها را برای وسایل نقلیه کاملاً الکتریکی بسیار سنگین میکند) و هم قدرت ویژه پایین (که آنها را برای ذخیره انرژی ثابت بسیار گران میکند). با این حال، قدرت بالای 1.4 وات بر سانتیمتر مربع برای باتریهای جریان هیدروژن-برم و انرژی ویژه بالا (530 وات ساعت بر کیلوگرم در سطح مخزن) برای باتریهای جریان هیدروژن-برومات نشان داده شد [۱۱] [۱۲] [۱۳] ]. [۱۴]
در سال 2022، Influit Energy با بودجه DARPA SBIR یک نانوالکترو سوخت غیرقابل اشتعال و اصلاح شده با سطحی را اعلام کرد که از یک اکسید فلزی معلق در یک محلول آبی ساخته شده است. این ماده حتی در غلظت بالا و ویژگی ها و چگالی انرژی بالاتر از باتری های Lion از محلول خارج نمی شود. دمای عملیاتی 40- تا 80 درجه سانتی گراد است. آنها به لیتیوم، فلزات سنگین یا عناصر کمیاب نیاز ندارند. [۱۵] [۱۶]
RFB های نیمه جریان غیر آلی
[ویرایش]باتری جریان هیبریدی از یک یا چند جزء الکترواکتیو استفاده می کند که به عنوان یک لایه جامد قرار گرفته اند. نقطه ضعف اصلی اتلاف انرژی و توان است که در باتری های جریان کامل با استفاده از الکترود حالت جامد دیده می شود. سلول شامل یک الکترود باتری و یک الکترود پیل سوختی است. این نوع از نظر انرژی توسط سطح الکترود محدود می شود. باتریهای جریان هیبریدی شامل باتریهای روی-برم ، روی-سریم ، محلول سرب-اسید ، [۱۷] و باتریهای جریان آهن-نمک هستند. ونگ و همکاران [۱۸] یک باتری هیبریدی قابل شارژ هیبرید وانادیوم فلزی با OCV آزمایشی 1.93 ولت و ولتاژ کاری 1.70 ولت را گزارش کردند که مقادیر نسبتاً بالایی در میان باتریهای جریان قابل شارژ با الکترولیتهای آبی دارد. این باتری هیبریدی از یک الکترود مثبت گرافیتی تشکیل شده است که در محلول مخلوط VOSO
4</br> VOSO
4 و H
2SO
4</br> H
2SO
4</br> H
2SO
4 و یک الکترود منفی هیدرید فلز در محلول آبی KOH . دو الکترولیت با pH متفاوت توسط یک غشای دوقطبی از هم جدا می شوند. این سیستم برگشت پذیری خوب و راندمان بالایی را در کولن (95٪)، انرژی (84٪) و ولتاژ (88٪) نشان داد. آنها بهبودهای بیشتر این زوج ردوکس را با دستاوردهای افزایش چگالی جریان، گنجاندن الکترودهای 100 سانتی متر مربع بزرگتر و عملکرد 10 سلول بزرگ به صورت سری گزارش کردند. دادههای اولیه با استفاده از ورودی توان شبیهسازی شده نوسانی، قابلیت حیات را در ذخیرهسازی مقیاس کیلووات ساعت آزمایش کردند. [۱۹] در سال 2016، یک باتری جریان هیبریدی Mn(VI)/Mn(VII)-Zn با چگالی انرژی بالا پیشنهاد شد.
نمونه اولیه باتری جریان روی - پلی یدید چگالی انرژی 167 Wh/L ( وات ساعت در لیتر ) را نشان داد. سلول های روی برومید قدیمی تر به 70 Wh/L می رسند. برای مقایسه، باتریهای لیتیوم فسفات آهن ۲۳۳ Wh/L ذخیره میکنند. با توجه به عدم وجود الکترولیت های اسیدی، غیر قابل اشتعال بودن و محدوده عملکرد −۴ تا ۱۲۲ درجه فارنهایت (−۲۰ تا ۵۰ درجه سلسیوس) باتری، ادعا می شود که باتری روی-پلی یداید ایمن تر از سایر باتری های جریان است. که به مدار خنک کننده گسترده نیاز ندارد، که باعث اضافه وزن و اشغال فضا می شود. یکی از مسائل حل نشده تجمع روی در الکترود منفی است که می تواند به غشاء نفوذ کند و کارایی را کاهش دهد. به دلیل تشکیل دندریت روی، باتری های هالید روی نمی توانند با چگالی جریان بالا کار کنند (> 20 mA/cm 2 ) و بنابراین چگالی توان محدودی دارند. افزودن الکل به الکترولیت باتری ZnI می تواند به حل این مشکل کمک کند. [۲۰] معایب Zn/I RFB در هزینه بالای نمک های یدید (> 20 دلار / کیلوگرم) است. ظرفیت منطقه محدود رسوب روی نیز انرژی و توان جدا شده و همچنین دندریت روی را از دست می دهد.
هنگامی که باتری به طور کامل تخلیه شد، هر دو مخزن محلول الکترولیت یکسانی را نگه می دارند: مخلوطی از یون های روی با بار مثبت ( Zn2+
) و یون یدید با بار منفی، ( I−
). هنگامی که یک مخزن شارژ می شود، یک یون منفی دیگر، پلی یدید، نگه می دارد ( I−
3 ). باتری با پمپاژ مایع از مخازن خارجی به قسمت پشته باتری که مایعات مخلوط می شوند، نیرو تولید می کند. در داخل پشته، یون های روی از یک غشای انتخابی عبور می کنند و در سمت منفی پشته به روی فلزی تبدیل می شوند. [۲۱] برای افزایش بیشتر چگالی انرژی باتری جریان روی-یدید، یون های برمید ( Br
– ) به عنوان عامل کمپلکس کردن برای تثبیت ید آزاد، تشکیل یون های ید-برومید(I
2Br−
) ،به عنوان وسیله ای برای آزاد کردن یون های یدید ، برای ذخیره بار استفاده می شود. [۲۲]
باتریهای جریان پروتون (PFB) یک الکترود ذخیرهسازی هیدرید فلزی را در یک سلول سوختی غشای تبادل پروتون برگشتپذیر (PEM) ادغام میکنند. در طول شارژ، PFB یون های هیدروژن تولید شده از شکافتن آب را با الکترون ها و ذرات فلزی در یک الکترود یک پیل سوختی ترکیب می کند. انرژی به شکل یک هیدرید فلزی حالت جامد ذخیره می شود. تخلیه زمانی که فرآیند معکوس شده و پروتون ها با اکسیژن محیط ترکیب می شوند، برق و آب تولید می کند. فلزات ارزانتر از لیتیوم قابل استفاده هستند و چگالی انرژی بیشتری نسبت به سلولهای لیتیوم ارائه میکنند.
ارگانیک. آلی
[ویرایش]در مقایسه با باتریهای جریان ردوکس که غیرآلی هستند، مانند باتریهای جریان ردوکس وانادیوم و باتریهای Zn-Br2، که برای دههها ساخته شدهاند، باتریهای جریان ردوکس آلی در سال 2009 ظاهر شدند. جذابیت اصلی باتریهای جریان ردوکس آلی در ویژگیهای ردوکس قابل تنظیم اجزای فعال ،نهفته است. از سال 2021، RFB ارگانیک دوام پایینی را تجربه میکند (یعنی عمر سالیانه یا چرخه، یا هر دو). به همین دلیل، تنها RFB معدنی در مقیاس تجاری نشان داده شده است. [۲۳]
باتری های جریان ردوکس آلی را می توان بیشتر به دو دسته آبی (AORFBs) و غیر آبی (NAORFBs) طبقه بندی کرد. [۲۴] [۲۵] AORFB ها از آب به عنوان حلال برای مواد الکترولیت استفاده می کنند در حالی که NAORFB ها از حلال های آلی استفاده می کنند. AORFB ها و NAORFB ها را می توان به سیستم های آلی کل و ترکیبی تقسیم کرد. اولی فقط از مواد آلی الکترود استفاده می کند، در حالی که دومی از مواد معدنی برای آند یا کاتد استفاده می کند. در ذخیره سازی انرژی در مقیاس بزرگتر، هزینه کمتر حلال و رسانایی بالاتر به AORFBها پتانسیل تجاری بیشتری می دهد و همچنین مزایای ایمنی الکترولیت های مبتنی بر آب را ارائه می دهد. در عوض NAORFB ها دریچه ولتاژ بسیار بزرگتری ارائه می دهند و فضای فیزیکی کمتری را اشغال می کنند.
PH خنثی AORFBs
[ویرایش]AORFBهای خنثی با pH در شرایط pH7 کار میکنند و معمولاً از NaCl به عنوان الکترولیت پشتیبانی میکنند. در شرایط pH خنثی، مولکول های آلی و آلی فلزی پایدارتر از شرایط اسیدی و قلیایی خورنده هستند. به عنوان مثال، K4[Fe(CN)]، یک کاتولیت رایج مورد استفاده در AORFBs، در محلول های قلیایی پایدار نیست اما در شرایط pH خنثی است. [۲۶]
AORFBها از متیل ویولوژن به عنوان آنولیت و 4-هیدروکسی-2،2،6،6-تترامتیل پیپریدین-1-اکسیل به عنوان یک کاتولیت در شرایط pH خنثی، به علاوه NaCL و یک غشای تبادل آنیونی کم هزینه استفاده کردند. این سیستم MV/TEMPO دارای بالاترین ولتاژ سلول، 1.25 Vاست و احتمالاً کمترین هزینه سرمایه (180 دلار در کیلووات ساعت) برای AORFBها گزارش شده است. الکترولیت های مایع آبی به عنوان جایگزینی برای سیستم های فعلی بدون جایگزینی زیرساخت های موجود طراحی شده اند. یک باتری آزمایشی 600 میلیواتی برای 100 سیکل با بازدهی نزدیک به 100 درصد در چگالیهای جریان بین 20 تا 100 میلیآمپر بر سانتیمتر مربع ، با عملکرد بهینه با رتبهبندی 40 تا 50 پایدار بود. میلی آمپر، که در آن حدود 70 درصد ولتاژ اولیه باتری حفظ می شد. [۲۷] [۲۸] AORFB های خنثی می توانند نسبت به AORFB های اسیدی یا قلیایی سازگارتر با محیط زیست باشند در حالی که عملکرد الکتروشیمیایی قابل مقایسه با RFB های خورنده را نشان می دهند. MV/TEMPO AORFB با محدودیت در سمت TEMPOدارای چگالی انرژی 8.4 Wh/L است . باتری های جریانی مبتنی بر Viologen عمدتا توسط گروه لیو در دانشگاه ایالتی یوتا ساخته شده اند. در سال 2019، این گروه یک AORFB سولفونات - ویولوژن / فروسیانید فوق سبک را گزارش کرد که برای 1000 چرخه با چگالی انرژی 10 Wh / L پایدار است، که تا کنون پایدارترین AORFB متراکم انرژی است. [۲۹]
AORFB های اسیدی
[ویرایش]کینون ها و مشتقات آنها اساس بسیاری از سیستم های ردوکس آلی هستند. [۳۰] [۳۱] [۳۲] در یک مطالعه، 1،2-دی هیدروبنزوکینون-3،5-دی سولفونیک اسید (BQDS) و 1،4-دی هیدروبنزوکینون-2-سولفونیک اسید (BQS) به عنوان کاتد استفاده شد و Pb/ PbSO4 معمولی آنولیت در یک هیبرید بود. اسید AORFB. کینون ها دو واحد بار الکتریکی را می پذیرند، در مقایسه با یک واحد در کاتولیت معمولی، به این معنی که چنین باتری می تواند دو برابر بیشتر انرژی را در یک حجم معین ذخیره کند.
کینون 9،10-آنتراکینون-2،7-دی سولفونیک اسید (AQDS)، ارزیابی شده است. AQDS در یک الکترود کربن شیشه ای در اسید سولفوریک تحت احیای سریع و برگشت پذیر دو الکترون/دو پروتون قرار می گیرد. یک باتری جریان آبی با الکترودهای کربن ارزان قیمت، ترکیبی از زوج کینون/هیدروکینون با Br−
/Br
2زوج ردوکس ، حداکثر چگالی توان گالوانیکی بیش از 6000 W/m 2 در 13000 A/m 2. تولید می کند چرخه زنی نشان داد < حفظ ظرفیت ذخیره سازی 99 درصد در هر چرخه>. چگالی انرژی حجمی بیش از 20 Wh/L بود. آنتراکینون-2-سولفونیک اسید و آنتراکینون-2،6-دی سولفونیک اسید در سمت منفی و 1،2 -دی هیدروبنزوکینون-3،5-دی سولفونیک اسید در سمت مثبت از استفاده از Br2 خطرناک جلوگیری می کند. ادعا شده است که باتری 1000 چرخه بدون تخریب دوام می آورد. [۳۳] در حالی که این سیستم قوی به نظر می رسد، ولتاژ سلولی پایینی دارد (حدود 0.55 V) و چگالی انرژی کم (<4 Wh/L).
اسید هیدروبرومیک که به عنوان الکترولیت استفاده می شود با محلول قلیایی کمتر سمی جایگزین شده است (1 M KOH ) و فروسیانید . [۳۴] PH بالاتر خورندگی کمتری دارد و امکان استفاده از مخازن پلیمری ارزان قیمت را فراهم می کند. افزایش مقاومت الکتریکی در غشا با افزایش ولتاژ جبران شد. ولتاژ سلولV 1.2 بود .[۳۵] [۳۶]راندمان سلول بیش از 99٪ بود، در حالی که راندمان رفت و برگشت 84٪ اندازه گیری شد. عمر باتری حداقل 1000 چرخه را ارائه می دهد. چگالی انرژی نظری آن Wh/L19 بود [۳۷] پایداری شیمیایی فروسیانید در محلول KOH با pH بالا بدون تشکیل Fe(OH) 2 یا Fe(OH) 3 باید قبل از افزایش مقیاس تایید شود.
ادغام هر دو آنولیت و کاتولیت در یک مولکول مورد بررسی قرار گرفته است. چنین آنالیتهای دو عملکردی [۳۸] یا مولکولهای ترکیبی [۳۹] امکان استفاده از یک ماده را در هر دو مخزن میدهند. در یک مخزن آن یکی ، دهنده الکترون است، در حالی که در دیگری گیرنده الکترون است. این دارای مزایای مرتبطی مانند کاهش اثر متقاطع است. [۴۰] بنابراین، مولکولهای کینون دیآمینوآنتراکینون [۴۰] و مولکولهای مبتنی بر نیل [۳۸] و همچنین مولکولهای ترکیبکننده TEMPO/ فنازین [۳۹] الکترولیتهای بالقوهای برای توسعه باتریهای متقارن ردوکس جریان (SRFB) هستند.
رویکرد دیگری یک رادیکال بلاتر را به عنوان اهداکننده/گیرنده اتخاذ کرد. 275 چرخه شارژ و دشارژ را در آزمایشات تحمل کرد، اگرچه محلول در آب نبود. [۴۱]
قلیایی
[ویرایش]مولکول های کینون به عنوان آنولیت در AROFB های قلیایی استفاده شده است. یکی دیگر از کاندیدهای آنولیت فلورنون است که برای افزایش حلالیت در آب مهندسی مجدد شده است. یک سلول نمایشی هیدروژن زدایی کتون برگشت پذیر به مدت 120 روز در 1111 چرخه شارژ در دمای اتاق بدون کاتالیزور به طور مداوم کار کرد و 97 درصد ظرفیت را حفظ کرد. این سلول بیش از دو برابر چگالی انرژی سیستم های مبتنی بر وانادیوم را ارائه می دهد. [۴۲] [۴۳] چالش اصلی برای AORFB های قلیایی فقدان یک کاتولیت پایدار است که چگالی انرژی خود را زیر 5 Wh/L نگه می دارد. همه AORFB های قلیایی گزارش شده از کاتولیت فروسیانید پتاسیم اضافی به دلیل مشکل پایداری فروسیانید در محلول های قلیایی استفاده می کنند.
باتری های جریان فلز-آلی از لیگاندهای آلی برای بهبود خواص فلزات فعال ردوکس استفاده می کنند. لیگاندها می توانند کلات هایی مانند EDTA باشند و می توانند الکترولیت را در شرایط خنثی یا قلیایی قرار دهند که در غیر این صورت کمپلکس های آبی فلزی رسوب می کنند. با مسدود کردن هماهنگی آب با فلز، لیگاندهای آلی می توانند واکنش های تجزیه آب کاتالیز شده توسط فلز را مهار کنند و در نتیجه سیستم های تمام آبی ولتاژ بالاتری ایجاد کنند. به عنوان مثال، استفاده از کروم هماهنگ شده با 1،3-پروپاندی آمین تترا استات (PDTA)، پتانسیل سلولی 1.62 V در مقابل فروسیانید و رکورد 2.13 V در مقابل برم را ایجاد کرد. [۴۴] باتریهای جریان آلی فلزی ممکن است به عنوان باتریهای جریان شیمی هماهنگی شناخته شوند که نشاندهنده فناوری پشت فنآوری Gridstar Flow لاکهید مارتین است. [۴۵]
الیگومر
[ویرایش]الیگومر ردوکس گونه RFB برای کاهش متقاطع گونه های الکترواکتیو، در حالی که از غشاهای کم هزینه استفاده می شود، پیشنهاد شده است. چنین الیگومرهای فعال ردوکس به عنوان ردوکسایمر شناخته می شوند. یک سیستم از پلیمرهای آلی و محلول نمکی با غشای سلولزی استفاده می کند. نمونه اولیه با حفظ ظرفیت قابل توجهی، 10000 چرخه شارژ را پشت سر گذاشت. چگالی انرژی 10 Wh/L بود. [۴۶] چگالی جریان به 100 میلی آمپر بر سانتی متر مربع رسید. [۴۷]
الیگومر دیگری RFB از ردوکسایمرهای ویولوژن و TEMPO در ترکیب با غشاهای دیالیز ارزان قیمت استفاده می کند. ماکرومولکول های عامل دار (مشابه شیشه اکریلیک یا استایروفوم ) محلول در آب ماده الکترود فعال هستند. غشای نانومتخلخل مقدار-انتخابی مانند یک صافی کار می کند و نسبت به غشاهای انتخابی یونی معمولی راحت تر و با هزینه کمتر تولید می شود. مولکولهای پلیمری بزرگ «اسپاگتی» مانند را حفظ میکند، در حالی که اجازه میدهد ضدیونهای کوچک عبور کنند. [۴۸] این مفهوم ممکن است هزینه های بالای غشاء سنتی Nafion را حل کند، اما طراحی و سنتز پلیمر فعال ردوکس با حلالیت در آب زیاد بی اهمیت نیست. تا کنون، RFB ها با گونه های ردوکس الیگومر ، قدرت رقابتی منطقه خاص را نشان نداده اند. مشخص نیست که آیا چگالی جریان عملیاتی کم یکی از ویژگی های ذاتی مولکول های ردوکس بزرگ است یا خیر.
بدون غشاء
[ویرایش]یک باتری بدون غشاء [۴۹] متکی به جریان آرام است که در آن دو مایع از طریق یک کانال پمپ می شوند، جایی که آنها تحت واکنش های الکتروشیمیایی برای ذخیره یا آزاد کردن انرژی قرار می گیرند. محلول ها به صورت موازی و با کمی مخلوط شدن جریان پیدا می کنند. جریان به طور طبیعی مایعات را جدا می کند و نیاز به غشاء ندارد.
غشاء و فرآیندهای غشایی اغلب پرهزینه ترین و کم اطمینان ترین اجزای باتری ها هستند، زیرا ممکن است در اثر قرار گرفتن مکرر در معرض واکنش دهنده های خاص خورده شوند. عدم وجود غشاء استفاده از محلول برم مایع و هیدروژن را امکان پذیر می کند: این ترکیب در هنگام استفاده از غشاها مشکل ساز است، زیرا آنها اسید هیدروبرومیک را تشکیل می دهند که می تواند غشا را از بین ببرد. هر دو ماده با هزینه کم در دسترس هستند. این طرح از یک کانال کوچک بین دو الکترود استفاده می کند. برم مایع از طریق کانال روی یک کاتد گرافیت و اسید هیدروبرومیک در زیر یک آند متخلخل جریان دارد. در همان زمان، گاز هیدروژن در سراسر آند جریان می یابد. واکنش شیمیایی را می توان برای شارژ مجدد باتری معکوس کرد ( اولین مورد برای هر طراحی بدون غشاء). یکی از این باتریهای جریان بدون غشاء که در آگوست 2013 منتشر شد، حداکثر چگالی توان 0.795 میلیوات بر سانتیمتر مربع، سه برابر بیشتر از دیگر سیستمهای بدون غشاء قدرت و مرتبهای بالاتر از باتریهای لیتیوم یونی تولید می کند.
در سال 2018، یک باتری جریان ردوکس بدون غشاء در مقیاس ماکرو با قابلیت شارژ مجدد و چرخش مجدد جریان های الکترولیت مشابه برای چرخه های متعدد نشان داده شده است. این باتری مبتنی بر کاتولیت آلی غیرقابل اختلاط و مایعات آنولیت آبی است که در حین چرخه زنی ظرفیت نگهداری و کارایی کولمبیکی بالایی را نشان می دهد. [۵۰]
شبکه نانو
[ویرایش]سیستم لیتیوم-گوگردی که در شبکه ای از نانوذرات چیده شده است، نیاز به حرکت بار در داخل و خارج از ذرات که در تماس مستقیم با صفحه رسانا هستند را حذف می کند. در عوض، شبکه نانوذرات اجازه میدهد الکتریسیته در سراسر مایع جریان یابد. این اجازه می دهد تا انرژی بیشتری استخراج شود.
سایر مواد شیمیایی
[ویرایش]سایر باتری های نوع جریان عبارتند از: باتری جریان هیبریدی روی-سریم، باتری جریان هیبریدی روی-برم و باتری هیدروژن برم .
سایر باتری های نوع جریان
[ویرایش]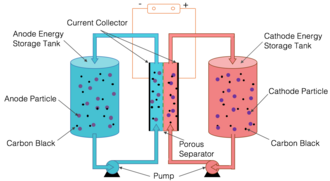
در یک سلول جریان نیمه جامد، الکترودهای مثبت و منفی از ذرات معلق در یک مایع حامل تشکیل شده اند. تعلیق مثبت و منفی در مخازن جداگانه ذخیره می شود و از طریق لوله های جداگانه به پشته ای از محفظه های واکنش مجاور پمپ می شود، جایی که آنها توسط یک مانع مانند یک غشای نازک و متخلخل از هم جدا می شوند. این رویکرد ساختار اصلی باتریهای جریان آبی را که از مواد الکترود معلق در یک الکترولیت مایع استفاده میکنند، با شیمی باتریهای لیتیوم یون در هر دو سوسپانسیون بدون کربن و دوغاب با شبکه کربن رسانا ترکیب میکند. باتری جریان ردوکس نیمه جامد بدون کربن نیز گاهی اوقات به عنوان باتری جریان ردوکس با پراکندگی جامد شناخته می شود. انحلال یک ماده رفتار شیمیایی آن را به طور قابل توجهی تغییر می دهد. با این حال، تعلیق قطعات مواد جامد ویژگی های جامد را حفظ می کند. نتیجه یک سوسپانسیون چسبناک است که مانند ملاس جریان دارد.
مواد جامد با هدف ردوکس
[ویرایش]باتریهای جریان با مواد جامد هدفدار ردوکس (ROTS) که به عنوان تقویتکننده انرژی جامد (SEB) نیز شناخته میشوند، یکی دیگر از پیشرفتهای اخیر است. [۵۲]
در این باتریها یا پوزولیت یا نگولیت یا هر دو (معروف به سیالات ردوکس)، با یک یا چند ماده جامد الکتریکی که در مخازن خارج از پشته برق ذخیره میشوند، در تماس هستند. سیالات ردوکس شامل یک یا چند زوج ردوکس هستند که پتانسیلهای ردوکس در کنار پتانسیل ردوکس مواد جامد الکتریسیته هستند. چنین RFBهایی با تقویتکنندههای انرژی جامد (SEB) مزیت انرژی ویژه بالای باتریهای معمولی (مانند لیتیوم یون ) را با مزیت انرژی جداشده باتریهای جریان ترکیب میکنند. RFB های SEB(ROTS) در مقایسه با RFB های نیمه جامد دارای مزایای متعددی هستند، مانند عدم نیاز به پمپاژ دوغاب چسبناک، بدون ته نشینی / گرفتگی، قدرت ویژه-سطح بالاتر، دوام بیشتر، فضای طراحی شیمیایی وسیع تر.
| زوج | حداکثر ولتاژ سلول (V) | میانگین چگالی توان الکترود (W/m 2 ) | میانگین چگالی انرژی سیال | چرخه ها |
|---|---|---|---|---|
| هیدروژن - لیتیوم برومات | 1.1 | 15000 | 750 ساعت بر کیلوگرم | |
| هیدروژن – لیتیوم کلرات | 1.4 | 10000 | 1400 ساعت بر کیلوگرم | |
| برم - هیدروژن | 1.07 | 7950 | ||
| آهن – قلع | 0.62 | < 200 | ||
| آهن – تیتانیوم | 0.43 | < 200 | ||
| آهن – کروم | 1.07 | < 200 | ||
| آهن – آهن | 1.21 | < 1000 | 20 Wh/L | 10000 |
| ارگانیک (2013) | 0.8 | 13000 | 21.4 Wh/L | 10 |
| ارگانیک (2015) | 1.2 | 7.1 Wh/L | 100 | |
| MV-TEMPO | 1.25 | 8.4 Wh/L | 100 | |
| سولفونات ویولوژن (NH4)4[Fe(CN)6] | 0.9 | > 500 | 10 Wh/L | 1000 |
| فلز-آلی – فروسیانید [۴۴] | 1.62 | 2000 | 21.7 Wh/L | 75 |
| فلز-آلی – برم [۴۴] | 2.13 | 3000 | 35 Wh/L | 10 |
| وانادیوم-وانادیوم (سولفات) | 1.4 | ~800 | 25 Wh/L | |
| وانادیوم-وانادیوم (برمید) | 50 Wh/L | 2000 [۲] | ||
| پلی سولفید سدیم-برم | 1.54 | ~800 | ||
| سدیم-پتاسیم [۵۳] | ||||
| گوگرد-اکسیژن-نمک [۵۴] | ||||
| روی – برم | 1.85 | ~ 1000 | 75 ساعت بر کیلوگرم | > 2000 |
| سرب اسید (متان سولفونات) | 1.82 | ~ 1000 | ||
| روی-سریم (متان سولفونات) | 2.43 | < 1200-2500 | ||
| Zn-Mn(VI)/Mn(VII) | 1.2 | 60 Wh/L |
باتریهای جریان روی برم قدیمیترین باتریها هستند که منشأ آنها به دهه 1880 برمیگردد. [۵۵]
مزایا
[ویرایش]باتری های جریان ردوکس و تا حدی باتری های جریان هیبریدی دارای مزایای زیر هستند:
- چیدمان انعطاف پذیر (به دلیل تفکیک اجزای برق و انرژی)
- عمر چرخه طولانی (چون هیچ انتقال فاز جامد به جامد وجود ندارد)
- زمان پاسخگویی سریع
- بدون نیاز به شارژ یکسان (شارژ بیش از حد باتری برای اطمینان از شارژ یکسان همه سلول ها)
- بدون انتشارات مضر
برخی از انواع نیز تعیین وضعیت شارژ آسان (از طریق وابستگی ولتاژ به شارژ)، تعمیر و نگهداری کم و تحمل در برابر شارژ/تخلیه بیش از حد را ارائه می دهند.
آنها امن هستند زیرا
- آنها معمولاً حاوی الکترولیت های قابل اشتعال نیستند
- الکترولیت ها را می توان دور از پشته برق ذخیره کرد.
این ویژگیهای فنی، باتریهای جریان ردوکس را به گزینهای مناسب برای ذخیرهسازی انرژی در مقیاس بزرگ تبدیل میکند.
معایب
[ویرایش]باتری های جریان دار در مقایسه با باتری های با مواد جامد الکترو اکتیو سه ضعف اصلی دارند [۵۵]
- چگالی انرژی کم (شما به مخازن بزرگ الکترولیت برای ذخیره مقادیر مفید انرژی نیاز دارید)
- نرخ شارژ و دشارژ پایین (در مقایسه با سایر فرآیندهای الکترود صنعتی). این بدان معنی است که الکترودها و جداکننده های غشایی باید بزرگ باشند که هزینه برق را افزایش می دهد.
- باتری های جریان بازده انرژی پایین تری دارند، زیرا در چگالی جریان بالاتر کار می کنند تا اثرات متقاطع (خود تخلیه داخلی) را به حداقل برسانند و هزینه برق را کاهش دهند.
باتریهای جریان معمولاً بازده انرژی بالاتری نسبت به سلولهای سوختی دارند ، اما کمتر از باتریهای لیتیوم یونی . [۵۶]
برنامه های کاربردی
[ویرایش]باتری های جریان معمولاً نسبتاً بزرگ در نظر گرفته می شوند (1 کیلووات ساعت - 10 مگاوات ساعت) کاربردهای ثابت با چرخه شارژ-دشارژ چند ساعته. [۵۷] باتری های جریانی برای زمان های شارژ/دشارژ کوتاه تر مقرون به صرفه نیستند. نمونه هایی از بازار باتری های جریانی عبارتند از:
- تعادل بار - جایی که باتری به یک شبکه الکتریکی متصل می شود تا نیروی الکتریکی اضافی را در ساعات کم بار ذخیره کند و در دوره های اوج تقاضا برق را آزاد کند. مشکل رایج محدود کردن استفاده از اکثر شیمی باتری های جریان در این برنامه، توان منطقه ای کم آنها (چگالی جریان عملیاتی) است که به هزینه بالای انرژی تبدیل می شود.
- ذخیره انرژی از منابع تجدیدپذیر مانند باد یا خورشید برای تخلیه در دوره های اوج تقاضا.
- اوج اصلاح، که در آن افزایش تقاضا توسط باتری برآورده می شود.
- یو پی اس ، جایی که اگر برق اصلی نتواند یک منبع تغذیه بدون وقفه را تامین کند، از باتری استفاده می شود.
- تبدیل توان - از آنجایی که همه سلول ها الکترولیت(های) یکسانی دارند، الکترولیت ها ممکن است با استفاده از تعداد مشخصی سلول شارژ شوند و با تعداد متفاوتی تخلیه شوند. از آنجایی که ولتاژ باتری با تعداد سلول های استفاده شده متناسب است، باتری می تواند به عنوان یک مبدل DC-DC بسیار قدرتمند عمل کند. علاوه بر این، اگر تعداد سلول ها به طور مداوم تغییر کند (در سمت ورودی و/یا خروجی) ، تبدیل توان نیز می تواند AC/DC، AC/AC، یا DC-AC با فرکانس محدود شده توسط دنده سوئیچینگ باشد.
- وسایل نقلیه الکتریکی – از آنجایی که باتریهای جریان را میتوان با جایگزینی الکترولیت به سرعت «شارژ» کرد، میتوان از آنها برای کاربردهایی استفاده کرد که در آن وسیله نقلیه به سرعت یک وسیله نقلیه موتور احتراقی انرژی دریافت کند. یک مشکل رایج که در بیشتر شیمی های RFB در کاربردهای EV یافت می شود، چگالی انرژی کم آنهاست که به یک برد کوتاه تبدیل می شود. باتریهای روی کلر و باتریهای با هالاتهای بسیار محلول، استثنای قابلتوجهی هستند.
- سیستم برق مستقل – نمونه ای از این در ایستگاه های پایه تلفن همراه است که در آن برق شبکه در دسترس نیست. باتری را می توان در کنار منابع انرژی خورشیدی یا بادی برای جبران سطوح نوسان قدرت آنها و در کنار یک ژنراتور برای استفاده بهینه از آن برای صرفه جویی در سوخت استفاده کرد.
همچنین ببینید
[ویرایش]منابع
[ویرایش]- ↑ Qi, Zhaoxiang; Koenig, Gary M. (2017-05-12). "Review Article: Flow battery systems with solid electroactive materials". Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena. 35 (4): 040801. Bibcode:2017JVSTB..35d0801Q. doi:10.1116/1.4983210. ISSN 2166-2746.
- ↑ ۲٫۰ ۲٫۱ Badwal, Sukhvinder P. S.; Giddey, Sarbjit S.; Munnings, Christopher; Bhatt, Anand I.; Hollenkamp, Anthony F. (24 September 2014). "Emerging electrochemical energy conversion and storage technologies". Frontiers in Chemistry. 2: 79. Bibcode:2014FrCh....2...79B. doi:10.3389/fchem.2014.00079. PMC 4174133. PMID 25309898.
- ↑ Alotto, P.; Guarnieri, M.; Moro, F. (2014). "Redox Flow Batteries for the storage of renewable energy: a review". Renewable & Sustainable Energy Reviews. 29: 325–335. doi:10.1016/j.rser.2013.08.001.
- ↑ "World's largest flow battery connected to the grid in China". New Atlas (به انگلیسی). 2022-10-03. Retrieved 2022-10-12.
- ↑ Aaron, Douglas (2013). "In Situ Kinetics Studies in All-Vanadium Redox Flow Batteries". ECS Electrochemistry Letters. 2 (3): A29–A31. doi:10.1149/2.001303eel.
- ↑ McCreery, Richard L. (July 2008). "Advanced Carbon Electrode Materials for Molecular Electrochemistry". Chemical Reviews (به انگلیسی). 108 (7): 2646–2687. doi:10.1021/cr068076m. ISSN 0009-2665. PMID 18557655.
- ↑ "Researchers Drastically Reduce The Cost of Redox Flow Batteries [$25 Per kWh]". TechReportArticles. 29 January 2021. Archived from the original on 16 April 2021. Retrieved 29 November 2022.
- ↑ Arenas, L.F.; Ponce de León, C.; Walsh, F.C. (June 2017). "Engineering aspects of the design, construction and performance of modular redox flow batteries for energy storage" (PDF). Journal of Energy Storage. 11: 119–153. doi:10.1016/j.est.2017.02.007.
- ↑ Luo, J.; Hu, B.; Hu, M.; Liu, T. L. (13 September 2019). "Status and Prospects of Organic Redox Flow Batteries towards Renewable Energy Storage". ACS Energy Lett. 2019, 4 (9): 2220–2240. doi:10.1021/acsenergylett.9b01332.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Spagnuolo, G.; Petrone, G.; Mattavelli, P.; Guarnieri, M. (2016). "Vanadium Redox Flow Batteries: Potentials and Challenges of an Emerging Storage Technology". IEEE Industrial Electronics Magazine. 10 (4): 20–31. doi:10.1109/MIE.2016.2611760.
{{cite journal}}:|hdl-access=requires|hdl=(help) - ↑ Cho, Kyu Taek; Tucker, Michael C.; Ding, Markus; Ridgway, Paul; Battaglia, Vincent S.; Srinivasan, Venkat; Weber, Adam Z. (2015). "Cyclic Performance Analysis of Hydrogen/Bromine Flow Batteries for Grid-Scale Energy Storage". ChemPlusChem. 80 (2): 402–411. doi:10.1002/cplu.201402043.
- ↑ Yu; Tolmachev, V. (2013). "Hydrogen-halogen electrochemical cells: A review of applications and technologies". Russian Journal of Electrochemistry. 50 (4): 301–316. doi:10.1134/S1023193513120069.
- ↑ Tolmachev, Yuriy V. (2015). "Energy cycle based on a high specific energy aqueous flow battery and its potential use for fully electric vehicles and for direct solar-to-chemical energy conversion". Journal of Solid State Electrochemistry. 19 (9): 2711–2722. doi:10.1007/s10008-015-2805-z.
- ↑ Tolmachev, Yuriy V. (2015). "Energy cycle based on a high specific energy aqueous flow battery and its potential use for fully electric vehicles and for direct solar-to-chemical energy conversion". Journal of Solid State Electrochemistry. 19 (9): 2711–2722. doi:10.1007/s10008-015-2805-z.
- ↑ Darpa Nanoelectrofuel Flow Battery (به انگلیسی), retrieved 2022-08-09
- ↑ Blain, Loz (2022-08-09). "Influit moves to commercialize its ultra-high density liquid batteries". New Atlas (به انگلیسی). Retrieved 2022-08-09.
- ↑ Krishna, M.; Fraser, E. J.; Wills, R. G. A.; Walsh, F. C. (2018-02-01). "Developments in soluble lead flow batteries and remaining challenges: An illustrated review". Journal of Energy Storage. 15: 69–90. doi:10.1016/j.est.2017.10.020. ISSN 2352-152X.
- ↑ J. Electrochem.
- ↑ J. Electrochem.
- ↑ Borghino, Dario (27 February 2015). "High-performance flow battery could rival lithium-ions for EVs and grid storage". Gizmag.
- ↑ White, Frances (25 February 2015). "New flow battery to keep big cities lit, green and safe". R&D.
- ↑ Weng, Guo-Ming (2017). "Unlocking the capacity of iodide for high-energy-density zinc/polyiodide and lithium/polyiodide redox flow batteries". Energy & Environmental Science. 10 (3): 735–741. doi:10.1039/C6EE03554J.
- ↑ M.Aziz et al.
- ↑ Brushett, Fikile; Vaughey, John; Jansen, Andrew (2012). "An All‐Organic Non‐aqueous Lithium‐Ion Redox Flow Battery". Advanced Functional Materials (به انگلیسی). 2 (11): 1390–1396. doi:10.1002/aenm.201200322.
- ↑ Bamgbopa, Musbaudeen O.; Shao-Horn, Yang; Almheiri, Saif (2017). "The potential of non-aqueous redox flow batteries as fast-charging capable energy storage solutions: demonstration with an iron–chromium acetylacetonate chemistry". Journal of Materials Chemistry A (به انگلیسی). 5 (26): 13457–13468. doi:10.1039/c7ta02022h. ISSN 2050-7488.
- ↑ Luo, J.; Sam, A.; Hu, B.; DeBruler C.; Liu, T. L. (2017). "Unraveling pH Dependent Cycling Stability of Ferricyanide / Ferrocyanide in Redox Flow Batteries". Nano Energy. 2017, 42: 215–221. doi:10.1016/j.nanoen.2017.10.057.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Moss, Richard (22 December 2015). "New flow battery projected to cost 60% less than existing standard". www.gizmag.com. Retrieved 23 December 2015.
- ↑ Liu, Tianbiao; Wei, Xiaoliang; Nie, Zimin; Sprenkle, Vincent; Wang, Wei (1 November 2015). "A Total Organic Aqueous Redox Flow Battery Employing a Low Cost and Sustainable Methyl Viologen Anolyte and 4-HO-TEMPO Catholyte". Advanced Energy Materials (به انگلیسی). 6 (3): 1501449. doi:10.1002/aenm.201501449. ISSN 1614-6840.
- ↑ Luo, J.; Hu, B.; DeBruler C.; Zhao, Y., Yuan B. Hu, M. Wu, W. Liu, T. L. "Unprecedented Capacity and Stability of Ammonium Ferrocyanide Catholyte in pH Neutral Aqueous Redox Flow Batteries". Joule. 4: 149–163.
{{cite journal}}: نگهداری یادکرد:نامهای متعدد:فهرست نویسندگان (link) - ↑ Gong, K; Fang, Q; Gu, S; Li, F.S.Y.; Yan, Y (2015). "Nonaqueous redox-flow batteries: organic solvents, supporting electrolytes, and redox pairs". Energy and Environmental Science (به انگلیسی). 8 (12): 3515–3530. doi:10.1039/C5EE02341F.
- ↑ Xu, Y.; Wen, Y.; Cheng, J.; Yanga, Y.; Xie, Z.; Cao, G. In World Non-Grid-Connected Wind Power and Energy Conference, 2009.
- ↑ Xu, Yan; Wen, Yue-Hua; Cheng, Jie; Cao, Gao-Ping; Yang, Yu-Sheng (2010). "A study of tiron in aqueous solutions for redox flow battery application". Electrochimica Acta. 55 (3): 715–720. doi:10.1016/j.electacta.2009.09.031. ISSN 0013-4686.
- ↑ Szondy, David (29 June 2014). "New water-based organic battery is cheap, rechargeable and eco-friendly". Gizmag.
- ↑ "A rechargeable battery to power a home from rooftop solar panels". phys.org.
- ↑ Matthew Gunther,ChemistryWorld. "Flow Battery Could Smooth Irregular Wind and Solar Energy Supply". Scientific American.
- ↑ Alkaline quinone flow battery Lin et al.
- ↑ Borghino, Dario (30 September 2015). "Greener, safer flow battery could store renewable energy on the cheap". www.gizmag.com. Retrieved 8 December 2015.
- ↑ ۳۸٫۰ ۳۸٫۱ Carretero-González, Javier; Castillo-Martínez, Elizabeth; Armand, Michel (2016). "Highly water-soluble three-redox state organic dyes as bifunctional analytes". Energy & Environmental Science (به انگلیسی). 9 (11): 3521–3530. doi:10.1039/C6EE01883A. ISSN 1754-5692.
- ↑ ۳۹٫۰ ۳۹٫۱ Winsberg, Jan; Stolze, Christian; Muench, Simon; Liedl, Ferenc; Hager, Martin D.; Schubert, Ulrich S. (2016-11-11). "TEMPO/Phenazine Combi-Molecule: A Redox-Active Material for Symmetric Aqueous Redox-Flow Batteries". ACS Energy Letters (به انگلیسی). 1 (5): 976–980. doi:10.1021/acsenergylett.6b00413. ISSN 2380-8195.
- ↑ ۴۰٫۰ ۴۰٫۱ Potash, Rebecca A.; McKone, James R.; Conte, Sean; Abruña, Héctor D. (2016). "On the Benefits of a Symmetric Redox Flow Battery". Journal of the Electrochemical Society (به انگلیسی). 163 (3): A338–A344. doi:10.1149/2.0971602jes. ISSN 0013-4651. OSTI 1370440.
- ↑ Lavars, Nick (2022-03-17). "Symmetrical flow battery may strike right balance for grid-scale storage". New Atlas (به انگلیسی). Retrieved 2022-03-18.
- ↑ Lavars, Nick (21 May 2021). "Candle compound brings high density to grid-scale battery technology". New Atlas (به انگلیسی). Retrieved 2021-05-26.
- ↑ Feng, Ruozhu; Zhang, Xin; Murugesan, Vijayakumar; Hollas, Aaron; Chen, Ying; Shao, Yuyan; Walter, Eric; Wellala, Nadeesha P. N.; Yan, Litao (2021-05-21). "Reversible ketone hydrogenation and dehydrogenation for aqueous organic redox flow batteries". Science (به انگلیسی). 372 (6544): 836–840. Bibcode:2021Sci...372..836F. doi:10.1126/science.abd9795. ISSN 0036-8075. PMID 34016776.
- ↑ ۴۴٫۰ ۴۴٫۱ ۴۴٫۲ Robb, Brian H.; Farrell, Jason M.; Marshak, Michael P. (2019). "Chelated Chromium Electrolyte Enabling High-Voltage Aqueous Flow Batteries". Joule (به انگلیسی). 3 (10): 2503–2512. doi:10.1016/j.joule.2019.07.002.
- ↑ "Energy Storage: GridStar Flow". Lockheed Martin. Retrieved 2020-07-27.
- ↑ "Chemists present an innovative redox-flow battery based on organic polymers and water". phys.org. Phys.org. 21 October 2015. Retrieved 6 December 2015.
- ↑ Janoschka, Tobias; Martin, Norbert; Martin, Udo; Friebe, Christian; Morgenstern, Sabine; Hiller, Hannes; Hager, Martin D.; Schubert, Ulrich S. (2015). "An aqueous, polymer-based redox-flow battery using non-corrosive, safe, and low-cost materials". Nature. 527 (7576): 78–81. Bibcode:2015Natur.527...78J. doi:10.1038/nature15746. PMID 26503039.
- ↑ Janoschka, Tobias; Martin, Norbert; Martin, Udo; Friebe, Christian; Morgenstern, Sabine; Hiller, Hannes; Hager, Martin D.; Schubert, Ulrich S. (2015). "An aqueous, polymer-based redox-flow battery using non-corrosive, safe, and low-cost materials". Nature. 527 (7576): 78–81. Bibcode:2015Natur.527...78J. doi:10.1038/nature15746. PMID 26503039.
- ↑ Bamgbopa, Musbaudeen O.; Almheiri, Saif; Sun, Hong (2017). "Prospects of recently developed membraneless cell designs for redox flow batteries". Renewable and Sustainable Energy Reviews. 70: 506–518. doi:10.1016/j.rser.2016.11.234. ISSN 1364-0321.
- ↑ Bamgbopa, Musbaudeen O.; Shao-Horn, Yang; Hashaikeh, Raed; Almheiri, Saif (2018). "Cyclable membraneless redox flow batteries based on immiscible liquid electrolytes: Demonstration with all-iron redox chemistry". Electrochimica Acta. 267: 41–50. doi:10.1016/j.electacta.2018.02.063. ISSN 0013-4686.
- ↑ Qi, Zhaoxiang; Koenig, Gary M. (2017). "Review Article: Flow battery systems with solid electroactive materials". Journal of Vacuum Science & Technology B, Nanotechnology and Microelectronics: Materials, Processing, Measurement, and Phenomena (به انگلیسی). 35 (4): 040801. Bibcode:2017JVSTB..35d0801Q. doi:10.1116/1.4983210. ISSN 2166-2746.
- ↑ {{ (2) Redox-Targeting-Based Flow Batteries for Large-Scale Energy Storage.
- ↑ Bush, Steve (20 July 2018). "Room-temperature flow battery uses liquid sodium-potassium alloy".
- ↑ Li, Zheng; Sam Pan, Menghsuan; Su, Liang; Tsai, Ping-Chun; Badel, Andres F.; Valle, Joseph M.; Eiler, Stephanie L.; Xiang, Kai; Brushett, Fikile R. (2017-10-11). "Air-Breathing Aqueous Sulfur Flow Battery for Ultralow-Cost Long-Duration Electrical Storage". Joule. 1 (2): 306–327. doi:10.1016/j.joule.2017.08.007.
- ↑ ۵۵٫۰ ۵۵٫۱ Tolmachev, Yuriy.
- ↑ Xu, Q.; Ji, Y.N.; Qin, L.Y.; Leung, P.K.; Qiao, F.; Li, Y.S.; Su, H.N. (2018). ""Evaluation of redox flow batteries goes beyond round-trip efficiency: A technical review"". Journal of Energy Storage. 16: 108–116. doi:10.1016/j.est.2018.01.005.
- ↑ Service, R.F. (2 November 2018). "Advances in flow batteries promise cheap backup power". Science. 362 (6414): 508–509. Bibcode:2018Sci...362..508S. doi:10.1126/science.362.6414.508. PMID 30385552.
خطای یادکرد: برچسپ <ref> که با نام «Science-Dictionary» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Fujii» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Bartolozzi» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «LindenReddy» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Shiokawa» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «PKLeung» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Borchers» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Nernst» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Keefer» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Kummer_and_Oei_1982» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «redflow» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Spaziente» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «deeya» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Kurzweil» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «greencar» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Braff» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «sandia» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Wald» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «MITTech» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «EVRS» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «EVRSfox» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «REDT» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Quick» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Andrews» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «Colli2016» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
خطای یادکرد: برچسپ <ref> که با نام «sse» درون <references> تعریف شده، در متن قبل از آن استفاده نشده است.
