گاهشمار بیماری زخم گوارشی و هلیکوباکتر پیلوری


گاهشمار زخم گوارشی و هلیکوباکتر پیلوری (انگلیسی: Timeline of peptic ulcer disease and Helicobacter pylori) گاهشمار وقایع مرتبط با کشف رابطهٔ میان هلیکوباکتر پیلوری و بروز زخمهای گوارشی و همچنین برخی انواع سرطان است. در سال ۲۰۰۵ بری مارشال و رابین وارن برندهٔ جایزه نوبل فیزیولوژی یا پزشکی شدند، چرا که طی پژوهشهایشان ثابت کردند که علت اصلی زخم گوارشی، باکتری هلیکوباکتر پیلوری است که میل طبیعی به محیطهای اسیدی همچون معده دارد. در نتیجهٔ زخمهای گوارشی را که بر اثر این باکتری ایجاد میشوند، با آنتیبیوتیک درمان میکنند تا این عفونت را در معده ریشهکن کنند. تا چند دهه پیش از این اکتشاف، عقیده بر آن بود که زخمهای گوارشی بر اثرِ ازدیاد اسید معده ایجاد میشود و به همین سبب، بیشتر درمانها متمرکز بر کنترل اسیدیته معده بود که موفقیت نسبی داشت. اینک مشخص شدهاست که کاهش اسید معده، با تغییر محیط آن، شرایط را برای عفونت هلیکوباکتر نامساعد میکند.
پیشینه
[ویرایش]پیش از دههٔ ۱۹۵۰ میلادی، تعاریف میکروبشناسی فراوانی از باکتریهای معده و ترشح اسید معده موجود بود که به هر دو نظریهٔ عفونی و پُراسیدی معده را در ایجاد زخمهای گوارشی اعتبار میبخشید. در یک پژوهش منفرد در ۱۹۵۴ میلادی، شواهدی از حضور باکتری در بیوپسی بافت معده که با روشهای سنتی رنگآمیزی میشدند، یافت نشد و همین موضوع، سبب جزماندیشی دربارهٔ نظریهٔ اسیدِ اضافی معده شد. طی تعدادی آزمون تجربی در دههٔ ۱۹۸۰ میلادی، این تفکر با اثبات انگاره کخ دربارهٔ نقش هلیکوباکتر پیلوری در ایجاد زخمهای گوارشی توسط بری مارشال و رابین وارن دگرگون شد. با این حال تلاش فراوانی لازم بود تا جامعهٔ پزشکی را متقاعد شود که این آزمونها و پژوهشها، اهمیت بالینی دارند. اینک تمامی جوامع علمی بزرگ متخصص در دستگاه گوارش در سرتاسر جهان متفقالقولند که هلیکوباکتر پیلوری علت اصلیِ غیرداروییِ بروز زخمهای گوارشی است و ریشهکنی این باکتری را گامی ضروری در درمان زخم معده و زخم دوازدهه میدانند و از آن طرفداری میکنند. علاوه بر این، هلیکوباکتر پیلوری با بروز لنفوم معده و آدنوکارسینوم معده در ارتباط است و سازمان جهانی بهداشت آن را جزء مواد سرطانزا طبقهبندی نمودهاست. با پیشرفت در علم زیستشناسی مولکولی در انتهای قرن بیستم، ژنوم این باکتری نیز تعیین توالی شد و بدین ترتیب درک بهتری از عوامل ویرولانس مؤثر در لانهگزینی و رشد باکتری و عفونت با آن در سطح مولکول دیانای حاصل شد.
پیش از قرن ۲۰ میلادی
[ویرایش]
- پیش از قرن ۱۶
- بقراط برای نخستین بار علائم مرتبط با معده را شرح داد.[۱]
- ابن سینا دریافت میان درد معده و زمان غذا خوردن رابطهای وجود دارد.[۱]
- ۱۵۸۶
- مارسلوس دوناتوس اهل منتووا با انجام کالبدشکافی، زخم گوارشی را توصیف نمود.[۲]
- ۱۶۸۸
- زخم دوازدهه مورد توجه یوهانس فون مورالت، کالبدشکاف و جراح سوئیسی، قرار گرفت.[۲]
- ۱۷۲۸
- اشتال فرضیهای مطرح کرد که رابطهای میان برخی انواع تب با التهاب معده و زخم آن وجود دارد.[۱]
- ۱۷۶۱
- مشخص شد که زخم گوارش، سبب ایجاد درد میشود.[۳]
- ۱۷۹۹
- متیو بیلی شرحی از زخمهای گوارشی منتشر کرد.[۲]

- ۱۸۱۲
- بروسه کشف کرد که اگر التهاب حاد معده درمان نشود، مزمن میشود.[۱]
- ۱۸۲۱
- نُوو بیان کرد که رابطهای میان التهاب معده با سرطان معده وجود دارد.[۱]
- ۱۸۲۲
- ویلیام بومانت برای نخستین بار اسیدی بودن محیط معده را اثبات کرد و رابطهٔ میان سطح اسید و خُـلق را بیان نمود.[۲]
- ۱۸۶۸
- آدولف کوسمال ترکیبات بیسموت (یک مادهٔ ضد باکتری) را جهت درمان زخم گوارشی پیشنهاد نمود. (از آن هنگام، بیسموت سابسالیسیلات در بسیاری از ترکیبات دارویی تجاری همچون «پپتو بیسمول» به عنوان درمان ضد باکتری هلیکوباکتر پیلوری بهکار رفتهاست). خواص ضد باکتری بیسموت تا سالها بعد مشخص نشد.[۱]
- ۱۸۷۵
- دانشمند آلمانی «گ. بوچر» و همکار فرانسویاش «ام. لوتول» فرضیهٔ ایجاد زخمهای گوارشی توسط باکتری را مطرح کردند.[۱]
- ۱۸۸۰
- یولیوس فریدریش کونهایم عنوان داشت که زخمها احتمالاً در اثر عوامل شیمیایی ایجاد میشوند.[۱]
- ۱۸۸۱
- ادوین کلبس متوجه حضور جاندارانی باکتریمانند در مجاری غدد گوارشی شد.[۴]
- ۱۸۸۹
- والری یاوُرسکی جاندارانی مارپیچی را در مایعات تهنشست معده انسان کشف کرد. او مدعی بود که این جانداران کوچک احتمالاً در بروز بیماریهای معده نقش دارند.[۱]
- ۱۸۹۲
- جولیو بیدزودزرو جاندارانی مارپیچی را در معدهٔ سگها کشف کرد.[۵][۶]

۱۹۰۰ تا ۱۹۵۰
[ویرایش]- ۱۹۰۵
- «اف. ریگل» عنوان کرد که زخمها در اثر افزایش اسید معده ایجاد میشود.[۱]

- ۱۹۰۶
- «والتر کرینیتس» باکتریهایی را در مبتلایان به سرطان معده کشف کرد.[۲]
- «فنتون بندیکت تِـرک» با خوراندن اِشریشیا کُلی به سگها در آنها زخم گوارشی ایجاد کرد.[۷]
- ۱۹۰۷
- «برکلی موینیهان» مدعی شد که اسید معده سبب بروز زخم گوارشی میگردد.[۱]
- ۱۹۱۰
- شوارتس فرضیهٔ «نقش اسید زیاد در ایجاد زخم» را منتشر کرد و عبارت مشهور «اسید نباشد، زخم نیست» را مطرح ساخت.[۲]
- «چ. جیبلی» اعلام کرد که قادر به ایجاد و تکرار مجدد آزمون تجربی «فنتون بندیکت تِـرک» نیست که با خوراندن باکتری به سگها، در آنها زخم گوارشی بهوجود آورده بود.[۱]
- ۱۹۱۳
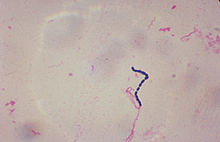
- «ئی.سی. رُزنو» مدعی گردید که استرپتوکوک موجب بروز زخم گوارشی میشود.[۸]
- ۱۹۱۵
- برای نخستین بار، داروهای آنتیاسید جهت درمان زخمها توصیه شد.[۳]
- باکتریها را با بروز زخم مرتبط دانستند، اما تصور بر آن بود که محل زندگی این باکتریها، دهان انسان است.[۹]
- ۱۹۱۹
- «کاتاسویا کاسائی» و «روکوزو کوبایاشی»، اسپیروکت را از گربه جدا کرده و توانستند با وارد کردن آن به بدن خرگوش، ایجاد زخم کنند.[۱۰]
- ۱۹۲۱
- دانشمند آلمانی «آ. لوگر»، اسپیروکت را در شیرهٔ معده کشف کرد و آن را با سرطان معده مرتبط دانست.[۴]
- ۱۹۲۴
- «جیمز موری لوک» و «تریلوک نات سث» اورهآز را در معدهٔ انسان کشف کردند و معتقد بودند که حضورش طبیعی و عادی است.[۱۱]
- ۱۹۲۵
- «آ. هوفمن» تکهای از معدهٔ دارای زخم را در انسان، به یک خوکچه هندی تزریق کرد و در آن زخم گوارشی ایجاد کرد. او موفق به جداسازی یک باکتری شد که معتقد بود عامل ایجاد زخم است.[۱۲]
- ۱۹۳۶
- در نخستین نسخهٔ «دانشنامهٔ بزرگ پزشکی» روسیه، عفونت به عنوان یکی از عوامل ایجاد زخم مطرح شد.[۱۳]
- ۱۹۳۹
- «اِی. استون فریبرگ» در بیمارستان «مانت ساینای بث اسرائیل» نیویورک، پژوهشی برای یافتن باکتری در معدهٔ انسان آغاز کرد. وی موفق به یافتن هلیکوباکتر پیلوری شد. شایع بود که پژوهشگران دیگر نتوانستند نتایج مشابهی بهدست آورند، اما هیچگونه نتایج علمی نفضکننده نیز منتشر نشد.[۱۴]
- جیمز دوئنگس اسپیروکت را در کالبدگشاییهای خود توصیف نمود.[۱۵]
- ۱۹۴۰
- «اِی. استون فریبرگ» و «لوئیس ئی. بارون» اسپیروکت را در کالبدگشاییهای خود مشاهده نمودند.[۱۶] فریبرگ پژوهش خود را نیمهتمام رها کرد، چرا که مدیرش به او توصیه کرد این موضوع را رها کند و به چیز دیگری بپردازد. مارشال معتقد بود که اگر فریبرگ به پژوهشهای خود ادامه داده بود، میتوانست در سال ۱۹۵۱ برندهٔ جایزه نوبل فیزیولوژی یا پزشکی شود.[۱۷]
- ۱۹۴۸
- فیتزجرالد و مورفی در فرضیه خود عنوان نمودند که زخمهای گوارشی در اثر خوردگی مخاط معده توسط اسید ایجاد میشود و اثربخشی اوره را به عنوان یک اقدام درمانی ثابت کردند.[۱۸]
۱۹۵۰ تا ۱۹۷۰
[ویرایش]- ۱۹۵۱
- «خ. آلنده» در کتابی، به شرح درمان زخمهای گوارشی با پنیسیلین پرداخت.[۲]
- ۱۹۵۳
- «رنه دینتزیس» و «برد هیستینگز» توانستند به استفاده از آنتیبیوتیک، جلوی تولید اورهآز در معدهٔ موشها را بگیرند و مدعی شدند که میان اورهاز و عفونت باکتریایی، رابطهای موجود است.[۱۹]
- ۱۹۵۴
- «اِدی دی. پالمر» مقالهای منتشر کرد و در آن بیان نمود که هیچگونه باکتری در معده انسان موجود نیست. وی معتقد بود که یافتههای پیشین به سبب آلوده شدن نمونههای بافتی بودهاست. متأسفانه او در پژوهش خود از رنگآمیزی نقره استفاده نکرده بود که بعدها بری مارشال و رابین وارن توسط آن، وجودِ هلیکوباکتر پیلوری را اثبات کردند.[۲۰]
- ۱۹۵۵
- تارنوپولسکایا به این نتیجه رسید که پنیسیلین، درمان قطعی زخم گوارشی است.[۱۳]
- موتیه و کورنه آنتیبیوتیکها را بهعنوان درمانی برای التهاب معده پیشنهاد نمودند.[۱۳]
- کورنبرگ و دیویس دریافتند که آنتیبیوتیکها میزان زخم گوارشی در گربهها را کاهش میدهند.[۲۱]
- ۱۹۵۷
- «شارل لیبه» و «آندره لوفِـوْر» کشف کردند که آنتیبیوتیکها سبب کاهش تبدیل اوره به آمونیاک در معده میشوند.[۲۲]
- ۱۹۵۸
- گوردون متوجه شد که پنیسیلین برخی انواع زخمهای گوارشی را بهطور کامل درمان میکند.[۱۳]
- یوان لیکودیس با موفقیت زخم گوارشی خودش را با آنتیبیوتیک درمان نمود.[۲۳]
- لیبه و لوفِـوْر نتایج مطالعات خود را در «کنگره جهانی بیماریهای دستگاه گوارش» در واشینگتن، دی.سی. ارائه کردند. مطالعه آنها با استقبال چندانی مواجه نشد، چرا که همگان با عنایت به پژوهش «اِدی دی. پالمر» در سال ۱۹۵۴، معتقد بودند که باکتری نمیتواند در محیط اسیدی معده زنده بماند.[۲۴]
- ۱۹۵۹
- لیبه و لوفِـوْر یک مطالعهٔ تکمیلی منتشر کردند که در آن اثبات نموده بودند آنتیبیوتیکها از تبدیل اوره به آمونیاک در معدهٔ انسان جلوگیری میکند.[۲۵]
- کانوی و همکاران در اعتراض به فرضیهٔ نقش باکتری در ایجاد زخمهای گوارشی، میزان اورهآزی را که توسط باکتری در معدهٔ موش تولید میشود، مورد پرسش و تردید قرار دادند.[۲۶]

- ۱۹۶۰
- «خوان د. بیال» و «اِکتور اورِگو»، موجوداتی شبیه به کامپیلوباکتر در معدهٔ گربهها و سگها ملاحظه نمودند.[۲۷]
- لیکودیس در یونان یک حق امتیاز انحصاری با شمارهٔ ۲۲٬۴۵۳ جهت درمان آنتیبیوتیکی زخمهای گوارشی دریافت داشت.[۲۳]
- ۱۹۶۲
- مروین زوسر و زینا استاین در مقالهای، یک اثر نسلی در زخمهای گوارشی در انگلستان یافتند. این یافته شاهدی بر نقشِ استرس در ایجاد زخم معده انگاشته شد.[۲۸]
- ۱۹۶۴
- لیکودیس درمان آنتیبیوتیکی خود را در یک گردهمایی انجمن متخصصان بیماریهای داخلی و جراحی در یونان مطرح کرد. بیشتر محافل و سازمانهای پزشکی از وی روی گرداندند.[۲۳]
- ۱۹۶۶
- مجلهٔ مشهور جاما دستننویس علمی لیکودیس را رد کرد.[۲۳]
- ۱۹۶۷
- «ایتو سوسومو» موجوداتی شبیه به کامپیلوباکتر یافت که به بافت پوششی معده متصل بود.[۲۹]
- ۱۹۶۸
- لیکودیس بابت درمان بیماران مبتلا به زخم گوارشی با آنتیبیوتیک، ۴٬۰۰۰ دراخمای یونان جریمه شد.[۲۳]
۱۹۷۰ تا قرن بیست و یکم
[ویرایش]- ۱۹۷۱
- «هاوارد اِستیر»، هلیکوباکتر پیلوری را در بافتبرداریهای انجام شده در یک بیمار مبتلا به زخم گوارشی مشاهده نمود.[۳۰]
- ۱۹۷۲
- نخستین گزارش از درمان موفقیتآمیز زخم گوارشی در چین با استفاده از فورازولیدون (نوعی داروی ضد باکتری)[۳۱]
- ۱۹۷۴
- موروزوف هلیکوباکتر پیلوری را مشاهده کرد، اما کشف خود را با بروز بیماری زخم گوارشی مرتبط ندانست.[۱۳]
- یک مقالهٔ معتبر پزشکی دربارهٔ زخم گوارشی منتشر شد که در آن اشارهای به باکتری نشده بود.[۳۰][۳۲]
- ۱۹۷۵
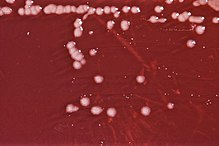
- اِستیر و کالین-جونز نتیجهٔ پژوهش خود را منتشر کردند که در آن به رابطهٔ میان هلیکوباکتر پیلوری و زخمهای گوارشی اشاره شده بود. آنها به این نتیجه رسیدند که این باکتری نوعی سودوموناس است و در اثر آلودگی نمونهٔ آزمایشگاهی پدید میآید و ربطی به زخم گوارشی ندارد.[۳۳]
- ۱۹۷۸
- در گردهمایی علمی «انجمن متخصصان گوارش آمریکا» در لاس وگاس، چندین مقاله ارائه شد که در آنها عنوان شده بود کنترل اسید معده توسط داروهای آنتاگونیست گیرنده اچ۲ هیستامین در درمان قطعی زخمهای گوارشی ناکارامد هستند.[۳۴]
- ۱۹۷۹
- «اریک جی. رمزی» در پژوهشی آشکار ساخت که تجویز بیسموت در ریشهکنی زخمهای گوارشی کمککننده است. بیسموت یک مادهٔ ضد باکتری است که البته رمزی این خاصیت آن را تشخیص نداد.[۳۵]
- جان رابین وارن برای نخستین بار هلیکوباکتر پیلوری را در بیوپسی بافت معده مشاهده نمود.[۳۶]
- فونگ، پاپادیمیتریو و ماتس هلیکوباکتر پیلوری را مورد توجه و مداقه علمی قرار دادند.[۳۷]
- ۱۹۸۱
- «یائو شی» باکتریها را در معده مشاهده نمود، اما معتقد بود که اینها گذار هستند و در معده لانهگزینی و تکثیر نمییابند.[۳۱]
- در ماه ژوئیه بری مارشال به بخش گوارش «بیمارستان سلطنتی پرت» (در شهر پرت) پیوست و در آنجا با رابین وارن آشنا شد.[۳۸]
- در ماه اکتبر وارن و مارشال با موفقیت، نخستین بیمار مبتلا به زخم گوارشی را درمان کردند.[۳۸]
- ۱۹۸۲
- «هیروشی ساتوه» و همکاران شواهدی دال بر علل عفونی زخمهای گوارشی در موشها پیدا کردند.[۳۹]
- وارن و مارشال نخستین پژوهش مشترک خود را جهت یافتن رابطهٔ میان هلیکوباکتر پیلوری و زخمهای گوارشی آغاز کردند.[۳۸]
- نخستین کشت موفق هلیکوباکتر پیلوری انجام شد که تقریباً بهطور تصادفی رخ داد.[۳۸]
- در ماه اکتبر مارشال با مشاهدهٔ تصاویر عکاسی ریزنگاری، کشف کرد که باکتری مورد مطالعهاش، کامپیلوباکتر نیست.[۳۸]
- در دوم اکتبر، مارشال نتایج یافتههای خود و وارن را در یک گردهمایی محلی مجمع پزشکان ارائه کرد. او با انتقادهایی مواجه شد که بعدها تصدیق نمود دستکم تا حدودی، بهجا و مستدل بودند.[۳۸]

- ۱۹۸۳
- در ماه ژانویه، وارن و مارشال طی دو نامهٔ مجزا، نتایج پژوهشهای خود را برای مجلهٔ معتبر لنست ارسال کردند.[۳۸]
- در فوریه، «انجمن متخصصان بیماریهای گوارش استرالیا» خلاصهٔ مقالهٔ مارشال را که جهت ارائه نتایج پژوهشهایش در کنفرانس سالیانه این انجمن ارسال شده بود، رد کرد و آن را در شمار ۱۰٪ پائینی مقالات ارسالی قلمداد نمود. همین مقاله برای ارائه در یک کارگاه کامپیلوباکتر در بروکسل پذیرفته شد.[۳۸]
- در ماه آوریل مارشال و یان هیسلوپ پژوهشی مشترک برای مقایسه اثر بیسموت و سایمتیدین شروع کردند. این پژوهش به سبب فقدان نتیجهٔ قاطع، نیمهتمام رها شد.[۳۸]
- در ماه ژوئن نامهٔ وارن و مارشال در لنست چاپ شد.[۴۰]
در سپتامبر هلیکوباکتر پیلوری در بیمارانی در خارج استرالیا هم مشاهده شد.[۳۸]
- پس از چاپ نامه وارن و مارشال در لنست، پژوهشگران در نقاط دیگر جهان نیز موفق به جداسازی هلیکوباکتر پیلوری شدند.[۳۸]
- ۱۹۸۴
- «انجمن متخصصان بیماریهای گوارش استرالیا» مقالهای را که شرحِ یافتههای وارن و مارشال بود، جهت ارائه پذیرفت.[۳۸]
- مارشال و گودوین تلاش کردند تا خوکها را با هلیکوباکتر پیلوری آلوده کنند و ثابت کنند که این باکتری قادر به زخم گوارشی است. این آزمون تجربی ناموفق بود.[۳۸]
- مقالهٔ وارن و مارشال در ماه مه توسط لنست پذیرفته و در ماه ژوئن منتشر شد. بسیاری از منتقدان و بازبینها از این مقاله خوششان نیامد.[۳۸]
- مکنالتی و واتسون موفق به بازتولید و تکرار نتایج بهدست آمده توسط وارن و مارشال شدند.[۴۱]
- در ۱۲ ژوئن مارشال تعمداً مقداری هلیکوباکتر پیلوری خورد و بیمار شد. سپس آنتیبیوتیک مصرف کرد و علائمش بهبود یافت.[۳۸]
- «شورای ملی پزشکی و سلامت» هزینهٔ کامل پژوهش مارشال برای هلیکوباکتر پیلوری را تأمین کرد.[۳۸]
- مقالهای در چین در مورد اثربخشی یک داروی آنتیبیوتیک در درمان زخمهای گوارشی منتشر شد.[۳۱]
- در ۳۱ ژوئیه نیویورک تایمز مقالهای از پزشک روزنامهنگار خود ل «ارنس کی. آلتمن» دربارهٔ رابطهٔ احتمالی میان زخمهای گوارشی و هلیکوباکتر پیلوری منتشر کرد.[۴۲] آلتمن در سال ۲۰۰۲ عنوان نود: از هنگام پیوستن به جمع خبرنگاران نیویورک تایمز در سال ۱۹۶۹ میلادی تا کنون، «هرگز برای مقالهای، جامعه پزشکی را چنین تدافعی و نکوهشگرانه ندیده بودم».[۴۳]
- توماس بورودی درمان سهدارویی مبتنی بر بیسموت را ابداع کرد که ترکیبی از بیسموت با دو آنتیبیوتیک بود. این درمان، نخستین درمانِ کاملاً موفق برای هلیکوباکتر پیلوری محسوب میشود که میزان ریشهکنیاش بیش از ۹۰٪ بود.[۴۴][۴۵][۴۶]
- ۱۹۸۵
- مارشال نتایج آلوده کردن خودش به هلیکوباکتر پیلوری را طی مقالهای منتشر کرد.[۳۸]
- بورودی درمان سهدارویی خود را ثبت اختراع کرد.[۴۷]
- ۱۹۸۷
- درام و همکاران بهدنبال پژوهشی بر روی کودکان، مقالهای در ژورنال پزشکی نیوانگلند چاپ کردند و در آن عنوان کردند که هلیکوباکتر پیلوری مخصوصاً با «زخم دوازده»، «التهاب اولیهٔ معده» یا «التهاب معده با دلیل نامشخص» در ارتباط است اما ربطی به التهاب ثانویه معده و زخمهای ناشی از بیماری کرون یا یک بیماری حیاتی نگرانکننده ندارد. از آنجایی که زخم دوازده و التهاب معده در کودکان نادر است، این مقاله صلاحیت و توانایی اثبات ادعاهای وارن و مارشال را داشت که میگفتند هلیکوباکتر پیلوری آنگونه که برخی گمان داشتند، یک عفونت فرصتطلب رشدکننده بر روی زخم و التهاب قبلی معده نیست، بلکه عامل اصلی ایجاد آن است. این نخستین باری بود که ژورنال پزشکی نیوانگلند که برترین مجلهٔ پزشکی جهان محسوب میشود، مقالهای دربارهٔ هلیکوباکتر پیلوری منتشر کرد.[۴۸]
- موریس نیز تعمداً هلیکوباکتر پیلوری خورد. او هم همچون مارشال، بیمار شد، اما برخلاف مارشال با مصرف آنتیبیوتیک بهطور کامل بهبود نیافت. وی سه سال درگیر عفونت با هلیکوباکتر بود.[۴۹]
- دابلین طی پژوهشی گسترده ثابت کرد که ریشهکن کردن هلیکوباکتر پیلوری بهطرز قابل توجهی، از عود زخمها جلوگیری میکند.[۵۰]
- ۱۹۹۰
- درمان سهدارویی بورودی با نام هلیداک در ایالات متحده آمریکا به صورت تجاری درآمد.[۵۱]
- پژوهشگران هلندی رائوس و تایتگات، درمان قطعی زخم دوازدهه را با استفاده از درمان ترکیبی سهدارویی بورودی شرح دادند.[۵۲] درمان سهدارویی که بهصورت ترکیبی از یک مهارکنندگان پمپ پروتونی و دو آنتیبیوتیک روزآمد و نوین شد، خیلی زود به درمانِ خطِ اول زخمهای گوارشی مبدل شد.
- کنگرهٔ جهانی بیماریهای گوارش توصیه نمود که جهت درمان زخمهای دوازده، باید هلیکوباکتر پیلوری را در معده ریشهکن کرد.[۵۳]
- نخستین گزارش از مقاومت دارویی هلیکوباکتر پیلوری به داروی مترونیدازول منتشر شد.[۵۴] این مقاومت دارویی سبب شد که آنتیبیوتیکها و مهارکنندگان پمپ پروتونی گوناگون و فراوانی برای ریشهکنی این باکتری ساخته شود.[۵۵]
- ۱۹۹۲
- «یوشیهیرو فوکودا» و همکارانش ثابت کردند که خوردن هلیکوباکتر پیلوری سبب بروز التهاب معده در میمون رزوس میگردد.[۴]
- «آنتونلو کوواچی» و همکاران توالی ژن CagA را مشخص کردند که سبب ساختهشدن نوعی پروتئین سطحی و دارای سمیت سلولی میگردد و همبستگی زیادی با برخی گونههای هلیکوباکتر پیلوریِ ایجادکنندهٔ زخم دوازدهه دارد. این نخستین توصیف علمی از عامل ویرولانس برای عفونت هلیکوباکتر با استفاده از روشهای زیستشناسی مولکولی بود.[۵۶]

- ۱۹۹۴
- فوجیوکا و همکارانش به نتایج علمی مشابهی با یوشیهیرو فوکودا و همکاران دست یافتند.[۴]
- مدت زمان حق انحصاری تولید داروهای کاهشدهنده اسید معده به اتمام رسید و در نتیجهٔ انگیزههای مالی و سودجویانه برای مخالفت با آنتیبیوتیکها در درمان زخم گوارش برطرف شد.[۳۸]
- در کنفرانسی که توسط مؤسسه ملی سلامت برگزار گردید، معلوم شد که یک اتفاق نظر و پذیرش همگانی در ایالات متحده آمریکا دربارهٔ هلیکوباکتر پیلوری به عنوان عامل ایجادکننده زخم گوارشی بهوجود آمدهاست.[۳۸]
- آژانس بینالمللی پژوهش سرطان سازمان جهانی بهداشت اعلام کرد که باکتری هلیکوباکتر پیلوری یک ماده سرطانزای گروه ۱ است.[۵۷]
- «جولی پارسونِـی» و همکاران رابطهٔ میان هلیکوباکتر پیلوری و لنفوم دستگاه گوارش را شرح دادند. این زخمهای بدخیم با ریشهکن کردن این باکتری درمان میشوند.[۵۸]
- ۱۹۹۷
- توم و همکاران، توالی کامل ژنوم هلیکوباکتر پیلوری را با ۱٬۶۶۷٬۸۶۷ جفتباز مشخص کردند. این موضوع سبب مشخص شدنِ یک عامل ویرولانس جدید برای عفونتزایی هلیکوباکتر پیلوری در سطح مولکولی شد.[۵۹][۶۰]
- ۲۰۰۱
- چان و همکاران در یک کارآزمایی تصادفی کنترلشده ثابت کردند که ریشهکنی هلیکوباکتر پیلوری در معده، حتی از بروز خونریزی در زخمهای ناشی از آسپرین و داروهای ضدالتهاب غیراستروئیدی جلوگیری میکند.[۶۱]
- ۲۰۰۲
- کارگروه هلیکوباکتر پیلوری اروپا، «گزارش اجماع ماستریخت ۲–۲۰۰۰» را منتشر و پیشنهاد نمود که یک راهبرد «آزمون و درمان» در بیماران جوانی که علائم غیرعادی ندارند، اجرا شود. این راهبرد، حامی استفاده از روشهای غیرتهاجمی برای تشخیص هلیکوباکتر پیلوری و درمان آن بود حتی اگر بیماری زخم گوارشی در آندوسکوپی یافت نمیشد.[۵۵]
- ۲۰۰۵
- وارن و مارشال بابت فعالیتهای علمیشان در زمینه هلیکوباکتر پیلوری و بیماری زخم گوارشی، برندهٔ جایزه نوبل فیزیولوژی یا پزشکی شدند.[۶۲]
منابع
[ویرایش]- ↑ ۱٫۰۰ ۱٫۰۱ ۱٫۰۲ ۱٫۰۳ ۱٫۰۴ ۱٫۰۵ ۱٫۰۶ ۱٫۰۷ ۱٫۰۸ ۱٫۰۹ ۱٫۱۰ ۱٫۱۱ Kidd, Mark; Irvin M. Modlin (1998). "A century of Helicobacter pylori". Digestion. 59 (1): 1–15. doi:10.1159/000007461. PMID 9468093. Archived from the original on 19 November 2020. Retrieved 26 March 2021.
- ↑ ۲٫۰ ۲٫۱ ۲٫۲ ۲٫۳ ۲٫۴ ۲٫۵ ۲٫۶ Unge, Peter (2002). "Helicobacter pylori treatment in the past and in the 21st century". In Barry Marshall (ed.). Helicobacter Pioneers: Firsthand Accounts from the Scientists Who Discovered Helicobacters. Victoria, Australia: Blackwell Science Asia. pp. 203–213. ISBN 978-0-86793-035-1.
- ↑ ۳٫۰ ۳٫۱ ۳٫۲ Buckley, Martin J.M; Colm A. O'Morain (1998). "Helicobacter biology – discovery". British Medical Bulletin. 54 (1): 7–16. doi:10.1093/oxfordjournals.bmb.a011681. PMID 9604426.
- ↑ ۴٫۰ ۴٫۱ ۴٫۲ ۴٫۳ Fukuda, Yoshihiro et al., "Kasai, Kobayashi and Koch's postulates in the history of Helicobacter pylori", in Helicobacter Pioneers, pp. 15–24.
- ↑ Bizzozero, Giulio (1893). "Ueber die schlauchförmigen Drüsen des Magendarmkanals und die Beziehungen ihres Epitheles zu dem Oberflächenepithel der Schleimhaut". Archiv für Mikroskopische Anatomie. 42: 82–152. doi:10.1007/BF02975307. S2CID 85338121. Archived from the original on 2 December 2020. Retrieved 26 March 2021.
- ↑ Figura, Natale & Laura Bianciardi, "Helicobacters were discovered in Italy in 1892: An episode in the scientific life of an eclectic pathologist, Giulio Bizzozero", in Helicobacter Pioneers, pp. 1–13.
- ↑ Turck, F.B. J.M (1906). "Ulcer of the stomach: Pathogenesis and pathology: Experiments in producing artificial gastric ulcer and genuine induced peptic ulcer". Journal of the American Medical Association. 46 (23): 872. doi:10.1001/jama.1906.62510500017003a. Archived from the original on 29 April 2021. Retrieved 26 March 2021.
- ↑ Rosenow, E.C. J.M (1913). "The production of ulcer of the stomach by injection of streptococci". Journal of the American Medical Association. 61 (22): 1947. doi:10.1001/jama.1913.04350230001001. Archived from the original on 29 April 2021. Retrieved 26 March 2021.
- ↑ Rosenow, E.C.; A.H. Sanford (1915). "The Bacteriology of Ulcer of the Stomach and Duodenum in Man". Journal of Infectious Diseases. 17: 219–226. doi:10.1093/infdis/17.1.219. Archived from the original on 29 April 2021. Retrieved 26 March 2021.
- ↑ Kasai, K.; R. Kobayashi (1919). "The stomach Spirochete Occurring in Mammals". Journal of Parasitology. 6 (1): 1–11. doi:10.2307/3271009. JSTOR 3271009.
- ↑ Luck; Seth (1924). "Gastric Urease". Biochemical Journal. 37 (6): 1227–1231. doi:10.1042/bj0181227. PMC 1259509. PMID 16743392.
- ↑ Hoffman, A (1925). "Experimental gastric duodenal inflammation and ulcer, produced with a specific organism fulfilling Koch's postulates". American Journal of the Medical Sciences. 170 (2): 212–219. doi:10.1097/00000441-192508010-00005.
- ↑ ۱۳٫۰ ۱۳٫۱ ۱۳٫۲ ۱۳٫۳ ۱۳٫۴ Mozorov, Igor A., "Helicobacter pylori was discovered in Russia in 1974", in Helicobacter Pioneers, pp. 105–118.
- ↑ Freedberg, A. Stone, "An Early Study of Human Stomach Bacteria", in Helicobacter Pioneers, pp. 25–28.
- ↑ Doenges, James (1939). "Spirochaetes in the gastric glands of the Macaus Rhesus and Human without definite history of related disease". Archives of Pathology. 27: 469–477.
- ↑ Freedberg, A.S.; L.E. Baron (1940). "The presence of spirochaetes in human gastric mucosa". American Journal of Digestive Diseases. 7 (10): 443–445. doi:10.1007/BF02997393.
- ↑ Altman, Lawrence K. (2005-12-06). "A Scientist, Gazing Toward Stockholm, Ponders 'What If?'". The New York Times. Archived from the original on 12 March 2020. Retrieved March 12, 2011.
- ↑ O'Connor, Humphrey J. and Colm A. O'Morain, "Gastric urease in ulcer patients in the 1940s: The Irish connection", in Helicobacter Pioneers, pp. 29–38.
- ↑ Dintzis RZ, Hastings AB (July 1953). "The Effect of Antibiotics on Urea Breakdown in Mice". Proc. Natl. Acad. Sci. U.S.A. 39 (7): 571–8. Bibcode:1953PNAS...39..571D. doi:10.1073/pnas.39.7.571. PMC 1063826. PMID 16589306.
- ↑ Palmer, E.D. (1954). "Investigation of the gastric mucosa spirochetes of the human". Gastroenterology. 27 (2): 218–220. doi:10.1016/S0016-5085(19)36173-6. PMID 13183283.
- ↑ Kornberg, H.L.; R.E. Davies (1955). "Gastric Urease". Physiological Reviews. 35 (1): 169–177. doi:10.1152/physrev.1955.35.1.169. PMID 14356931.
- ↑ Lieber, C.S.; A. Lefèvre (1957). "Effect of oxytetracycline on acidity, ammonia, and urea in gastric juice in normal and uremic subjects". Comptes Rendus des Séances et Mémoires de la Société de Biologie. 151 (5): 1038–1042. PMID 13500735.
- ↑ ۲۳٫۰ ۲۳٫۱ ۲۳٫۲ ۲۳٫۳ ۲۳٫۴ Rigas, Basil and Efstathios D. Papavassiliou, "John Lykoudis: The general practitioner in Greece who in 1958 discovered etiology of, and a treatment for, peptic ulcer disease", in Helicobacter Pioneers, pp. 75–84.
- ↑ Lieber, Charles S. J., "How it was discovered in Belgium and the USA (1955–1976) that Gastric Urease was Caused by a Bacterial Infectio", in Helicobacter Pioneers, pp. 39–52.
- ↑ Lieber CS, Lefèvre A (August 1959). "Ammonia as a Source of Gastric Hypoacidity in Patients with Uremia". J. Clin. Invest. 38 (8): 1271–7. doi:10.1172/JCI103902. PMC 442081. PMID 13673083.
- ↑ Conway, E.J.; O. Fitzgerald; K. McGeeney; F. Geoghegan (1959). "The location and origin of gastric urease". Gastroenterology. 37 (4): 449–56. doi:10.1016/S0016-5085(19)35390-9. PMID 13811656.
- ↑ Vital, J.D.; H. Orrego (1960). "Electron Microscope Observations on the Fine Structure of Parietal Cells". Journal of Biophysical and Biochemical Cytology. 7 (2): 367–72. doi:10.1083/jcb.7.2.367. PMC 2224815. PMID 13842039.
- ↑ Susser, M.; Z. Stein (1962). "Civilization and peptic ulcer". Lancet. 1 (7221): 115–9. doi:10.1016/s0140-6736(62)91127-3. PMID 13918500.. Reprinted as Susser M, Stein Z (2002). "Civilization and peptic ulcer. 1962". International Journal of Epidemiology. 31 (1): 13–7. doi:10.1093/ije/31.1.13. PMID 11914283. Archived from the original on 23 July 2008. Retrieved 26 March 2021.
- ↑ Ito, Susumu (1967). "Anatomic structure of the gastric mucosa". In Heidel, US; Code, CF (eds.). Handbook of Physiology Section 6 Volume 2. American Physiological Society. pp. 705–741.
- ↑ ۳۰٫۰ ۳۰٫۱ Steer, Howard W (2002). "The discovery of Helicobacter pylori in England in the 1970s". In Barry J. Marshall (ed.). Helicobacter pioneers: firsthand accounts from the scientists who discovered helicobacters, 1892–1982. Oxford: Blackwell. pp. 119–29. ISBN 978-0-86793-035-1.
- ↑ ۳۱٫۰ ۳۱٫۱ ۳۱٫۲ Xiao, Shu Dong (2002). "How we discovered in China in 1972 that antibiotics cure peptic ulcer". In Barry J. Marshall (ed.). Helicobacter pioneers: firsthand accounts from the scientists who discovered helicobacters, 1892–1982. Oxford: Blackwell. pp. 165–202. ISBN 978-0-86793-035-1.
- ↑ Patrick, W.J.A.; D. Denham; A.P.M. Forrest (1974). "Mucous change in the human duodenum: A light and electron microscopic study and correlation with disease and gastric acid secretion". Gut. 15 (10): 767–76. doi:10.1136/gut.15.10.767. PMC 1412991. PMID 4434919.
- ↑ Steer, H.W.; D.G. Colin-Jones (1975). "Mucosal changes in gastric ulceration and their response to carbenoxolone sodium". Gut. 16 (8): 590–7. doi:10.1136/gut.16.8.590. PMC 1411007. PMID 810394.
- ↑ Peterson, Walter L (2002). "The Dallas experience with acute Helicobacter pylori infection". In Barry J. Marshall (ed.). Helicobacter pioneers: firsthand accounts from the scientists who discovered helicobacters, 1892–1982. Oxford: Blackwell. pp. 143–50. ISBN 978-0-86793-035-1.
- ↑ Ramsey, E.J.; K.V. Carey; et al. (1979). "Epidemic gastritis with hypochlorhydria". Gastroenterology. 76 (6): 1449–57. doi:10.1016/0016-5085(79)90415-3. PMID 437444.
- ↑ Warren, J. Robin (2002). "The discovery of Helicobacter pylori in Perth, Western Australia". In Barry J. Marshall (ed.). Helicobacter pioneers: firsthand accounts from the scientists who discovered helicobacters, 1892–1982. Oxford: Blackwell. pp. 151–64. ISBN 978-0-86793-035-1.
- ↑ Fung, W.P.; J.M Papadimitriou; L.R. Matz (1979). "Endoscopic, histological and ultrastructural correlations in chronic gastritis". American Journal of Gastroenterology. 71 (3): 269–79. PMID 443229.
- ↑ ۳۸٫۰۰ ۳۸٫۰۱ ۳۸٫۰۲ ۳۸٫۰۳ ۳۸٫۰۴ ۳۸٫۰۵ ۳۸٫۰۶ ۳۸٫۰۷ ۳۸٫۰۸ ۳۸٫۰۹ ۳۸٫۱۰ ۳۸٫۱۱ ۳۸٫۱۲ ۳۸٫۱۳ ۳۸٫۱۴ ۳۸٫۱۵ ۳۸٫۱۶ ۳۸٫۱۷ ۳۸٫۱۸ Marshall, Barry (2002). "The discovery that Helicobacter pylori, a spiral bacterium, caused peptic ulcer disease". In Barry J. Marshall (ed.). Helicobacter pioneers: firsthand accounts from the scientists who discovered helicobacters, 1892–1982. Oxford: Blackwell. pp. 165–202. ISBN 978-0-86793-035-1.
- ↑ Satoh, H.; P.H. Guth; M.I. Grossman (1983). "Role of bacteria in gastric ulceration produced by indomethacin in the rat: cytoprotective action of antibiotics". Gastroenterology. 84 (3): 483–9. doi:10.1016/0016-5085(83)90071-9. PMID 6822322.
- ↑ Warren, J.R.; Barry Marshall (1983). "Unidentified curved bacilli on gastric epithelium in active chronic gastritis". Lancet. 1 (8336): 1273–5. doi:10.1016/S0140-6736(83)92719-8. PMID 6134060.
- ↑ McNulty, C.A.; D.M. Watson (1984). "Spiral bacteria of the gastric antrum". The Lancet. 1 (8385): 1068–9. doi:10.1016/S0140-6736(84)91469-7. PMID 6143990. S2CID 42600737.
- ↑ Altman, Lawrence K. (1984-07-31). "NEW BACTERIUM LINKED TO PAINFUL STOMACH ILLS". The New York Times. Archived from the original on 30 December 2018. Retrieved March 12, 2011.
- ↑ Humphrey, Nancy (2002-09-27). "Award-winning journalist informs doctors, world". The Reporter, Vanderbilt University Medical Center's Weekly Newspaper. Archived from the original on 30 December 2018. Retrieved March 12, 2011.
- ↑ Rimbara, Emiko; Fischbach, Lori A.; Graham, David Y. (2011). "Optimal therapy for Helicobacter pylori infections". Nature Reviews Gastroenterology & Hepatology. 8 (2): 79–88. doi:10.1038/nrgastro.2010.210. PMID 21293508. S2CID 23529476.
- ↑ Borody, TJ; Cole, P; Noonan, S; Morgan, A; Lenne, J; Hyland, L; Brandl, S; Borody, EG; George, LL (1989). "Recurrence of duodenal ulcer and Campylobacter pylori infection after eradication". The Medical Journal of Australia. 151 (8): 431–435. doi:10.5694/j.1326-5377.1989.tb101251.x. PMID 2687668. S2CID 26066525.
- ↑ Borody, T. J.; George, L. L.; Brandl, S.; Andrews, P.; Lenne, J.; Moore-Jones, D.; Devine, M.; Walton, M. (1992-01-01). "Helicobacter pylori Eradication with Doxycycline—Metronidazole—Bismuth Subcitrate Triple Therapy". Scandinavian Journal of Gastroenterology. 27 (4): 281–284. doi:10.3109/00365529209000075. ISSN 0036-5521. PMID 1589705.
- ↑ [۱], Borody, Thomas J., "Method for treatment of gastro intestinal disorders" Patent Number 5,196,205.
- ↑ Drumm B; et al. (1987). "Association of Campylobacter pylori on the gastric mucosa with antral gastritis in children". New England Journal of Medicine. 316 (25): 1557–1661. doi:10.1056/nejm198706183162501. PMID 3587289.
- ↑ Morris, A.; G. Nicholson (1987). "Ingestion of Campylobacter pyloridis causes gastritis and raised fasting gastric pH". American Journal of Gastroenterology. 82 (3): 192–9. PMID 3826027.
- ↑ Coghlan, J.G.; H. Humphrise; et al. (1987). "Campylobacter pylori and recurrence of duodenal ulcers—a 12-month follow-up study". The Lancet. 2 (8568): 109–11. doi:10.1016/S0140-6736(02)93231-9. PMID 2890019.
- ↑ "HELIDAC® Therapy". dailymed.nlm.nih.gov. Archived from the original on 30 December 2018. Retrieved 2017-02-14.
- ↑ Rauws E, Tytgat G (1990). "Cure of duodenal ulcer associated with eradication of Helicobacter pylori". Lancet. 335 (8700): 1233–5. doi:10.1016/0140-6736(90)91301-P. PMID 1971318. S2CID 41888935.
- ↑ Rauws, E.A.J.; G.N.J. Tytgat (1990). "Cure of duodenal ulcer associated with eradication of Helicobacter pylori". The Lancet. 335 (8700): 1233–5. doi:10.1016/0140-6736(90)91301-P. PMID 1971318. S2CID 41888935.
- ↑ Becx M; Janssen A; et al. (1990). "Metronidazole-resistant Helicobacter pylori". Lancet. 335 (8688): 539–40. doi:10.1016/0140-6736(90)90772-W. PMID 1968548. S2CID 34740886.
- ↑ ۵۵٫۰ ۵۵٫۱ Malfertheiner P; Mégraud F; O'Morain C; et al. (2002). "Current concepts in the management of Helicobacter pylori infection—the Maastricht 2-2000 Consensus Report". Aliment Pharmacol Ther. 16 (2): 167–80. doi:10.1046/j.1365-2036.2002.01169.x. PMID 11860399.
- ↑ Covacci A; Censini S; Bugnoli M; et al. (1993). "Molecular characterization of the 128-kDa immunodominant antigen of Helicobacter pylori associated with cytotoxicity and duodenal ulcer". Proc Natl Acad Sci USA. 90 (12): 5791–5. Bibcode:1993PNAS...90.5791C. doi:10.1073/pnas.90.12.5791. PMC 46808. PMID 8516329.
- ↑ <Please add first missing authors to populate metadata.> (1994). IARC Monograph on the Evaluation of Carcinogenic Risks to Humans. Lyon: World Health Organization. pp. 177–240.
- ↑ Parsonnet J; Hansen S; Rodriguez L; et al. (1994). "Helicobacter pylori infection and gastric lymphoma". New England Journal of Medicine. 330 (18): 1267–71. doi:10.1056/NEJM199405053301803. PMID 8145781.
- ↑ Tomb J; White O; Kerlavage A; et al. (1997). "The complete genome sequence of the gastric pathogen Helicobacter pylori". Nature. 388 (6642): 539–47. Bibcode:1997Natur.388..539T. doi:10.1038/41483. PMID 9252185.
- ↑ Aspholm-Hurtig M; Dailide G; Lahmann M; et al. (2004). "Functional adaptation of BabA, the H. pylori ABO blood group antigen binding adhesin". Science. 305 (5683): 519–22. Bibcode:2004Sci...305..519A. doi:10.1126/science.1098801. PMID 15273394. S2CID 26489149.
- ↑ Chan F; Chung S; Suen B; et al. (2001). "Preventing recurrent upper gastrointestinal bleeding in patients with Helicobacter pylori infection who are taking low-dose aspirin or naproxen". N Engl J Med. 344 (13): 967–73. doi:10.1056/NEJM200103293441304. PMID 11274623.
- ↑ "Nobel Prize in Medicine 2005". Nobel Foundation. Archived from the original on 26 December 2018. Retrieved October 3, 2006.
