چرخه سلول

چرخه سلولی یا چرخه تقسیم سلول، یکسری پشت سرهم از وقایعی است که درون سلول رخ داده و منجر به تقسیم آن به دو سلول دختری میشود. این وقایع شامل رشد سلول، دوبرابر شدن DNA (همانندسازی DNA) و برخی اندامکهای سلول و به دنبال آن بخشبندی سیتوپلاسم، کروموزومها و دیگر ترکیبات بین دو سلول دختری طی فرایند تقسیم سلولی میباشند.
در سلولهای یوکاریوتی (سلولهای حاوی هسته) مانند جانوران، گیاهان، قارچها و پروتوزوآها، چرخه سلولی به دو مرحلهٔ اصلی تقسیم میشود: اینترفاز و فاز M که شامل میتوز و سیتوکینز است. در طی اینترفاز، سلول رشد کرده، مواد موردنیاز میتوز را فراهم کرده و DNA و برخی اندامکهایش را دوبرابر میکند. درحالیکه، در طی فاز M، کروموزومهای مضاعف شده، اندامکها و سیتوپلاسم، بین دو سلول دختری تقسیم میشوند. جهت تضمین همانندسازی درست اجزای سلولی و تقسیم مناسب سلول، مکانیزمهای کنترلی تحت عنوان نقاط وارسی چرخه سلول پس از هر مرحله کلیدی آن حضور دارند که تعیین میکنند که آیا سلول برای پا گذاشتن به مرحله بعدی آماده است یا خیر.
در پروکاریوتها (سلولهای بدون هسته) که شامل باکتریها و آرکیها میشوند، چرخ سلولی به سه دوره B, C و D تقسیم میشود. دوره B از انتهای تقسیم سلولی تا ابتدای همانندسازی DNA را شامل میشود. همانندسازی DNA در دوره C رخ داده و دوره D نیز از انتهای همانندسازی DNA تا تقسیم سلول باکتریایی به دو سلول دختری گسترده شده است.[۱]
در ارگانیسمهای تک سلولی، یک چرخه تقسیم سلولی منجر به تولیدمثل موجود و بقای آن میشود. در پرسلولیها، چندین سری از چرخه سلولی رخ میدهد تا ارگانیسم پرسلولی از یک تک سلولی لقاح یافته به یک موجود بالغ تبدیل شود و همچنین فرایند چرخه سلولی مسئول بازسازی و ترمیم مو، پوست، سلولهای خونی و برخی اندامهای درونی میباشد (به جز اعصاب). پس از چرخه سلولی، هر کدام از سلولهای دختری وارد اینترفاز چرخه بعدی میشوند. اگرچه مراحل مختلف اینترفاز را معمولاً نمیتوان از لحاظ ریختشناسی تمیز داد، هر فاز از چرخه سلولی حاوی یک سری فرآیندهای بیوشیمیایی خاص است که سلول را برای شروع تقسیم سلولی آماده میکند.
فازها
[ویرایش]
چرخه سلولی یوکاریوتها شامل ۴ فاز میشود: فاز G1، فاز S یا سنتز، فاز G2 (این سه فاز همان اینترفاز را تشکیل میدهند) و فاز M (میتوز و سیتوکینز). فاز M خود شامل دو فرایند کاملاً جفت شده میباشد: میتوز، که در آن هسته سلول تقسیم میشود و سیتوکینز، که در آن سیتوپلاسم و غشاء سلولی برای تشکیل دو سلول دختری تقسیم میشوند. فعالسازی هر فاز وابسته به پیشرفت صحیح و تکمیل فاز قبلی است. سلولهایی که به صورت موقت یا برگشتپذیر تقسیم خود را متوقف کردهاند، گفته میشود که وارد فاز سکونی به نام G0 یا فاز استراحت شدهاند.
| حالت | فاز | مخفف | شرح |
|---|---|---|---|
| استراحت | Gap 0 | G0 | فازی که در آن سلول چرخه را رها کرده و تقسیم خود را متوقف کرده است. |
| اینترفاز | Gap 1 | G1 | رشد سلول. نقطه بازرسی G1 تضمین میکند که همه چیز برای سنتز DNA آماده باشد. |
| سنتز | S | همانندسازی DNA | |
| Gap 2 | G2 | رشد و آمادهسازی جهت میتوز. نقطه وارسی G2 تضمین میکند که همه چیز برای ورود به فاز M یا میتوز و تقسیم سلولی آماده باشد. | |
| تقسیم سلول | میتوز | M | رخداد تقسیم سلول. نقطه وارسی متافازی تضمین میکند سلول برای تقسیم کامل، آماده باشد. |
فاز G0 (سکون)
[ویرایش]
G0 فاز استراحت است که در آن سلول، چرخه را رها کرده و تقسیمش را متوقف میکند. چرخه سلولی با این فاز آغاز میشود. سلولهایی که تکثیر نمییابند (تقسیم نشونده) در یوکاریوتهای پرسلولی عمدتاً از فاز G1 وارد فاز سکون G0 شده و تا مدت زمان نسبتاً طولانی یا همیشگی (در رابطه با نورونها) در این فاز باقی میمانند. این فاز معمولاً مخصوص سلولهایی است که بهطور کامل متمایز شدهاند. برخی سلولها نیز به صورت نیمه دائمی وارد این فاز سکون میشوند که به نوعی پسامیتوزی هستند؛ مانند برخی سلولهای کبد، کلیه و معده. از سوی دیگر، بعضی سلولها نیز به هیچ وجه وارد فاز سکون یا G0 نمیشوند و در طول زندگی ارگانیسم، بهطور مداوم به تقسیم خود ادامه میدهند؛ مانند سلولهای اپیتلیالی.
واژه پسامیتوزی برخی مواقع به سلولهای در حال سکون و برخی مواقع به سلولهای پیر تلقی میشود. پیری سلولی در پاسخ به آسیب DNA و استرس خارجی رخ میدهد و معمولاً منجر به توقف فاز G1 میشود. این فرایند به نوعی جایگزین آپوپتوز سلولهای آسیب دیده، شمرده میشود.
اینترفاز
[ویرایش]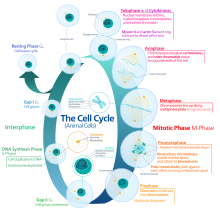
اینترفاز نشان دهنده فازی میان دو میتوز موفق است. اینترفاز شامل مجموعه ای از تغییرات و فرآیندهایی است که در سلولها و هستههای تازه تشکیل شده رخ داده تا آنها را برای تقسیم دوباره آماده کند. این فاز همچنین با عناوین فاز آمادهسازی یا فاز اینترمیتوز نیز شناخته میشود. بهطور کلی، اینترفاز حداقل حدود ۹۱ درصد زمان کل چرخه سلولی را شامل میشود.
اینترفاز در ۳ فاز اتفاق میافتد که شامل G1، S و G2 میشود و به دنبال آنها میتوز و سیتوکینز نیز رخ میدهد. مهمترین مرحله اینترفاز، مرحله S است که در آن DNA هسته ای سلول دوبرابر میشود.
فاز G1 (اولین فاز رشد یا گپ فاز پسامیتوزی)
[ویرایش]
اولین فاز در مرحله اینترفاز که از انتهای میتوز قبلی تا ابتدای سنتز DNA به طول میانجامد، فاز G1 نام دارد (حرف G از کلمه فاصله یا Gap میآید). این فاز همچنین فاز رشد یا Growth اولیه نیز نامیده میشود. در طول این فاز، فرآیندهای بیوسنتتیک سلولی که سرعتشان در فاز M کاهش یافته بود، با سرعت بالایی از سر گرفته میشوند. مدت زمان فاز G1 بهطور گستردهای حتی میان سلولهای مختلف یک گونه نیز متفاوت است.[۲] در این مرحله از اینترفاز، سلول، ذخایر پروتئینی و تعداد اندامکهایی نظیر میتوکندری و ریبوزوم را افزایش داده و همچنین اندازه اش رشد میکند. در فاز G1، سلول سه گزینه جهت ادامه دارد:
- ادامه چرخه سلولی و ورود به فاز S
- توقف چرخه سلولی و ورود به فاز G0 جهت شروع تمایز سلولی
- در فاز G1 متوقف شود، که یا میتواند وارد فاز سکون گردد یا دوباره به چرخه بازگردد
این نقطه تصمیمگیری را نقطه وارسی یا نقطه منع (Restriction Point) مینامند. این نقطه وارسی که به آن نقطه R یا آغاز (START) نیز گویند، توسط سایکلینهای G1/S که منجر به انتقال سلول از فاز G1 به S میشوند، تنظیم میگردد. عبور سلول از این نقطه وارسی، سلول را وادار به تقسیم میکند و از این جهت به این نقطه، نقطهٔ تعهد نیز میگویند.
فاز S (همانندسازی DNA)
[ویرایش]مرحله بعدی اینترفاز یا همان فاز S با شروع سنتز DNA آغاز میشود و زمانیکه کامل شد، همه کروموزومها همانندسازی شدهاند و این یعنی هر کروموزوم از دو کروماتید خواهری تشکیل شده است؛ بنابراین، در طول این فاز، مقدار DNA سلولی دوبرابر شده ولی پلوئیدی و تعداد کروموزومها تغییری نمیکند. در فاز S، سرعت و میزان رونویسی RNA و سنتز پروتئین بسیار پایین میآید. استثنایی برای این حالت، تولید هیستون هاست که در طول این فاز افزایشی چشمگیر دارد.[۳][۴][۵]
فاز G2 (رشد)
[ویرایش]فاز G2 پس از همانندسازی DNA رخ میدهد و دوره ای از سنتز پروتئین و رشد سریع سلول جهت آماده شدن برای شروع میتوز است. در طول این فاز میکروتوبولها شروع به تغییر سازماندهی میکنند تا دوکهای تقسیم را شکل دهند. پیش از شروع فاز میتوز، سلولها باید در نقطه وارسی انتهای G2 از لحاظ هرگونه آسیب DNA در کروموزومهایشان بررسی شوند. این نقطه وارسی بهطور اساسی توسط پروتئین p53 تنظیم میشود. اگر DNA سلول دچار آسیب شده باشد، p53 با توقف چرخه یا منجر به ترمیم DNA یا آپوپتوز سلول میشود. اگر پروتئین p53 جهش یافته و عملکردش را از دست دهد، سلولها ممکن است با DNA آسیب دیده خود چرخه سلولی را ادامه دهند و منجر به پیشرفت سرطان شوند.
فاز میتوز (جدایی کروموزومها)
[ویرایش]فاز M که نسبتاً کوتاه است، شامل تقسیم هسته (کاریوکینز) و تقسیم سیتوپلاسم (سیتوکینز) میباشد. این فاز کوتاهترین فاز چرخه سلولی است. فاز میتوزی، یک فاز پیچیده و بسیار تنظیم شده است. این فاز خود به زیرفازها یا مراحلی تقسیم میشود که در هرکدام یک سری از فرایندها و فعالیتهای سلولی به وقوع میپیوندند. این مراحل که کاملاً متوالی و بدون مکث هستند، عبارتند از:
میتوز فرآیندی است که در آن سلول یوکاریوتی کروموزومهای درون هسته اش را در دو مجموعه یکسان، در دو هسته تقسیم میکند. در طول فرایند میتوز، جفتهای کروموزومی فشرده شده و سپس به میکروتوبولها متصل میشوند تا دو کروماتید خواهری به دو قطب مخالف سلول کشیده شوند.
میتوز منحصراً در سلولهای یوکاریوتی است، اما به شکلهای مختلفی در گونههای گوناگون رخ میدهد. برای مثال، سلولهای جانوری میتوز «باز» را انجام میدهند که در آن پوشش هسته قبل از جدایی کروموزومها میشکند؛ درحالیکه در قارچها از قبیل Aspergillus nidulans و ساکارومایسیس سرویزیه (مخمر)، تقسیم «بسته» رخ میدهد که تقسیم کروموزومها درون هسته سلول دست نخورده، کامل میشود.[۶]
فاز سیتوکینز (جدایی همهٔ اجزای سلولی)
[ویرایش]سیتوکینز بلافاصله پس از میتوز رخ میدهد که در آن هستهها، سیتوپلاسم، اندامکها و غشاء سلولی بین دو سلولی که هر کدام میزان مساوی از این اجزاء را مشمول میشوند، تقسیم میگردد. سیتوکینز به روشهای مختلفی بین سلولهای گیاهی و جانوری دیده میشود. درحالیکه در سلولهای جانوری، غشاء سلولی در حین سیتوکینز تشکیل یک شکاف را داده که با عمیق شدن آن تقسیم دو سلول کامل میشود؛ در سلولهای گیاهی، یک صفحه سلولی در میانه سلول شکل میگیرد. محل این صفحه سلولی توسط سازماندهی یک گروه پیش پروفازی از میکروتوبولها و اکتینها مشخص میشود. میتوز و سیتوکینز با همدیگر تقسیم سلول والدی به دو سلول دختری که هرکدام از لحاظ ژنتیکی با هم و با سلول مادری یکسان هستند را پیش میبرند. این دو مرحله یا فاز تقریباً ۱۰درصد از چرخه سلولی را شامل میشوند.
از آنجایی که سیتوکینز معمولاً در پیوند تنگاتنگی با میتوز رخ میدهد، واژه "میتوز" اغلب به جای "فاز M" استفاده میشود. با اینحال، برخی سلولها متحمل میتوز و سیتوکینز جدایی میشوند و تک سلولهایی را طی فرایندی به نام Endoreplication میسازند که چندین هسته دارند. این فرایند بیشتر در قارچها و کپکهای مخاطی گزارش شده است اما در گروههای دیگر موجودات نیز یافت میشود. حتی در جانوران، سیتوکینز و میتوز ممکن است مستقل از هم رخ دهند؛ برای مثال در طول مراحل خاصی از تکوین جنینی مگس سرکه.[۷] خطاها در میتوز میتواند از طریق آپوپتوز منجر به مرگ سلولی شود یا باعث جهشهایی گردد که به سرطان ختم مییابند.
تنظیم چرخه سلولی یوکاریوتی
[ویرایش]تنظیم چرخه سلولی شامل فرآیندهای حیاتی برای بقای سلول، از قبیل تشخیص و ترمیم آسیبهای ژنتیکی و همینطور جلوگیری از تقسیم کنترل نشده سلول میشود. وقایع مولکولی که چرخه سلولی را کنترل میکنند، جهت دار و اختصاصی هستند و در نتیجه، هر فرایند متوالی است و غیرممکن است که چرخه معکوس شود.
نقش سایکلینها و CDKها
[ویرایش]

دو کلاس کلیدی از مولکولهای تنظیمی چرخه سلولی، یعنی سایکلینها و کینازهای وابسته به سایکلین (CDKها)، پیشرفت سلول در چرخه را تعیین میکنند.[۸] لیلند هارتول، آر. تیموتی هانت و پاول ام. نرس توانستند در سال ۲۰۰۱ جایزه نوبل فیزیولوژی یا پزشکی را به دلیل کشف این مولکولهای مرکزی دریافت کنند.[۹] بسیاری از ژنهای کدکننده سایکلینها و CDKها بین تمامی یوکاریوتها محافظت شدهاند؛ اما بهطور کلی، ارگانیسمهای پیچیدهتر، سیستمهای پیچیده و بیشتری را دارا میباشند. بسیاری از ژنهای مربوطه، اولین بار در طی مطالعات روی مخمرها، مخصوصاً ساکارومایسیس سرویزیه، کشف شدند.[۱۰] نامگذاری ژنتیکی برای بسیاری از این ژنها در مخمر با نام cdc (چرخه تقسیم سلولی یا cell division cycle) به همراه یک شماره شناسایی انجام گرفت، از قبیل cdc25 یا cdc20.
در یک هترودایمر فعال، سایکلینها زیرواحد تنظیمی و CDKها زیرواحد کاتالیتیک را شکل میدهند به طوریکه سایکلینها هیچ نقش کاتالیتیک نداشته و CDKها نیز در غیاب سایکلین مربوطه خود، غیرفعال هستند. با فعال شدن طی اتصال به سایکلین، CDKها یک واکنش بیوشیمیایی معمول را به نام فسفریلاسیون انجام میدهند که منجر به فعال شدن یا مهار پروتئینهای هدف میشود که این عمل، ورود سلول به فاز بعدی چرخه را هماهنگ میکند. ترکیبات سایکلین-CDK مختلف، پروتئینهای هدف پایین دست را مشخص میکند. CDKها بهطور دائمی در سلول بیان میشوند درحالیکه سایکلینها تنها در فازها و مراحل خاصی از چرخه و توسط سیگنالهای مولکولی مختلفی سنتز میشوند.
مکانیسم عمومی برهمکنش سایکلین-CDK
[ویرایش]با دریافت سیگنال خارج سلولی میتوژن، کمپلکسهای سایکلین-CDK فاز G1 فعال شده و با القای بیان یک سری از فاکتورهای رونویسی که خود، بیان سایکلینهای فاز S و آنزیمهای دخیل در همانندسازی DNA را القا میکنند، سلول را برای شروع فاز S آماده میگردانند. کمپلکسهای سایکلین-CDK فاز G1 همچنین با هدف گذاری یوبیکوئیتیناسیون پروتئینهای مهارکننده فاز S، تخریب آنها را پیش میبرند. وقتی یک پروتئین یوبی کوئیتینه میشود، در واقع جهت تخریب پروتئولیتیک توسط پروتئازوم نشاندار شده است. با اینحال، نتایج یک مطالعه جدید روی دینامیک مولکولی و رونوشت برداری پروتئین E2F مشخص کرده است که فعالیت سایکلین-CDK و به خصوص کمپلکس سایکلین D و CDK4/6 در اصل تنظیم زمانبندی ورود به چرخه سلولی است نه تعهد به آن.[۱۱]
کمپلکسهای فعال سایکلین-CDK فاز S، پروتئینهایی که در طول فاز G1، کمپلکس پیش آغازگر همانندسازی را روی منشأ همانندسازی DNA تشکیل دادهاند، فسفریله میکند. این فسفریلاسیون دو هدف دارد: اول اینکه کمپلکسهایی که از قبل تجمع یافتهاند را فعال کند؛ و دوم اینکه از تجمع بیشتر این کمپلکسها خودداری شود و به نوعی تضمین کند که همانندسازی تنها یکبار در طول یک چرخه سلولی انجام میشود. در فرایند همانندسازی DNA نباید هیچ شکافی رخ داده و حتی قسمتی از ژنوم از دوبرابر شدن جا بماند زیرا سلولهای دختری که قسمتی یا کل ژنهای ضروریشان را از دست دهند، به سرعت میمیرند.
کمپلکسهای سایکلین-CDK میتوزی که در فازهای S و G2 سنتز شده ولی غیرفعال میمانند، شروع میتوز را با تحریک پروتئینهای پاییندست که در فشردگی کروموزومها و تشکیل دوکهای میتوزی نقش دارند، القا میکنند. یکی از کمپلکسهای حیاتی که در طول میتوز فعال میشود، یوبیکوئیتین لیگازی به نام کمپلکس القاکننده آنافاز یا APC است که تخریب پروتئینهای ساختاری مرتبط با کینهتوکور کروموزومی را کلید میزند. کمپلکس APC همچنین سایکلینهای میتوزی را جهت تخریب نشاندار میکند که موجب میشود مراحل تلوفاز و سیتوکینز رخ دهند.[۱۲]
فعالیت اختصاصی کمپلکسهای سایکلین-CDK
[ویرایش]سایکلین D اولین سایکلین تولید شده در پاسخ به سیگنالهای خارج سلولی (مانند فاکتورهای رشد) توسط سلولی است که وارد چرخه شده است. غلظت این سایکلین در سلولهای در حال استراحت که تقسیم نمیشوند، پایین نگه داشته میشود. همچنین در فاز سکون، CDKهای ۴ و ۶ نیز به دلیل اتصال به اعضای خانواده INK4 مانند p16 که فعالیت کینازی CDKها را مهار میکنند، غیرفعال هستند.[۱۳] زمانیکه محرکهای میتوژنی به سلول میرسند، منجر به افزایش بیان سایکلین D میشوند. در پاسخ به این افزایش بیان، سایکلینهای D به CDK4/6 موجود متصل شده و کمپلکس فعال Cyclin D-Cdk4/6 را تشکیل میدهند. این کمپلکس با مونوفسفریلاسیون، پروتئین رتینوبلاستوما یا Rb را به pRb تبدیل میکند. پروتئین سرکوبگر تومور Rb در حالت غیرفسفریله موجب خروج سلول از چرخه سلولی و ورود به فاز سکون یا G0 میشود.[۱۴]
در چند دهه اخیر، مدلی توسط دانشمندان پذیرفته بود که در آن اعلام میشد که پروتئین Rb که بیش از ۱۴ جایگاه فسفریلاسیون دارد، تنها توسط کمپلکس Cyclin D-Cdk4/6 هایپرفسفریله شده و بهطور کامل غیرفعال میشود و درنتیجه آن، فاکتور نسخه برداری E2F از Rb جدا شده و موجب بیان ژنهای دخیل در انتقال G1 به S میگردد.
با اینحال، مشاهدات علمی مطالعات اخیر نشان دادند که Rb در ۳ حالت یا ایزوفرم وجود دارد: (۱) پروتئین Rb غیرفسفریله در فاز، G0 (2) پروتئین Rb تکفسفریله یا هیپوفسفریله در اوایل فاز G1؛ و (۳) پروتئین Rb غیرفعال هایپرفسفریله در اواخر فاز G1.[۱۵][۱۶][۱۷] در اوایل G1، پروتئینهای Rb تکفسفریله در ۱۴ ایزوفرم مختلف حضور داشته که هرکدام میل متمایزی به E2F دارند.[۱۷] مشخص شده است که پروتئین Rb با صدها پروتئین متفاوت ارتباط دارد و این ایده که Rbهای تکفسفریله مختلف، پروتئینهای همراه متفاوتی دارند، بسیار جالب نظر است.[۱۸] به تازگی یک گزارش تأیید نمود که مونوفسفریلاسیون، ارتباط Rb با پروتئینهای مختلف را کنترل کرده و منجر به بروز فعالیتهای مختلف این پروتئین میشود.[۱۹] جالب توجه این است که تمامی ایزوفرمهای تکفسفریله Rb، برنامه رونویسی و بیانی E2F را مهار کرده و سلول را در فاز G1 متوقف میکنند. نکته مهم اینجاست که فرمهای تکفسفریله مختلف Rb نتایج بیانی مختلفی بر E2F دارند.[۱۹]
بهطور کلی، اتصال pRb به E2F بیان ژنهای هدف این فاکتور رونویسی که در انتقال G1/S دخیل هستند (مانند سایکلین نوع E) را مهار میکند. فسفریلاسیون جزئی پروتئین Rb (توسط CDK4/6 متصل به سایکلین D) فعالیت مهاری آن را بر E2F کاهش داده و منجر به شروع بیان سایکلین E میشود و به نوعی هر کمپلکس سایکلین-CDK، باعث افزایش بیان کمپلکس بعدی میشود. مکانیسم مولکولی دقیقی که موجب میشود سلول شروع به بیان سایکلین E کند همچنان ناشناخته است؛ اما با افزایش غلظت این سایکلین، کمپلکس فعال Cyclin E-CDK2 تشکیل شده و به واسطه هایپرفسفریلاسیون، Rb را بهطور کامل غیرفعال میکند.[۱۷] پروتئین Rb هایپرفسفریله بهطور کامل از E2F جدا شده و بیان ژنهای هدف این فاکتور رونویسی که در پیشبرد سلول به فاز S موردنیاز هستند، بالا میرود. مشخص شده است که Cyclin D-CDK4/6 به یک مارپیچ آلفای خاص در انتهای C-ترمینال پروتئین Rb که مخصوص اتصال سایکلین D (و نه سایکلینهای دیگر نظیر E, A و B) است، متصل میشود.[۲۰] این مشاهدات بیان میدارند که پروتئین Rb توسط کمپلکسهای مختلف سایکلین-CDK در سطوح مختلفی فسفریله میشود. علاوه بر آن، آنالیزهای جهشی روی مارپیچ اختصاصی جایگاه اتصال سایکلین D نشان میدهد که اختلال در اتصال سایکلین D به Rb، منجر به عدم هیپوفسفریلاسیون Rb، توقف سلول در G1 و فعالیت سرکوبگر توموری Rb میگردد. رشد سرطانی تودههای سلولی، اغلب با اختلال در تنظیم فعالیت Cyclin D-CDK4/6 همراه است.[۲۰]
پروتئین Rb هایپرفسفریله، از کمپلکس E2F/DP1/Rb جدا شده (این کمپلکس با قرارگیری در بالادست ژنهای هدف E2F، از بیان و رونویسی آنها جلوگیری میکند) و درنتیجه E2F فعال میشود. درنتیجه فعال شدن E2F، ژنهای مختلفی از قبیل سایکلین E، سایکلین A، آنزیم DNA پلیمراز، آنزیم تیمیدین کیناز و… رونویسی میشوند. همانطور که گفته شد، سایکلین E با CDKهای مربوطه (CDK2) کمپلکس شده و سلول را از فاز G1 به S منتقل میکند. تشکیل و فعال شدن کمپلکس Cyclin B-CDK1 منجر به تخریب پوشش هسته و شروع پروفاز شده و متعاقباً غیرفعال شدن این کمپلکس، خروج سلول از میتوز را کلید میزند.
مهارکنندهها
[ویرایش]داخل سلولی
[ویرایش]دو خانواده ژنی، یعنی خانواده cip/kip به انگلیسی Cdk Interacting Protein/Kinase Inhibitory Protein یا پروتئین مرتبط با CDK/پروتئین مهاری کیناز و خانواده INK4a/ARF به انگلیسی Inhibitor of Kinase 4/Alternative Reading Frame یا مهارکننده کیناز۴/چارچوب خوانش الترنیتیو، جلوی پیشبرد چرخه سلولی را میگیرند. به دلیل اینکه این ژنها در پیشگیری از رشد تومور مؤثر هستند، به آنها سرکوبگران تومور گفته میشود.
خانواده ژنی cip/kip شامل سه ژن p21، p27 و p57 میشود. آنها با اتصال و غیرفعال سازی کمپلکسهای سایکلین-CDK، چرخه سلولی را در فاز G1 متوقف میکنند. فعالیت پروتئین p21 توسط p53 که خود طی آسیب DNA مانند پراش پرتو فعال میشود، القا میگردد و پروتئین p27 نیز توسط فاکتور دگرگونکننده رشد بتا یا TGFβ که یک مهارکننده رشد است، فعال میشود.
خانواده ژنی INK4a/ARF شامل p16INK4a که به CDK4 متصل شده و چرخه سلولی را در فاز G1 متوقف میکند، و همچنین p14ARF که از تخریب p53 جلوگیری میکند، میباشد.

سنتتیک
[ویرایش]مهارکنندههای سنتتیک Cdc25 میتوانند برای توقف چرخه سلولی و بنابراین به عنوان عوامل ضدنئوپلاسمی و ضدسرطانی مفید باشند.[۲۱]
بسیاری از سرطانهای انسان با فعالیت بیش از حد Cdk4/6 همراه هستند.[۲۲] با توجه به عملکرد کمپلکس Cyclin D-Cdk4/6، مهار این کمپلکس میتواند باعث جلوگیری از تکثیر تومورهای بدخیم شود. متعاقباً، دانشمندان با هدف قراردادن Cdk4/6، تلاش میکنند تا مهارکنندههای سنتتیک این کینازها را تولید و روانه بازار کنند. در حال حاضر، سه مهارکننده Cdk4/6 - یعنی پالبوسیکلیب، ریبوسیکلیب و آبماسیکلیب – که تاییدیه FDA را دریافت نمودهاند، برای درمان مرحله پیشرفته یا متاستازی، گیرندهٔ هورمون مثبت (HR+) و گیرندهٔ HER2 منفی (HER-) سرطان پستان مورد استفاده قرار میگیرند.[۲۳][۲۴] برای مثال، پالبوسیکلیب یک مهارکننده خوراکی Cdk4/6 است که تاکنون نتایج مطلوبی روی سرطان پستان پیشرفته ER-مثبت/HER2-منفی داشته است. اصلیترین عارضه این داروهای سنتتیک، نوتروپنی یا کاهش نوتروفیلهای خون است که میتوان آن را با کاهش دوز مصرفی کنترل کرد.
نکته قابل ذکر این است که درمان هدفمند Cdk4/6 تنها در درمان انواعی از سرطانها که در آنها پروتئین Rb بیان میشود، میتواند مفید باشد. سلولهای سرطانی که ژن Rb در آنها از دست رفته است، نسبت به مهارکنندههای Cdk4/6 مقاوم هستند.
نقاط وارسی
[ویرایش]نقاط وارسی چرخه سلولی، توسط سلول برای بررسی و کنترل پیشرفت چرخه سلولی مورد استفاده قرار میگیرند.[۲۵] این نقاط خاص، با جلوگیری از پیشرفت چرخه، این اجازه را میدهند که فازهای ضروری سلول به درستی بررسی شده و اگر آسیب DNA رخ داده است، ترمیم شود. تا زمانیکه ضروریات هر نقطه وارسی برای سلول محیا نباشد، اجازه عبور و ورود به فاز بعدی داده نمیشود. نقاط وارسی معمولاً شامل پروتئینهای تنظیمی هستند که بر پیشبرد مراحل مختلف چرخه سلولی نظارت میکنند.
تخمین زده شده است که در سلول نرمال انسان، حدود ۱ درصد از آسیبهای تک رشتهای DNA، به حدود ۵۰ شکست دو رشتهای درون سلولی به ازای هر چرخه سلول تبدیل میشود.[۲۶] با وجود اینکه این شکستهای دو رشتهای (DSBs) معمولاً با دقت بالایی ترمیم میشوند، خطا در این سیستم تعمیر و ترمیم بهطور قابل توجهی با نرخ سرطان در انسانها مرتبط است.[۲۶]
چندین نقطه وارسی در چرخه سلولی، تضمین میکنند که DNA آسیب دیده یا کامل نشده به سلولهای دختری انتقال پیدا نکند. سه نقطه وارسی اصلی عبارتند از: نقطه وارسی G1/S، نقطه وارسی G2/M و نقطه وارسی متافازی (میتوزی). نقطه وارسی دیگر همان نقطه وارسی G0 است که بلوغ سلولها را میسنجد. اگر سلولی نتواند از هر کدام از این نقاط عبور کند، توانایی تقسیم را نخواهد داشت و چرخه برای آن سلول متوقف میشود.
نقطه گذر G1/S، یک مرحله محدودکننده سرعت چرخه است که همچنین با نام نقطه تعهد یا منع نیز شناخته میشود. این نقطه وارسی، همان جایی است که سلول از لحاظ وجود مواد موردنیاز برای همانندسازی DNA (مانند بازهای نوکلئوتیدی، آنزیم DNA سنتاز، کروماتین و…) بررسی میگردد. سلول ناسالم یا فاقد مواد موردنیاز، در این نقطه متوقف میشود.
نقطه گذر G2/M، همان جایی است که سلول مطمئن میشود که میزان مناسبی از سیتوپلاسم و فسفولیپیدها را برای دو سلول دختری داراست. اما این نقطه، زمان مناسب برای تقسیم هسته و سیتوپلاسم را نیز کنترل میکند، زیرا برخی مواقع نیاز است که رده ای از سلولها همگی بهطور همزمان تقسیم شوند (برای مثال، جنین در حال رشد باید تا قبل از گذر میانبلاستولا، توزیع متقارنی از سلولها را دارا باشد). این عمل توسط نقطه وارسی G2/M کنترل میشود.
نقطه وارسی متافازی نسبتاً یک نقطه بازرسی فرعی است، به این دلیل که سلولی که وارد متافاز شده است، متعهد است که تقسیم سلولی را کامل کند. با اینحال این موضوع به این معنا نیست که این نقطه اهمیتی ندارد؛ در این نقطه بازرسی، سلول برای تضمین از تشکیل دوکهای تقسیم و اتصال همگی کروموزومها به دوکها و قرارگیریشان در صفحه استوایی سلول قبل از شروع آنافاز، بررسی میشود.[۲۷]
با وجود اینکه نقاط وارسی اصلی این سه هستند، الزامی وجود ندارد که همه انواع سلولها برای تقسیم و تکثیر به ترتیب از این نقاط عبور کنند. برخی سلولهای سرطانی به دلیل جهشهایی که در ژنهای مختلف خود دارند، به سرعت از این نقاط گذشته یا حتی آنها را بدون کنترل شدن، رد میکنند و به نوعی گذر از فاز S به M و دوباره به S را بهطور متوالی انجام میدهند. چون این سلولهای سرطانی نقاط وارسی خود را از دست دادهاند، هر گونه رخداد جهش DNA بدون اینکه بررسی یا ترمیم شود به سلولهای دختری انتقال مییابد و این دلیلی است بر این حقیقت که چرا سلولهای سرطانی با افزایش چشمگیری جهشهای مختلف را در خود جمع میکنند. جدا از سلولهای سرطانی، بسیاری از سلولهای کاملاً تمایزیافته، دیگر متحمل تکثیر و تقسیم نمیشوند و چرخه سلولی را ترک کرده، وارد فاز G0 شده و باقی عمر خود را آنجا میمانند؛ به نوعی دیگر نیازی به نقاط وارسی چرخه ندارند. مدلی جایگزین برای پاسخ چرخه سلولی به آسیب DNA نیز پیشنهاد شده است که تحت عنوان نقطه وارسی پساهمانندسازی شناخته میشود.
تنظیم نقطه وارسی نقش بسیار مهمی را در تکوین ارگانیسم ایفا میکند. برای مثال در تولیدمثل جنسی در زمان لقاح تخمک، وقتی که اسپرم به تخمک متصل میشود، فاکتورهای پیامرسانی را آزاد میکند که تخمک را از وقوع لقاح آگاه میسازد. این سیگنال موجب میشود که اووسیت لقاح یافته از حالت سکون و فاز G0 خود خارج شده و دوباره تقسیم و همانندسازی را از سر بگیرد.
پروتئین p53 نقش بسیار مهمی را در راه انداختن مکانیسمهای کنترلی هر دو نقطه وارسی G1/S و G2/M دارد. علاوه بر p53، تنظیم کنندههای دیگر نقاط وارسی بهطور ویژه ای در حال تحقیق و مطالعه هستند تا نقششان در رشد و تکثیر سرطان مشخص گردد.
تصویربرداری فلوئورسنس از چرخه سلولی
[ویرایش]
فعالیتها و تلاشهای آتسوشی میاواکی و همکارانش منجر به توسعه روش یوبیکوئیتیناسیون فلوئورسنتی پروتئینهای شاخص چرخه سلولی یا FUCCI شد که به آنها اجازه میداد تا تصویربرداری فلوئورسنس از چرخه سلولی را انجام دهند. در اصل طی این روش، یک پروتئین فلوئورسنت سبز به نام mAG به پروتئین hGem (پروتئین Geminin انسانی) متصل شده و پروتئین فلوئورسنت نارنجی رنگی نیز (mKO2) با پروتئین Cdt1 انسانی ادغام گشت. نکته قابل ذکر این است که این پروتئینهای فلوئورسنت، حاوی سیگنال جایگیری هسته ای (NLS) و همچنین جایگاههای یوبیکوئیتیناسیون بوده ولی عملکرد خاصی ندارند. پروتئین فلوئورسنت سبز یا همان Geminin، در طول فازهای S, G2 و M تولید شده و در طی فازهای G0 و G1 تخریب میشود، درحالیکه پروتئین فلوئورسنت نارنجی یعنی Cdt1، در طول فازهای G0 و G1 سنتز شده و در بقیه فازها تخریب میگردد.[۲۸] بعدها، سیستمهای FUCCI مبتنی بر امواج فراسرخ و نزدیک به فروسرخ (NIR) با استفاده از پروتئین فلوئورسنت مشتق از سیانوباکتری (smURFP) و پروتئین فلوئورسنت مشتق از باکتریوفیتوکروم توسعه یافتند.[۲۹] چندین تغییر و تحول در سیستم FUCCI اولیه ایجاد گشت تا برای مطالعه سیستمهای درون آزمایشگاهی یا in vitro بهینه تر شود. این تغییرات و پیشرفتها موجب افزایش حساسیت و دقت این سیستم در تشخیص فازهای چرخه سلولی شده و ارزیابیهای دقیقی در رابطه با تکثیر سلولها را ممکن ساخت.[۳۰]
نقش در تشکیل تومور
[ویرایش]بی نظمی در اجزای چرخه سلولی ممکن است منجر به تشکیل تومور گردد.[۳۱] همانطور که اشاره شد، زمانیکه ژنهایی نظیر مهارکنندههای چرخه سلولی برای مثال Rb, P53 و… جهش دار میشوند، میتوانند موجب تقسیم بدون کنترل سلولها و شکلگیری تومور شوند. اگرچه مدت زمان چرخه سلولی برای سلولهای توموری برابر یا بیشتر از سلولهای نرمال است، اما نسبت سلولهای در حال تقسیم (در مقایسه با سلولهای متوقف شده در فاز G0) در سلولهای توموری بسیار بیشتر از بافتهای نرمال است.[۳۲] بنابراین در تشکیل تومور، افزایش خالص سلول رخ میدهد زیرا نسبت سلولهایی که دچار آپوپتور یا سکون میشوند، تغییر نمیکند.
در سرطانها، معمولاً سلولهای در حال تقسیم مورد هدف درمان قرار میگیرند؛ زیرا این سلولها به دلیل تقسیم و همانندسازی DNA، ماده ژنتیکی شان در معرض است و با شیمی درمانی (با استفاده از داروها) یا پرتودرمانی (با استفاده از اشعهها) میتوان ژنوم آنها را تخریب کرد. این حقیقت در درمان سرطان کاربرد دارد؛ به طوریکه طی فرآیندی به نام Debulking یا جراحی کاهنده حجم یا حجم زدایی، بخش قابل توجهی از تومور با جراحی حذف شده که باعث خروج سلولهای توموری باقی مانده از فاز G0 به G1 میشود (زیرا با حذف بخش بزرگی از تومور، موادغذایی، اکسیژن و فاکتورهای رشد دردسترس خواهند بود). در نهایت شیمی درمانی و استفاده از اشعهها پس از فرایند حجم زدایی، منجر به حذف این سلولهای جدیدالورود به چرخه میشود.
در رابطه با سرعت چرخه سلولی این نکته جالب است که سریعترین سلولهای تقسیم شونده پستانداران در کشتهای سلولی، سلولهای اپیتلیال کریپتهای روده میباشند که میتوانند در طول ۹ تا ۱۰ ساعت چرخه خود را کامل کنند. از طرفی مشخص شده است که مدت زمان چرخه سلولی سلولهای بنیادی پوست موش در حال استراحت، میتواند بیش از ۲۰۰ ساعت به طول انجامد. بیشتر این تفاوتها در سرعت چرخه سلولی به دلیل مدت زمانهای مختلف فاز G1 است و فازهای M و S آنچنان تفاوت زمانی بین سلولهای گوناگون ندارند.
به طورکلی، سلولها در انتهای فازهای M و G2 حساسیت بالایی به اشعهها دارند و در اواخر فاز S بیشترین مقاومت را از خود نشان میدهند. برای سلولهایی که مدت زمان چرخه سلولی شان بیشتر است و یه فاز G1 طولانی دارند، یک پیک مقاومت دیگر در اواخر G1 وجود دارد. الگوی مقاومت و حساسیت، با سطوح ترکیبات سولفیدریل در سلول ارتباط دارد. ترکیبات سولفیدریل مواد طبیعی هستند که از سلولها در برابر آسیبهای پرتو محافظت میکنند و درنتیجه غلظت این ترکیبات در فاز S بالاست و در نزدیک میتوز به پایینترین حد خود میرسد.
در رابطه با آسیبهای DNA، مکانیسم نوترکیبی همولوگ یا HR یک فرایند دقیق ترمیم شکستهای دو رشتهای DNA میباشد. این سیستم ترمیم تقریباً در فاز G1 حضور ندارد، در فاز S بیشترین فعالیت را دارد و در G2/M کاهش مییابد.[۳۳] ترمیم اتصال انتهایی غیرهمولوگ یا NHEJ نیز یک سیستم تعمیر شکستهای دو رشتهای DNA در طول چرخه سلول است؛ اما دقت سیستم HR را نداشته و یکی از عوامل جهش زایی در سلول بهشمار میرود.
تکامل چرخه سلولی
[ویرایش]تکامل ژنوم
[ویرایش]چرخه سلول باید همه اجزای سلولی را دوبرابر کرده و آنها را بهطور مساوی بین دو سلول دختری، تقسیم کند. بسیاری از اجزای سلولی، مانند پروتئینها و ریبوزومها در طول چرخه سلولی (به جز فاز M) بهطور مداوم تولید میشوند. با اینحال، کروموزومها و عناصر مرتبط دیگر مانند مرکز سازماندهی میکروتوبولی یا MTOCs، تنها یکبار در طول چرخه سلول تقسیم و دوبرابر میشوند. یکی از ویژگیهای اصلی چرخه سلولی، توانایی هماهنگکردن همانندسازی مداوم و دوره ای اجزای مختلف سلولی است که با تشکیل ژنوم، تکامل یافت.
محیط پیش سلولی اطراف سلولهای اولیه، شامل RNAهای عملکردی و خود تکثیرشونده بود.[۳۴] این RNAها برای سلول میتوانستند نقشهای مختلفی را به دنبال داشته باشند؛ برای مثال سلول را به منابع غذایی رسانده یا آن را از منابع دور کند. در این محیط، بقا و تکثیر سلول نیازمند سنتز و تولید RNAهای مناسب بود. این پیش-سلولها باید با RNAهای انگلی، مسائل وراثت و کنترل تعداد کپیهای RNAهای خاص مقابله میکردند. (به این معنا که در آن شرایط، سلولهای والد جهت تولید سلولهای جدید که بتوانند بقا یابند، باید RNAهای عملکردی ضروری را به نسل بعد انتقال میدادند)[۳۴][۳۵]
برای حل این موضوع، جدایی RNAهای ژنومی از RNAهای عملکردی اتفاق افتاد.[۳۶] RNAهای ضروری برای بقا سلول که نیاز بود بصورت ارثی به نسلهای بعد نیز انتقال یابند، ادغام شده و ژنومی تک رشتهای از جنس RNA را شکل دادند. در این میان، RNAهای انگلی باید برای بقا، خود را در ژنوم تازه شکل گرفته ادغام میکردند. پس از جدایی RNAهای ژنومی از عملکردی، حال نیاز بود تا سنتز آنها نیز جدا شده و در زمانهای مختلف از عمر سلول رخ دهند. در نهایت، جایگزینی RNAژنومی با DNA که ساختار پایدارتری است، اجازه شکلگیری ژنومهای بزرگتر را داد.[۳۴]
تکامل سایکلین و کیناز وابسته به سایکلین
[ویرایش]پیشبرد چرخه سلولی توسط نواسانات غلظتی سایکلینها و در نتیجه برهمکنشهای مولکولی کینازهای وابسته به سایکلین مختلف (CDKs) رخ میدهد. در مخمر، تنها یک CDK (پروتئین Cdc28 در ساکارومایسیس سرویزیه و Cdc2 در شیزوساکارومایسیس پومبه) چرخه سلولی را کنترل میکند.[۳۷] با اینحال در جانوران، خانوادههایی از CDKها تکامل یافتهاند.[۳۸][۳۹] Cdk1 ورود سلول به میتوز را کنترل میکند و Cdk2، Cdk4 و Cdk6 ورود سلول به فاز S را تنظیم مینمایند. علیرغم تکامل خانواده CDK در جانوران، این پروتئینها دارای عملکردهای مرتبط یا اضافی هستند.[۴۰][۴۱][۴۲] برای مثال، موشهای ناک اوت شده سهگانه (که هر سه ژن Cdk2/4/6 آنها خاموش است) همچنان میتوانند چرخه سلولی را پیش ببرند.[۴۳] آزمایشات نشان داده است که ناک اوت ژن cdk1 کشنده میباشد؛ که نشان دهنده وجود یک کیناز اجدادی CDK1 است که چرخه سلولی را کنترل میکرده است.[۴۳]
گیاه آرابیدوپسیس تالیانا حاوی یک پروتئین همولوگ Cdk1 با نام CDKA;1 میباشد. با اینحال، گیاهان حاوی جهش در ژن cdka;1 میتوانند زنده بمانند[۴۴] و این برخلاف الگوی ضروری بودن CDK1 برای چرخه سلولی پشتتاژکان است (زیرا در پشتتاژکان یا opisthokonta که همان جانوران و قارچها هستند، Cdk1 مهمترین و ضروریترین کیناز برای چرخه سلولی است که ناک اوت آن منجر به مرگ ارگانیسم میشود).[۴۵] گیاهان همچنین حاوی گروه خاصی از CDKهای نوع B هستند که عملکردشان از نقش در تکوین تا تنظیم میتوز متفاوت است.[۴۶][۴۷]
تکامل نقطه وارسی G1/S
[ویرایش]
نقطه وارسی G1/S همان جایی است که سلول متعهد به پیشبرد تقسیم سلولی میشود. شبکه تنظیمی پیچیدهای منجر به گذر سلول از G1 به S میگردد. در میان پشتتاژکان، هم توالیهای پروتئینی واگرا و هم توپولوژیهای شبکه ای مشابهی یافت میشود.[۴۵][۴۸]
ورود به فاز S هم در مخمر و هم در جانوران توسط غلظت و سطوح دو تنظیم کننده مخالف هم کنترل میشود.[۴۵] شبکههایی که این فاکتورهای رونویسی را تنظیم میکنند در مخمر و جانوران، حلقههای دوگانه بازخورد منفی و حلقههای بازخورد مثبت هستند.[۴۵][۴۸][۴۹] یک مکانیسم تنظیمی اضافی برای تنظیم گذر G1/S در مخمر و جانوران، شامل فسفریلاسیون و دفسفریلاسیون کمپلکسهای سایکلین-CDK میشود.
بهطور کلی، مکانیسمهای مولکولی و تنظیمی چرخه از مخمر گرفته تا انسان بسیار در طول تکامل حفاظت شده است.[۵۰][۵۱] برای مثال در مخمر، پروتئین Whi5 باید با فسفریلاسیون توسط Cln3 سرکوب گردد تا فاکتور رونویسی SBF فعال شود؛[۵۲] و در جانوران مانند انسان نیز به همین منوال، پروتئین Rb باید توسط کمپلکس Cyclin D-CDK4/6 مهار گردد تا فاکتور رونویسی E2F فعال شود.[۵۳] هردو پروتئین Whi5 و Rb، رونویسی را با فراخواندن آنزیم هیستون داستیلاز برروی پروموترها مهار میکنند.[۵۴][۵۵] همچنین دو پروتئین جایگاههای فسفریلاسیونی برای CDKها داشته که توسط آنها فسفریله و مهار میشوند.[۵۶][۵۳] با اینحال، این دو پروتئین تشابه توالی خاصی ندارند.
مطالعات روی گیاه آرابیدوپسیس تالیانا دانش ما را از گذر G1/S در بین یوکاریوتها گسترش داد. گیاهان نیز شبکههای تنظیمی محافظت شدهای را با پشتتاژکان به اشتراک میگذارند و بسیاری از تنظیم کنندههای چرخه در گیاهان با تنظیم کنندههای جانوران همولوژی دارند.[۵۷] برای مثال، گیاهان نیز باید برای فعال شدن فاکتور E2F، پروتئین Rb را مهار کنند.[۵۸] این عناصر محافظت شده چرخه سلولی بین گیاهان و جانوران احتمالاً نشاندهنده وجود پروتئینهایی اجدادی در یوکاریوتها است. با اینکه مخمرها شبکه تنظیمی محافظت شدهای را با گیاهان و جانوران به اشتراک میگذارند، ماهیت بسیار متفاوت تنظیم کنندههای مخمر نشان میدهد که این جانداران با سرعت بالایی تحت دودمان مخمرها تکامل یافتهاند.[۴۵]
منابع
[ویرایش]- ↑ Wang, Jue D.; Levin, Petra A. (2009-11). "Metabolism, cell growth and the bacterial cell cycle". Nature Reviews Microbiology (به انگلیسی). 7 (11): 822–827. doi:10.1038/nrmicro2202. ISSN 1740-1526. PMC 2887316. PMID 19806155.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Smith, J. A.; Martin, L. (1973-04). "Do Cells Cycle?". Proceedings of the National Academy of Sciences (به انگلیسی). 70 (4): 1263–1267. doi:10.1073/pnas.70.4.1263. ISSN 0027-8424. PMC 433472. PMID 4515625.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Wu, Roy S.; Bonner, William M. (1981-12). "Separation of basal histone synthesis from S-phase histone synthesis in dividing cells". Cell (به انگلیسی). 27 (2): 321–330. doi:10.1016/0092-8674(81)90415-3.
{{cite journal}}: Check date values in:|date=(help) - ↑ Nelson, David M.; Ye, Xiaofen; Hall, Caitlin; Santos, Hidelita; Ma, Tianlin; Kao, Gary D.; Yen, Timothy J.; Harper, J. Wade; Adams, Peter D. (2002-11-01). "Coupling of DNA Synthesis and Histone Synthesis in S Phase Independent of Cyclin/cdk2 Activity". Molecular and Cellular Biology (به انگلیسی). 22 (21): 7459–7472. doi:10.1128/MCB.22.21.7459-7472.2002. ISSN 1098-5549. PMC 135676. PMID 12370293.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Cameron, Ivan L.; Greulich, Richard C. (1963-07-01). "EVIDENCE FOR AN ESSENTIALLY CONSTANT DURATION OF DNA SYNTHESIS IN RENEWING EPITHELIA OF THE ADULT MOUSE". The Journal of Cell Biology (به انگلیسی). 18 (1): 31–40. doi:10.1083/jcb.18.1.31. ISSN 1540-8140. PMC 2106275. PMID 14018040.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ De Souza, Colin P. C.; Osmani, Stephen A. (2007-09). "Mitosis, Not Just Open or Closed". Eukaryotic Cell (به انگلیسی). 6 (9): 1521–1527. doi:10.1128/EC.00178-07. ISSN 1535-9778. PMC 2043359. PMID 17660363.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Lilly, Mary A; Duronio, Robert J (2005-04-18). "New insights into cell cycle control from the Drosophila endocycle". Oncogene (به انگلیسی). 24 (17): 2765–2775. doi:10.1038/sj.onc.1208610. ISSN 0950-9232.
- ↑ Nigg, Erich A. (1995-06). "Cyclin‐dependent protein kinases: Key regulators of the eukaryotic cell cycle". BioEssays (به انگلیسی). 17 (6): 471–480. doi:10.1002/bies.950170603. ISSN 0265-9247.
{{cite journal}}: Check date values in:|date=(help) - ↑ «The Nobel Prize in Physiology or Medicine 2001». NobelPrize.org (به انگلیسی). دریافتشده در ۲۰۲۵-۰۱-۲۷.
- ↑ Spellman, Paul T.; Sherlock, Gavin; Zhang, Michael Q.; Iyer, Vishwanath R.; Anders, Kirk; Eisen, Michael B.; Brown, Patrick O.; Botstein, David; Futcher, Bruce (1998-12). Fink, Gerald R. (ed.). "Comprehensive Identification of Cell Cycle–regulated Genes of the Yeast Saccharomyces cerevisiae by Microarray Hybridization". Molecular Biology of the Cell (به انگلیسی). 9 (12): 3273–3297. doi:10.1091/mbc.9.12.3273. ISSN 1059-1524. PMC 25624. PMID 9843569.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Dong, Peng; Maddali, Manoj V.; Srimani, Jaydeep K.; Thélot, François; Nevins, Joseph R.; Mathey-Prevot, Bernard; You, Lingchong (2014-09-01). "Division of labour between Myc and G1 cyclins in cell cycle commitment and pace control". Nature Communications (به انگلیسی). 5 (1). doi:10.1038/ncomms5750. ISSN 2041-1723. PMC 4164785. PMID 25175461.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Mahmoudi, Morteza; Azadmanesh, Kayhan; Shokrgozar, Mohammad A.; Journeay, W. Shane; Laurent, Sophie (2011-05-11). "Effect of Nanoparticles on the Cell Life Cycle". Chemical Reviews (به انگلیسی). 111 (5): 3407–3432. doi:10.1021/cr1003166. ISSN 0009-2665.
- ↑ Goel, Shom; DeCristo, Molly J.; McAllister, Sandra S.; Zhao, Jean J. (2018-11). "CDK4/6 Inhibition in Cancer: Beyond Cell Cycle Arrest". Trends in Cell Biology (به انگلیسی). 28 (11): 911–925. doi:10.1016/j.tcb.2018.07.002. PMC 6689321. PMID 30061045.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Burkhart, Deborah L.; Sage, Julien (2008-09). "Cellular mechanisms of tumour suppression by the retinoblastoma gene". Nature Reviews Cancer (به انگلیسی). 8 (9): 671–682. doi:10.1038/nrc2399. ISSN 1474-175X. PMC 6996492. PMID 18650841.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Paternot, Sabine; Bockstaele, Laurence; Bisteau, Xavier; Kooken, Hugues; Coulonval, Katia; Roger, Pierre (2010-02-15). "Rb inactivation in cell cycle and cancer: The puzzle of highly regulated activating phosphorylation of CDK4 versus constitutively active CDK-activating kinase". Cell Cycle (به انگلیسی). 9 (4): 689–699. doi:10.4161/cc.9.4.10611. ISSN 1538-4101.
- ↑ Henley, Shauna A; Dick, Frederick A (2012). "The retinoblastoma family of proteins and their regulatory functions in the mammalian cell division cycle". Cell Division (به انگلیسی). 7 (1): 10. doi:10.1186/1747-1028-7-10. ISSN 1747-1028. PMC 3325851. PMID 22417103.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۱۷٫۰ ۱۷٫۱ ۱۷٫۲ Narasimha, Anil M; Kaulich, Manuel; Shapiro, Gary S; Choi, Yoon J; Sicinski, Piotr; Dowdy, Steven F (2014-06-04). "Cyclin D activates the Rb tumor suppressor by mono-phosphorylation". eLife (به انگلیسی). 3. doi:10.7554/eLife.02872. ISSN 2050-084X. PMC 4076869. PMID 24876129.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Dyson, Nicholas J. (2016-07-01). "RB1: a prototype tumor suppressor and an enigma". Genes & Development (به انگلیسی). 30 (13): 1492–1502. doi:10.1101/gad.282145.116. ISSN 0890-9369. PMC 4949322. PMID 27401552.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۱۹٫۰ ۱۹٫۱ Sanidas, Ioannis; Morris, Robert; Fella, Katerina A.; Rumde, Purva H.; Boukhali, Myriam; Tai, Eric C.; Ting, David T.; Lawrence, Michael S.; Haas, Wilhelm (2019-03). "A Code of Mono-phosphorylation Modulates the Function of RB". Molecular Cell (به انگلیسی). 73 (5): 985–1000.e6. doi:10.1016/j.molcel.2019.01.004. PMC 6424368. PMID 30711375.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۲۰٫۰ ۲۰٫۱ Topacio, Benjamin R.; Zatulovskiy, Evgeny; Cristea, Sandra; Xie, Shicong; Tambo, Carrie S.; Rubin, Seth M.; Sage, Julien; Kõivomägi, Mardo; Skotheim, Jan M. (2019-05). "Cyclin D-Cdk4,6 Drives Cell-Cycle Progression via the Retinoblastoma Protein's C-Terminal Helix". Molecular Cell (به انگلیسی). 74 (4): 758–770.e4. doi:10.1016/j.molcel.2019.03.020. PMC 6800134. PMID 30982746.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ «PharmaXChange.info - CDC25 PHOSPHATASES: A Potential Target for Novel Anticancer Agents». web.archive.org. ۲۰۱۶-۰۳-۰۳. دریافتشده در ۲۰۲۵-۰۱-۲۷.
- ↑ Sherr, Charles J.; Beach, David; Shapiro, Geoffrey I. (2016-04-01). "Targeting CDK4 and CDK6: From Discovery to Therapy". Cancer Discovery (به انگلیسی). 6 (4): 353–367. doi:10.1158/2159-8290.CD-15-0894. ISSN 2159-8274. PMC 4821753. PMID 26658964.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ O'Leary, Ben; Finn, Richard S.; Turner, Nicholas C. (2016-07). "Treating cancer with selective CDK4/6 inhibitors". Nature Reviews Clinical Oncology (به انگلیسی). 13 (7): 417–430. doi:10.1038/nrclinonc.2016.26. ISSN 1759-4774.
{{cite journal}}: Check date values in:|date=(help) - ↑ Bilgin, Burak; Sendur, Mehmet A.N.; Şener Dede, Didem; Akıncı, Muhammed Bülent; Yalçın, Bülent (2017-09-02). "A current and comprehensive review of cyclin-dependent kinase inhibitors for the treatment of metastatic breast cancer". Current Medical Research and Opinion (به انگلیسی). 33 (9): 1559–1569. doi:10.1080/03007995.2017.1348344. ISSN 0300-7995.
- ↑ Elledge, Stephen J. (1996-12-06). "Cell Cycle Checkpoints: Preventing an Identity Crisis". Science (به انگلیسی). 274 (5293): 1664–1672. doi:10.1126/science.274.5293.1664. ISSN 0036-8075.
- ↑ ۲۶٫۰ ۲۶٫۱ Vilenchik, Michael M.; Knudson, Alfred G. (2003-10-28). "Endogenous DNA double-strand breaks: Production, fidelity of repair, and induction of cancer". Proceedings of the National Academy of Sciences (به انگلیسی). 100 (22): 12871–12876. doi:10.1073/pnas.2135498100. ISSN 0027-8424. PMC 240711. PMID 14566050.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ LeMaire-Adkins, Renée; Radke, Kristi; Hunt, Patricia A. (1997-12-29). "Lack of Checkpoint Control at the Metaphase/Anaphase Transition: A Mechanism of Meiotic Nondisjunction in Mammalian Females". The Journal of Cell Biology (به انگلیسی). 139 (7): 1611–1619. doi:10.1083/jcb.139.7.1611. ISSN 0021-9525. PMC 2132649. PMID 9412457.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Sakaue-Sawano, Asako; Kurokawa, Hiroshi; Morimura, Toshifumi; Hanyu, Aki; Hama, Hiroshi; Osawa, Hatsuki; Kashiwagi, Saori; Fukami, Kiyoko; Miyata, Takaki (2008-02). "Visualizing Spatiotemporal Dynamics of Multicellular Cell-Cycle Progression". Cell (به انگلیسی). 132 (3): 487–498. doi:10.1016/j.cell.2007.12.033.
{{cite journal}}: Check date values in:|date=(help) - ↑ Rodriguez, Erik A; Tran, Geraldine N; Gross, Larry A; Crisp, Jessica L; Shu, Xiaokun; Lin, John Y; Tsien, Roger Y (2016-09). "A far-red fluorescent protein evolved from a cyanobacterial phycobiliprotein". Nature Methods (به انگلیسی). 13 (9): 763–769. doi:10.1038/nmeth.3935. ISSN 1548-7091. PMC 5007177. PMID 27479328.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Salmenov, Rustem; Mummery, Christine; ter Huurne, Menno (2024-10). "Cell cycle visualization tools to study cardiomyocyte proliferation in real-time". Open Biology (به انگلیسی). 14 (10). doi:10.1098/rsob.240167. ISSN 2046-2441. PMC PMC11461051. PMID 39378987.
{{cite journal}}: Check|pmc=value (help); Check|pmid=value (help); Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Champeris Tsaniras, S.; Kanellakis, N.; Symeonidou, I.E.; Nikolopoulou, P.; Lygerou, Z.; Taraviras, S. (2014-06). "Licensing of DNA replication, cancer, pluripotency and differentiation: An interlinked world?". Seminars in Cell & Developmental Biology (به انگلیسی). 30: 174–180. doi:10.1016/j.semcdb.2014.03.013.
{{cite journal}}: Check date values in:|date=(help) - ↑ Baserga, R. (1965-06). "THE RELATIONSHIP OF THE CELL CYCLE TO TUMOR GROWTH AND CONTROL OF CELL DIVISION: A REVIEW". Cancer Research. 25: 581–595. ISSN 0008-5472. PMID 14347544.
{{cite journal}}: Check date values in:|date=(help) - ↑ Mao, Zhiyong; Bozzella, Michael; Seluanov, Andrei; Gorbunova, Vera (2008-09-15). "DNA repair by nonhomologous end joining and homologous recombination during cell cycle in human cells". Cell Cycle (به انگلیسی). 7 (18): 2902–2906. doi:10.4161/cc.7.18.6679. ISSN 1538-4101. PMC 2754209. PMID 18769152.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۳۴٫۰ ۳۴٫۱ ۳۴٫۲ "Evolution of the cell cycle". Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences (به انگلیسی). 349 (1329): 271–281. 1995-09-29. doi:10.1098/rstb.1995.0113. ISSN 0962-8436.
- ↑ Cavalier‐Smith, T. (1987-07). "The Origin of Eukaryote and Archaebacterial Cells". Annals of the New York Academy of Sciences (به انگلیسی). 503 (1): 17–54. doi:10.1111/j.1749-6632.1987.tb40596.x. ISSN 0077-8923.
{{cite journal}}: Check date values in:|date=(help) - ↑ Maizels, N; Weiner, A M (1994-07-19). "Phylogeny from function: evidence from the molecular fossil record that tRNA originated in replication, not translation". Proceedings of the National Academy of Sciences (به انگلیسی). 91 (15): 6729–6734. doi:10.1073/pnas.91.15.6729. ISSN 0027-8424. PMC 44276. PMID 8041690.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Morgan, David O. (1997-11). "CYCLIN-DEPENDENT KINASES: Engines, Clocks, and Microprocessors". Annual Review of Cell and Developmental Biology (به انگلیسی). 13 (1): 261–291. doi:10.1146/annurev.cellbio.13.1.261. ISSN 1081-0706.
{{cite journal}}: Check date values in:|date=(help) - ↑ Malumbres, Marcos; Harlow, Edward; Hunt, Tim; Hunter, Tony; Lahti, Jill M.; Manning, Gerard; Morgan, David O.; Tsai, Li-Huei; Wolgemuth, Debra J. (2009-11). "Cyclin-dependent kinases: a family portrait". Nature Cell Biology (به انگلیسی). 11 (11): 1275–1276. doi:10.1038/ncb1109-1275. ISSN 1465-7392. PMC 2914104. PMID 19884882.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Satyanarayana, A; Kaldis, P (2009-08-20). "Mammalian cell-cycle regulation: several Cdks, numerous cyclins and diverse compensatory mechanisms". Oncogene (به انگلیسی). 28 (33): 2925–2939. doi:10.1038/onc.2009.170. ISSN 0950-9232.
- ↑ Barrière, Cédric; Santamaría, David; Cerqueira, Antonio; Galán, Javier; Martín, Alberto; Ortega, Sagrario; Malumbres, Marcos; Dubus, Pierre; Barbacid, Mariano (2007-06). "Mice thrive without Cdk4 and Cdk2". Molecular Oncology (به انگلیسی). 1 (1): 72–83. doi:10.1016/j.molonc.2007.03.001. ISSN 1574-7891. PMC 5543859. PMID 19383288.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Ortega, Sagrario; Prieto, Ignacio; Odajima, Junko; Martín, Alberto; Dubus, Pierre; Sotillo, Rocio; Barbero, Jose Luis; Malumbres, Marcos; Barbacid, Mariano (2003-09). "Cyclin-dependent kinase 2 is essential for meiosis but not for mitotic cell division in mice". Nature Genetics (به انگلیسی). 35 (1): 25–31. doi:10.1038/ng1232. ISSN 1061-4036.
{{cite journal}}: Check date values in:|date=(help) - ↑ Aleem, Eiman; Kiyokawa, Hiroaki; Kaldis, Philipp (2005-08). "Cdc2–cyclin E complexes regulate the G1/S phase transition". Nature Cell Biology (به انگلیسی). 7 (8): 831–836. doi:10.1038/ncb1284. ISSN 1465-7392.
{{cite journal}}: Check date values in:|date=(help) - ↑ ۴۳٫۰ ۴۳٫۱ Santamaría, David; Barrière, Cédric; Cerqueira, Antonio; Hunt, Sarah; Tardy, Claudine; Newton, Kathryn; Cáceres, Javier F.; Dubus, Pierre; Malumbres, Marcos (2007-08-16). "Cdk1 is sufficient to drive the mammalian cell cycle". Nature (به انگلیسی). 448 (7155): 811–815. doi:10.1038/nature06046. ISSN 0028-0836.
- ↑ Nowack, Moritz K.; Harashima, Hirofumi; Dissmeyer, Nico; Zhao, Xin'Ai; Bouyer, Daniel; Weimer, Annika K.; De Winter, Freya; Yang, Fang; Schnittger, Arp (2012-05). "Genetic Framework of Cyclin-Dependent Kinase Function in Arabidopsis". Developmental Cell (به انگلیسی). 22 (5): 1030–1040. doi:10.1016/j.devcel.2012.02.015.
{{cite journal}}: Check date values in:|date=(help) - ↑ ۴۵٫۰ ۴۵٫۱ ۴۵٫۲ ۴۵٫۳ ۴۵٫۴ ۴۵٫۵ Harashima, Hirofumi; Dissmeyer, Nico; Schnittger, Arp (2013-07). "Cell cycle control across the eukaryotic kingdom". Trends in Cell Biology (به انگلیسی). 23 (7): 345–356. doi:10.1016/j.tcb.2013.03.002.
{{cite journal}}: Check date values in:|date=(help) - ↑ Boudolf, Véronique; Barrôco, Rosa; Engler, Janice de Almeida; Verkest, Aurine; Beeckman, Tom; Naudts, Mirande; Inzé, Dirk; De Veylder, Lieven (2004-04). "B1-Type Cyclin-Dependent Kinases Are Essential for the Formation of Stomatal Complexes in Arabidopsis thaliana". The Plant Cell (به انگلیسی). 16 (4): 945–955. doi:10.1105/tpc.021774. ISSN 1040-4651. PMC 412868. PMID 15031414.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Andersen, Stig Uggerhøj; Buechel, Sabine; Zhao, Zhong; Ljung, Karin; Novák, Ondřej; Busch, Wolfgang; Schuster, Christoph; Lohmann, Jan U. (2008-02-26). "Requirement of B2-Type Cyclin-Dependent Kinases for Meristem Integrity in Arabidopsis thaliana". The Plant Cell (به انگلیسی). 20 (1): 88–100. doi:10.1105/tpc.107.054676. ISSN 1532-298X. PMC 2254925. PMID 18223038.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۴۸٫۰ ۴۸٫۱ Cross, Frederick R.; Buchler, Nicolas E.; Skotheim, Jan M. (2011-12-27). "Evolution of networks and sequences in eukaryotic cell cycle control". Philosophical Transactions of the Royal Society B: Biological Sciences (به انگلیسی). 366 (1584): 3532–3544. doi:10.1098/rstb.2011.0078. ISSN 0962-8436. PMC 3203458. PMID 22084380.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Skotheim, Jan M.; Di Talia, Stefano; Siggia, Eric D.; Cross, Frederick R. (2008-07-17). "Positive feedback of G1 cyclins ensures coherent cell cycle entry". Nature (به انگلیسی). 454 (7202): 291–296. doi:10.1038/nature07118. ISSN 0028-0836. PMC 2606905. PMID 18633409.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Ferrell, James E (2002-04). "Self-perpetuating states in signal transduction: positive feedback, double-negative feedback and bistability". Current Opinion in Cell Biology (به انگلیسی). 14 (2): 140–148. doi:10.1016/S0955-0674(02)00314-9.
{{cite journal}}: Check date values in:|date=(help) - ↑ Venta, Rainis; Valk, Ervin; Kõivomägi, Mardo; Loog, Mart (2012). "Double-negative feedback between S-phase cyclin-CDK and CKI generates abruptness in the G1/S switch". Frontiers in Physiology. 3. doi:10.3389/fphys.2012.00459. ISSN 1664-042X. PMC 3515773. PMID 23230424.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Eser, Umut; Falleur-Fettig, Melody; Johnson, Amy; Skotheim, Jan M. (2011-08). "Commitment to a Cellular Transition Precedes Genome-wide Transcriptional Change". Molecular Cell (به انگلیسی). 43 (4): 515–527. doi:10.1016/j.molcel.2011.06.024. PMC 3160620. PMID 21855792.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ ۵۳٫۰ ۵۳٫۱ Narasimha, Anil M; Kaulich, Manuel; Shapiro, Gary S; Choi, Yoon J; Sicinski, Piotr; Dowdy, Steven F (2014-06-04). "Cyclin D activates the Rb tumor suppressor by mono-phosphorylation". eLife (به انگلیسی). 3. doi:10.7554/eLife.02872. ISSN 2050-084X. PMC 4076869. PMID 24876129.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Harbour, J.William; Luo, Robin X; Santi, Angeline Dei; Postigo, Antonio A; Dean, Douglas C (1999-09). "Cdk Phosphorylation Triggers Sequential Intramolecular Interactions that Progressively Block Rb Functions as Cells Move through G1". Cell (به انگلیسی). 98 (6): 859–869. doi:10.1016/S0092-8674(00)81519-6.
{{cite journal}}: Check date values in:|date=(help) - ↑ Takahata, Shinya; Yu, Yaxin; Stillman, David J (2009-11-04). "The E2F functional analogue SBF recruits the Rpd3(L) HDAC, via Whi5 and Stb1, and the FACT chromatin reorganizer, to yeast G1 cyclin promoters". The EMBO Journal. 28 (21): 3378–3389. doi:10.1038/emboj.2009.270. ISSN 0261-4189. PMC 2776103. PMID 19745812.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ de Bruin, Robertus A.M; McDonald, W.Hayes; Kalashnikova, Tatyana I; Yates, John; Wittenberg, Curt (2004-06). "Cln3 Activates G1-Specific Transcription via Phosphorylation of the SBF Bound Repressor Whi5". Cell (به انگلیسی). 117 (7): 887–898. doi:10.1016/j.cell.2004.05.025.
{{cite journal}}: Check date values in:|date=(help) - ↑ Zhao, Xin'Ai; Harashima, Hirofumi; Dissmeyer, Nico; Pusch, Stefan; Weimer, Annika K.; Bramsiepe, Jonathan; Bouyer, Daniel; Rademacher, Svenja; Nowack, Moritz K. (2012-08-02). Palanivelu, Ravishankar (ed.). "A General G1/S-Phase Cell-Cycle Control Module in the Flowering Plant Arabidopsis thaliana". PLoS Genetics (به انگلیسی). 8 (8): e1002847. doi:10.1371/journal.pgen.1002847. ISSN 1553-7404. PMC 3410867. PMID 22879821.
{{cite journal}}: نگهداری یادکرد:فرمت پارامتر PMC (link) - ↑ Weimer, Annika K.; Nowack, Moritz K.; Bouyer, Daniel; Zhao, Xin’Ai; Harashima, Hirofumi; Naseer, Sadaf; De Winter, Freya; Dissmeyer, Nico; Geldner, Niko (2012-10). "RETINOBLASTOMA RELATED1 Regulates Asymmetric Cell Divisions in Arabidopsis". The Plant Cell (به انگلیسی). 24 (10): 4083–4095. doi:10.1105/tpc.112.104620. ISSN 1040-4651. PMC 3517237. PMID 23104828.
{{cite journal}}: Check date values in:|date=(help)نگهداری یادکرد:فرمت پارامتر PMC (link)
